八年级常见化学式和化学方程式.docx
《八年级常见化学式和化学方程式.docx》由会员分享,可在线阅读,更多相关《八年级常见化学式和化学方程式.docx(17页珍藏版)》请在冰点文库上搜索。
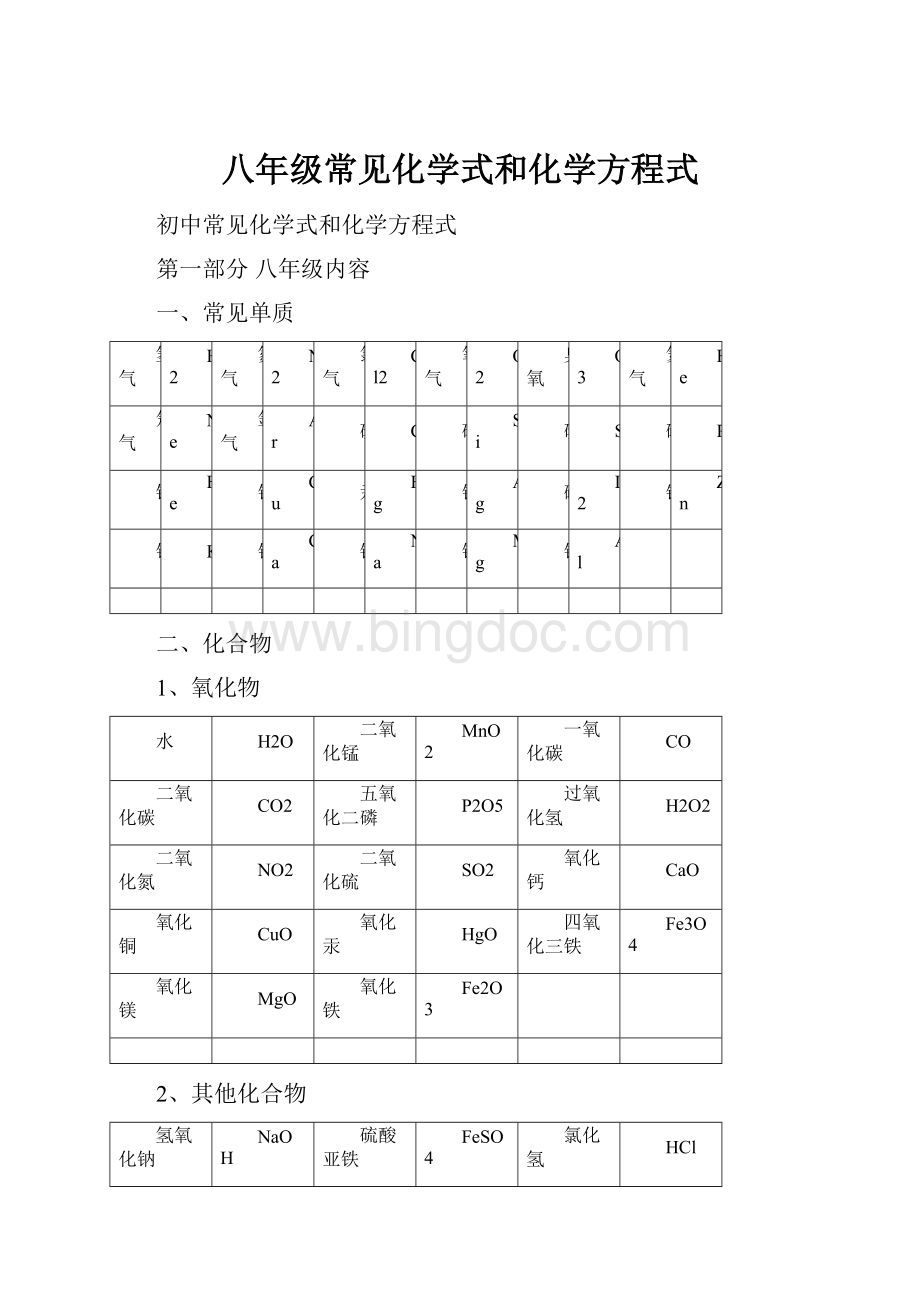
八年级常见化学式和化学方程式
初中常见化学式和化学方程式
第一部分八年级内容
一、常见单质
氢气
H2
氮气
N2
氯气
Cl2
氧气
O2
臭氧
O3
氦气
He
氖气
Ne
氩气
Ar
碳
C
硅
Si
硫
S
磷
P
铁
Fe
铜
Cu
汞
Hg
银
Ag
碘
I2
锌
Zn
钾
K
钙
Ca
钠
Na
镁
Mg
铝
Al
二、化合物
1、氧化物
水
H2O
二氧化锰
MnO2
一氧化碳
CO
二氧化碳
CO2
五氧化二磷
P2O5
过氧化氢
H2O2
二氧化氮
NO2
二氧化硫
SO2
氧化钙
CaO
氧化铜
CuO
氧化汞
HgO
四氧化三铁
Fe3O4
氧化镁
MgO
氧化铁
Fe2O3
2、其他化合物
氢氧化钠
NaOH
硫酸亚铁
FeSO4
氯化氢
HCl
碳酸
H2CO3
碳酸钙
CaCO3
稀盐酸
HCl
碳酸钙
CaCO3
硫酸铜
CuSO4
氢氧化钙
Ca(OH)2
高锰酸钾
KMnO4
锰酸钾
K2MnO4
氯酸钾
KClO3
氯化钙
CaCl2
氨气
NH3
氢氧化铜
Cu(OH)2
氯化钠
NaCl
氯化钾
KCl
3、常见有机化合物
甲烷
CH4
乙醇
C2H5OH
三、常见反应的化学方程式
1.镁在空气中燃烧:
2Mg+O2点燃2MgO
2.铁在氧气中燃烧:
3Fe+2O2点燃Fe3O4
3.氢气中空气中燃烧:
2H2+O2点燃2H2O
4.红磷在空气中燃烧:
4P+5O2点燃2P2O5
5.硫粉在空气中燃烧:
S+O2点燃SO2
6.碳在氧气中充分燃烧:
C+O2点燃CO2
7.碳在氧气中不充分燃烧:
2C+O2点燃2CO
8.一氧化碳在氧气中燃烧:
2CO+O2点燃2CO2
9.甲烷在空气中燃烧:
CH4+2O2点燃CO2+2H2O
10.酒精在空气中燃烧:
C2H5OH+3O2点燃2CO2+3H2O
11.水在直流电的作用下分解:
2H2O通电2H2↑+O2↑
12.过氧化氢的分解:
2H2O2MnO22H2O+O2↑
13.加热氯酸钾(有少量的二氧化锰):
2KClO3△2KCl+3O2↑
14.加热高锰酸钾:
2KMnO4△K2MnO4+MnO2+O2↑
15.碳酸不稳定而分解:
H2CO3H2O+CO2↑;H2CO3△H2O+CO2↑
16.高温煅烧石灰石(工业制CO2):
CaCO3高温CaO+CO2↑
17.氢气还原氧化铜:
H2+CuO△Cu+H2O
18.木炭还原氧化铜:
C+2CuO高温2Cu+CO2↑
19.焦炭还原氧化铁:
3C+2Fe2O3高温4Fe+3CO2↑
20.焦炭还原四氧化三铁:
2C+Fe3O4高温3Fe+2CO2↑
21.一氧化碳还原氧化铜:
CO+CuO△Cu+CO2
22.一氧化碳还原氧化铁:
3CO+Fe2O3高温2Fe+3CO2
23.一氧化碳还原四氧化三铁:
4CO+Fe3O4高温3Fe+4CO2
24.锌和稀盐酸(实验室制氢气):
Zn+2HCl===ZnCl2+H2↑
25.铁和硫酸铜溶液反应:
Fe+CuSO4===FeSO4+Cu
26.检验CO2:
Ca(OH)2+CO2====CaCO3↓+H2O
27.大理石(或石灰石)与稀盐酸反应(实验室制CO2):
CaCO3+2HCl===CaCl2+H2O+CO2↑
28.氢氧化钠与硫酸铜:
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
29.二氧化碳溶解于水:
CO2+H2O===H2CO3
30.二氧化硫溶于水与水反应:
SO2+H2O====H2SO3
附录一:
物质颜色
(1)固体物质的颜色
白色固体:
CuSO4、MgO、P2O5、Ca(OH)2、CaCO3、KClO3、KCl、NaCl、Na2CO3等
红色固体:
Cu、Fe2O3
黑色固体:
C(木炭)、CuO、MnO2、Fe3O4、铁粉
蓝色固体:
CuSO4·5H2O
淡黄色固体:
S
淡蓝色固体:
液态氧气
(2)液体的颜色
蓝色溶液:
CuSO4溶液 浅绿色溶液:
FeSO4溶液
附录二、几种常见气体的检验
附录三基本概念:
1、化学变化:
生成了其它物质的变化
2、物理变化:
没有生成其它物质的变化
3、物理性质:
不需要发生化学变化就表现出来的性质
(如:
颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:
物质在化学变化中表现出来的性质
(如:
可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:
由一种物质组成
6、混合物:
由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:
具有相同核电荷数(即质子数)的一类原子的总称
8、原子:
是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:
是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:
由同种元素组成的纯净物
11、化合物:
由不同种元素组成的纯净物
12、氧化物:
由两种元素组成的化合物中,其中有一种元素是氧元素
13、化学式:
用元素符号来表示物质组成的式子
14、相对原子质量:
以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值。
某原子的相对原子质量=
相对原子质量≈质子数+中子数
15、相对分子质量:
化学式中各原子的相对原子质量的总和
16、离子:
带有电荷的原子或原子团
17、原子的结构:
原子、离子的关系:
注:
在离子里,核电荷数=质子数≠核外电子数
18、二种化学反应基本类型:
①化合反应:
由两种或两种以上物质生成一种物质的反应如:
A+B=AB
②分解反应:
由一种物质生成两种或两种以上其它物质的反应如:
AB=A+B
三者的关系:
缓慢氧化会引起自燃,两者都是氧化反应
19、还原反应:
在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)
氧化反应:
物质跟氧发生的化学反应(不属于化学的基本反应类型)
缓慢氧化:
进行得很慢的,甚至不容易察觉的氧化反应
自燃:
由缓慢氧化而引起的自发燃烧
20、催化剂:
在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质
(注:
2H2O2===2H2O+O2↑此反应MnO2是催化剂)
21、质量守恒定律:
参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。
微观实质:
反应的前后,原子的数目、种类、质量都不变;元素的种类也不变
22、燃烧:
可燃物跟氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:
①可燃物;
②氧气(或空气);
③可燃物的温度要达到着火点。
附录四基本知识、理论:
1、空气的成分:
氮气占78%,氧气占21%,稀有气体占%,二氧化碳占%,其它气体与杂质占%
2、主要的空气污染物:
NO2、CO、SO2等物质
3、常见的酸根离子:
SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、PO43-(磷酸根)、Cl-(氯离子)、HCO3-(碳酸氢根)、OH-(氢氧根)、NH4+(铵根或铵离子)
4、化学式和化合价:
(1)化学式的意义:
①宏观意义:
a.表示一种物质;
b.表示该物质的元素组成;
②微观意义:
a.表示该物质的一个分子;
b.表示该物质的分子构成;
③量的意义:
a.表示物质的一个分子中各原子个数比;
b.表示组成物质的各元素质量比。
(2)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:
化合物中正负化合价代数和为零。
②根据元素化合价写化学式的步骤:
a.写出元素符号,正价元素写在左,负价元素写在右
b.标出元素化合价;看元素化合价是否有约数,并约成最简比;
c.十字交叉为个数(化成最简比),写在元素符号右下角
5、核外电子排布:
1-20号元素(要记住元素的名称及原子结构示意图)
注:
元素的化学性质取决于最外层电子数
6、书写化学方程式的原则:
①以客观事实为依据;
②遵循质量守恒定律
7、物质的结构:
物质
化合物
存在状态
表示方法
单质
元素符号
元素
宏观组成
相对质量—相对原子质量
相对质量—相对分子质量
微观构成
核外电子(—)
表示方法
元素符号
质子(+)
中子
化学式
由原子构成
结构
表示方法
原子
分子
原子核
分类
无机化合物
纯净物
单质
金属单质
非金属单质
稀有气体
碱
氧化物
酸
有机化合物
化合物
盐
混合物
离子
带电的原子或原子团
表示方法
离子符号
相对质量—各原子的相对原子质量和
8、化学符号的意义及书写:
(1)化学符号的意义:
a.元素符号:
①表示一种元素;②表示该元素的一个原子。
(有原子构成的物质,元素符号还可以表示该物质)
b.化学式:
本知识点的第5点第
(1)小点
c.离子符号:
表示1个该离子
d.化合价符号:
表示元素或原子团的化合价。
当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。
(2)化学符号的书写:
a.原子的表示方法:
用元素符号表示
b.分子的表示方法:
用化学式表示
c.离子的表示方法:
用离子符号表示
d.化合价的表示方法:
用化合价符号表示
9、原子、分子、离子、元素和物质(纯净物和混合物)间的关系:
10、制取气体常用的发生装置和收集装置:
发生装置
收集装置
[固(+固)]
[固+液]
简易装置
[固+液]
排水法
向上
排空气法
向下
排空气法
11、三种气体的实验室制法以及它们的区别:
气体
氧气(O2)
氢气(H2)
二氧化碳(CO2)
药品
高锰酸钾(KMnO4)、氯酸钾或双氧水(H2O2)和二氧化锰(MnO2)
[固(+固)]或[固+液]
锌粒(Zn)和盐酸(HCl)或稀硫酸(H2SO4)
[固+液]
石灰石(大理石)(CaCO3)和稀盐酸(HCl)
[固+液]
检验
用带火星的木条,伸进集气瓶,若木条复燃,是氧气
点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气
通入澄清的石灰水,看是否变浑浊,若浑浊则是CO2。
收集方法
①排水法(不易溶于水)②瓶口向上排空气法(密度比空气略大)
①排水法(难溶于水)②瓶口向下排空气法(密度比空气小)
①瓶口向上排空气法
(密度比空气大)
(不能用排水法收集)
验满
用带火星的木条,放在集气瓶口,若木条复燃,氧气已满
<1>用拇指堵住集满氢气的试管口;<2>靠近火焰,移开拇指点火
若声音较小,氢气已纯;若有尖锐的爆鸣声,则氢气不纯
用燃着的木条,放在集气瓶口,若火焰熄灭,则已满
放置
正放
倒放
正放
12、一些重要常见气体的性质(物理性质和化学性质)
物质
物理性质
(通常状况下)
化学性质
用途
氧气
(O2)
无色无味的气体,不易溶于水,密度比空气略大
氧化性(能与C、Fe、S、P等物质发生反应)
供给呼吸,
支持燃烧
氢气
(H2)
无色无味的气体,难溶于水,密度比空气小,是最轻的气体。
1可燃性
1、填充气、飞舰(密度比空气小)
2、合成氨、制盐酸
3、气焊、气割(可燃性)
4、提炼金属(还原性)
2还原性
二氧化碳(CO2)
无色无味的气体,密度大于空气,能溶于水,固体的CO2叫“干冰”。
能与水反应
1、用于灭火(应用其不可燃烧,也不支持燃烧的性质)
2、制饮料、化肥和纯碱
能与氢氧化钙反应(鉴别CO2)
一氧碳(CO)
无色无味气体,密度比空气略小,难溶于水,有毒气体
1可燃性
②还原(跟血液中血红蛋白结合,破坏血液输氧的能力)性
作作燃料
冶炼金属
13.解计算题:
计算题的类型有:
①化合物中某元素质量分数的计算
②根据化学方程式进行计算
③由①和②两种类型混合在一起计算
(一)、、化合物(纯净物)中某元素质量分数的计算
某元素质量分数=╳100%
(二)、混合物中某化合物的质量分数计算(纯度)
化合物的质量分数=╳100%
(三)、混合物中某元素质量分数的计算(含量)
某元素质量分数=╳100%
某元素质量分数(含量)=化合物的质量分数(纯度)╳该元素在化合物中的质量分数(已知)
(四)、根据化学方程式计算
1、审题:
看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。
找出解此题的有关公式。
2、根据化学方程式计算的解题步骤:
①设未知量
②书写出正确的化学方程式
③写出有关物质的相对分子质量、已知量、未知量
④列出比例式,求解
⑤答。
附录五八年级常见反应现象归纳
1.硫酸铜溶液和氢氧化钠溶液的反应:
2.实验室制取二氧化碳:
在蓝色溶液中产生蓝色沉淀;溶液由蓝色变为无色(或蓝色变浅)
白色固体表面产生气泡,固体逐渐减少或消失
3.汞在空气中加热:
4.氧化汞受热分解:
银白色液体表面生成红色固体。
红色固体中生成银白色液体。
5.红磷(或白磷)在空气中燃烧:
6.硫粉在空气(或氧气)中燃烧
红色固体燃烧,发出黄白色火焰,发光,放热,产生大量的白烟,生成白色固体。
淡黄色固体在空气中燃烧发出微弱的淡蓝色火焰,放热,产生有刺激性气味的气体;
7.细铁丝在氧气中燃烧:
淡黄色固体在氧气中燃烧先熔化后燃烧,发出明亮的蓝紫色火焰,放热,产生有刺激性气味的气体。
银白色固体在氧气中剧烈燃烧,火星四射,放热,生成黑色固体。
8.氢气在空气(或氧气)中燃烧:
9.通电分解水:
无色气体燃烧,发出淡蓝色火焰,放热。
罩在火焰上的干冷烧杯内壁有水珠产生。
(若没有烧杯不用答)
在两个电极附近均产生气泡,气体汇集到试管底部,负极管中产生的气体体积是正极产生气体体积比为2:
1
11.镁条在空气(或氧气)中燃烧:
12.氢气还原氧化铜:
银白色固体燃烧发出耀眼的白光,放热,产生白烟,生成白色固体。
试管中的固体由黑色变为光亮紫红色;试管口有水滴出现。
12.单质碳还原氧化铁:
14.单质碳还原氧化铜:
试管中红色固体中有黑色固体产生;澄清的石灰水中导气管口冒出气泡且变白色浑浊。
试管中黑色固体中有紫红色固体产生;澄清的石灰水中导气管口有气泡冒出且变白色浑浊
15.二氧化碳与澄清的石灰水的反应:
16.一氧化碳在空气(或氧气)中燃烧:
澄清的石灰水变白色浑浊(若通入还应提到导管口产生无色气泡)。
无色气体燃烧,发出蓝色火焰,放热;罩在火焰上的小烧杯内壁的内涂澄清石灰水变白色浑浊。
17.一氧化碳还原氧化铜:
18.甲烷在空气中燃烧:
玻璃管中的黑色固体中产生紫红色固体;澄清的石灰水中导管口产生气泡,澄清的石灰水变白色浑浊;尾端的导管口气体燃烧产生蓝色火焰放热。
无色气体燃烧,产生明亮蓝色火焰,放热;罩在火焰上干冷烧杯内壁有水珠出现;向烧杯中倒入澄清石灰水振荡后出现白色浑浊。
19.课本128页探究燃烧条件的实验:
铜片上的白色固体燃烧,发光,发出黄白色火焰,放出大量的热,产生大量白烟,生成白色固体,铜片上的红色固体不燃烧,热水中的白色固体熔化,不燃烧
20.一氧化碳还原氧化铁(高炉炼铁):
玻璃管中的红色固体中产生黑色固体;澄清的石灰水中导管口产生气泡冒出,澄清的石灰水变白色浑浊;装置尾端的导管口气体燃烧产生蓝色火焰,放热。
21.将CO2通入紫色石蕊溶液中:
溶液由紫色变为红色。
附录六八年级化学方程式网络图
一、氧系网络
① ;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ ;
⑧ ;
⑨ ;
⑩ ;
⑾ ;
⑿ ;
⒀ ;
⒁ ;
⒂ ;
二、碳系网络
⑴
⑵可燃性
还原性
⑶可燃性
还原性
⑷
⑸
⑹
⑺
⑻实验室制二氧化碳
工业制二氧化碳
⑼
⑽
⑾
⑿