高中化学杭州市高考命题比赛试题13.docx
《高中化学杭州市高考命题比赛试题13.docx》由会员分享,可在线阅读,更多相关《高中化学杭州市高考命题比赛试题13.docx(27页珍藏版)》请在冰点文库上搜索。
高中化学杭州市高考命题比赛试题13
2018年浙江省普通高校招生选考科目模拟考试
细目表
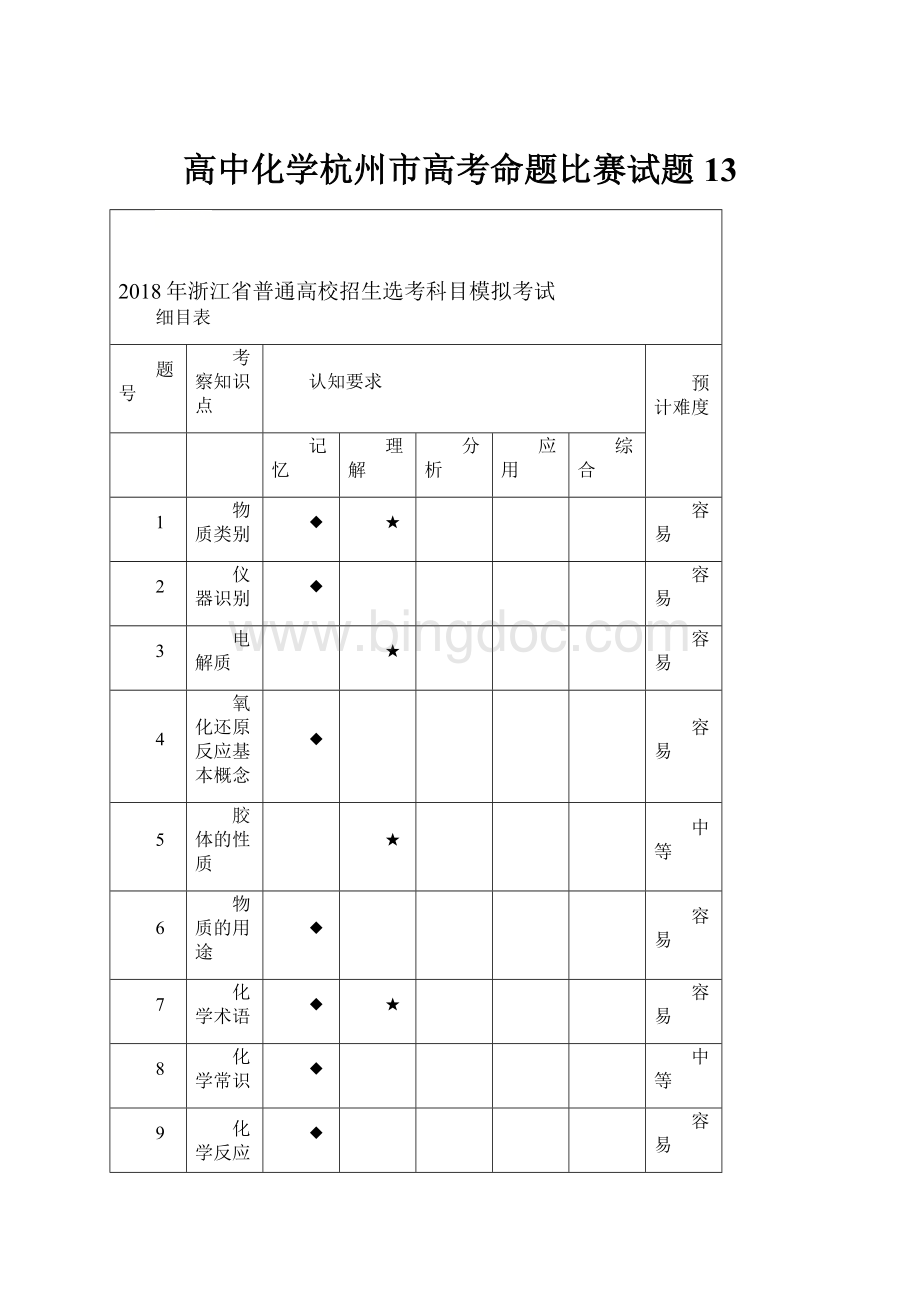
题号
考察知识点
认知要求
预计难度
记忆
理解
分析
应用
综合
1
物质类别
◆
★
容易
2
仪器识别
◆
容易
3
电解质
★
容易
4
氧化还原反应基本概念
◆
容易
5
胶体的性质
★
中等
6
物质的用途
◆
容易
7
化学术语
◆
★
容易
8
化学常识
◆
中等
9
化学反应中的热量
◆
容易
10
实验操作
◆
容易
11
有机基本概念
容易
12
化学平衡
中等
13
离子方程式
★
中等
14
元素周期表
★
●
中等
15
有机物的性质
◆
★
●
中等
16
食品中有机物性质
◆
容易
17
原电池、电解池
★
●
中等
18
水溶液中离子浓度
★
●
较难
19
化学反应中的能量变化
◆
★
●
容易
20
微粒间相互作用力
◆
容易
21
化学反应速率
◆
中等
22
阿伏伽德罗常数
◆
★
●
中等
23
酸碱中和滴定
◆
★
●
中等
24
物质的制备
★
▲
较难
25
离子推断
★
●
难
26
简单有机推理
◆
★
中等
27
无机推断
★
●
▲
■
难
28
物质制备性质探究实验
★
●
▲
■
较难
29
无机样品原理分析
★
●
▲
■
较难
30
化学反应原理
◆
★
●
▲
■
难
31
实验化学
◆
★
●
▲
■
难
32
基础有机化学
◆
★
●
▲
■
难
2018年浙江省普通高校招生选考科目模拟考试
化学
本试题卷分选择题和非选择题两部分,满分100分,考试时间90分钟。
其中加试题部分为30分,用【加试题】标出。
考生注意:
1.答题前,请务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔分别填写在试题卷和答题纸规定的位置上。
2.答题时,请按照答题纸上“注意事项”的要求,在答题纸相应的位置上规范作答,在本试题卷上作答一律无效
3.非选择题的答案必须使用黑色字迹的签字笔或钢笔在答题纸上相应区域内,作图时可先使用2B铅笔,确定后必须使用黑色字迹的签字笔或钢笔描黑。
4.可能用到的相对原子质量H-1C-12N-14O-16Na-23Li-8S-32Cl-35.5Fe-56Cu-64
选择题部分
一、选择题(本题共25小题,每小题2分,共50分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.(原创)下列属于酸性氧化物的是()
A.SiO2B.Na2O2C.CaOD.NO2
2.(原创)下列仪器可用于干燥的是()
A.
B.
C.D.
3.(原创)下列物质中属于弱电解质的是()
A.Ba2CO3 B.硫酸 C.HF D.CO2
4.(原创)反应A12O3+N2+3C=2A1N+3CO中的氧化剂是()
A.A12O3B.N2C.CD.CO
5.(原创)下列分散系能用半透膜分离出分散质的是()
A.NaHSO4B.生理盐水C.淀粉溶液D.泥浆
6.(原创)下列叙述中正确的是()
A.生物质能来源于植物机体加工产品所储存的能量,绿色植物通过光合作用将化学能转化为生物质能
B.棉布、羊毛和涤纶充分燃烧后的产物都是二氧化碳和水
C.铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂和催化剂载体
D.铁盐水解产生具有吸附性的胶体粒子,因而可用于饮用水的杀菌消毒
7.(原创)下列有关化学用语的表示中正确的是()
A.H2O2电子式:
B.聚丙烯的结构简式:
C.二氧化硅的结构式:
O=Si=O
D.16O2-和18O2-离子结构示意图均可以表示为:
8.(原创)下列不能使湿润的淀粉碘化钾试纸变蓝的是()
A.I2B.NO2C.Cl2D.SO2
9.(原创)下列化学反应属于吸热反应的是()
A.碘升华B.铁溶于盐酸C.铁生锈D.Ba(OH)2·8H2O晶体与NH4Cl晶体混合
10.(原创)下列说法正确的是()
A.氯水应保存在棕色广口瓶中并置于阴凉处
B.实验室受溴腐蚀致伤,现用苯或甘油洗伤口,再用水洗
C.可釆用通过饱和碳酸氢钠溶液的方法,除去CO2中混有的SO2
D.容量瓶、滴定管上都标有使用温度,“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶则不需要
11.(原创)下列说法不正确的是()
A.C-12原子是指质子数和中子数都是6的一种核素
B.金刚石和纳米碳管互为同素异形体
C.乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物
D.(CH3)3CCH3的名称是2,2—甲基丙烷
12.(原创)某温度下,在体积为2L的密闭容器中,2molSO2和1molO2发生反应:
2SO2(g)+O2(g)
2SO3(g)△H=-197kJ·mol-1,2min后达到平衡,生成0.4molSO3。
下列说法正确的是()
A.升高温度,逆反应速率减小
B.2min时反应放出的热量为39.4kJ
C.2min内反应速率为v(O2)=0.1mol·(L·mol)-1
D.当混合气体的密度不再发生变化时,说明反应达到平衡状态
13.(原创)下列化学方程式或离子方程式书写正确的是()
A、向KOH溶液中通入过量的SO2气体:
2OH-+SO2=SO32-+H2O
B、向FeBr2中通入过量的Cl2:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C、实验室制氯气:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
D、漂白粉的制备:
Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
14.(原创)短周期元素W、X、Y、Z的原子序数依次增大,W的单质是空气中体积分数最大的气体,W与Y最外层电子数之和为X最外层电子数的2倍,X、Y、Z简单离子的电子层结构相同,Z最外层电子数等于最内层电子数。
下列说法正确的是()
A.元素非金属性由强到弱的顺序:
W>Y>X
B.W的简单气态氢化物比Y的简单气态氢化物稳定
C.离子半径由大到小的顺序:
X>Y>Z
D.WX与ZX中的化学键类型相同
15.(原创)下列说法不正确的是()
A.煤的液化可以获得液态烃及甲醇等
B.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
C.碳原子数小于5的烷烃共有5种,其中异丁烷的二氯代物有三种
D.苯与四氯化碳两种有机物可用酸性高锰酸钾溶液鉴别
16.(原创)下列说法正确的是()
A.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
B.一定条件下,所有的油脂、糖类和蛋白质都能发生水解
C.在一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量是18(1-a)
D.鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂且对应的现象,碘水、变蓝色;硫酸铜溶液,白色沉淀;新制Cu(OH)2,加热后有砖红色沉淀
17.(根据2016年浙江省杭州市萧山区高考化学模拟试卷改编)如图是一种可充电的锂离子电池充、放电的工作示意图。
该电池的反应式为:
Li1﹣xMnO2+LixC6
LiMnO2+C6,(LixC6表示锂原子嵌入石墨形成的复合材料,LiMnO2表示含锂原子的MnO2)。
下列有关说法正确的是()
A.放电时,该电池的负极反应为:
LixC6﹣xe﹣═C6+xLi+
B.K与N相接时,A是负极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充电或放电过程中都只存在一种形式的能量转化
18.(原创)常温下,浓度均为0.1mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是()
A.两者的导电能力相同
B.向氨水溶液中加水稀释,溶液中c(H+)增大
C.将两溶液稀释相同倍数,NaOH溶液pH小于氨水
D.将浓度均为0.1mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:
c(OH-)>c(H+)
19.(原创)根据如图所示示意图,下列说法正确的是()
A.反应的热化学方程式可表示为C(s)+H2O(g)
CO(g)+H2(g)ΔH=(b-a)kJ/mol
B.该反应的反应热等于过程反应物断键释放的总能量减去生成物成键吸收的总能量
C.由图可知CO(g)和H2(g)的能量比C(s)和H2O(g)的高
D.1molC(g)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ
20.(原创)下列说法正确的是()
A.所有物质都含有化学键
B.稳定性H2O>CH4>SiH4,是因为其分子间作用力依次减小
C.过氧化钠为离子晶体,溶于水的过程中只破坏了离子键
D.干冰和白磷分子中,每个原子最外层都具有8电子稳定结构
21.(原创)在体积恒定的容器中发生反应C(s)+H2O(g)
CO(g)+H2(g),为研究温度及催化剂对反应的影响,分别在不同温度和催化剂下,保持其他初始试验条件不变,重复上述实验,经相同时间测得CO气体浓度如图所示,其中M,N分别是两条曲线的最高点,下列说法不正确的是()
A.在N点时,该反应达到平衡
B.在催化剂甲的作用下反应的平衡常数与催化剂乙的作用下的反应平衡常数相等
C.M点后CO的物质的量浓度减小的原因可能是温度升高发生了副反应
D.将固体C研磨成小颗粒可加快该反应的反应速率
22.(原创)设NA是阿伏加德罗常数的值,下列说法正确的是()
A.将100mL1mol/LFeCl3溶液与足量的KI溶液充分反应,转移0.3NA个电子
B.2.24LN2O和N2的混合气体中含有的氮原子数目为2NA
C.1.2g金刚石与石墨的混合物中含有碳碳单键的数目为0.4NA
D.常温下1.0LpH=12K2CO3溶液中由水电离出的OH-的数目为0.01NA
23.(根据2016年浙江省杭州市萧山区高考化学模拟试卷改编)25℃时,将浓度均为0.1mol/LCH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是()
A.电离平衡常数:
CH3COOH>HX>H2CO3
B.将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液
C.往10ml0.1mol/L的Na2CO3溶液中缓慢滴加10ml0.1mol/L的HX,混合后的离子浓度大小关系:
c(Na+)>
c(HCO3﹣)>c(X﹣)>c(OH﹣)>c(H+)
D.将浓度均为0.1mol/L的CH3COOH和HX的混合液用标准氢氧化钠溶液滴定,至中性时,CH3COOH被完全中和
24.(根据浙江省绍兴市新昌中学2018届高三10月选考适应性考试化学试题改编)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),制备过程如图所示:
下列说法不正确的是()
A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:
4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2可以使紫色石蕊溶液先变红再褪色
C.溶液X调pH的试剂可以选用氧化铁
D.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
25.(根据2016年浙江省杭州市萧山区高考化学模拟试卷改编)某混合物X由Cu、SiO2、Al2O3、Fe2O3中的一种或几种物质组成.进行如下实验.
下列说法不正确的是()
A.由步骤I可知X中一定含有的物质是Cu、SiO2、Fe2O3
B.蓝色溶液存在的阳离子只有Cu2+、Fe2+、H+
C.由步骤Ⅱ可知X中含有SiO2的质量为3g
D.无法判断混合物中Fe2O3与Cu的质量比
非选择题部分
二、非选择题(本大题共7小题,共50分)
26.(6分)(原创)某科研小组利用石油分馏产品烃X经下列路线,合成一种新型香料D,已知B与饱和NaHCO3溶液反应产生气体,C分子中存在两个甲基,其转化关系如图:
按要求回答下列问题:
(1)A中官能团名称为▲;A→C的反应类型为▲。
(2)写出B+C→D化学反应方程式▲。
(3)已知下列说法正确的是▲_。
A.石油炼制过程中X→A为分馏B.X和A互为同系物
C.可以用碳酸氢钠溶液区分B、C、DD.D催化氧化的产物(C3H6O)能发生银镜反应
27.(6分)(根据浙江省浙大附中2015年高三高考全真模拟理综卷改编)无机化合物A(含Li等三种元素),是具有良好前景的储氢材料。
对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C。
在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C(标准状况)。
已知气体C极易溶于水得到碱性溶液,电解无水B可生成金属单质D和氯气。
请回答下列问题:
(1)A的化学式是▲,C的电子式是▲。
(2)写出化合物A与足量盐酸反应的化学方程式:
▲.
(3)物质A在加强热分解的化学方程式为:
▲.
28.(4分)(根据浙江省选考十校联盟2017年十月适应性考试化学改编)CuCl广泛应用于化工和印染等行业。
某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
已知:
该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:
(1)D装置的作用▲。
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化▲
(3)写出由CuCl2制备CuCl的方程式:
▲.
29.(4分)(原创)草酸亚铁FeC2O4是一种重要原料,某研究性学习小组对FeC2O4热分解产物进行研究:
取8.64gFeC2O4·2H2O(相对分子质量为144)粉末在氮气保护下进行控温热分解,得到4.64g固体氧化物M和混合气体,已知混合气体中存在H2、CO和CO2,且混合气体中CO和CO2物质的量相等。
试计算:
(1)4.64g固体氧化物中n(O)=▲mol
(2)混合气体中V(H2)=▲L(标准状况)
30.【加试题】(原创)第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。
其中,烟气中的NOX与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱销)后才能排放。
I.水的脱销处理:
(1)水中的含氮物质在好氧硝化菌的作用下有如下反应:
NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-278KJ/mol(快反应)
NO2-(aq)+1/2O2(g)=NO3-(aq)△H=-73KJ/mol(慢反应)
则总的热化学方程式:
NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=▲KJ/mol
(2)20℃下含氮废水(以NH4+)的NH4+的浓度随DO(水体中溶解氧)浓度的变化曲线如下图1所示,在图上画出20℃下NO2-的浓度随DO的变化趋势图
(3)研究表明,用电解法除去氨氮废水(反应中视为NH4+)有很高的脱氮效率,写出该过程中阳极的电极反应式▲.
II.空气的脱销处理:
(4)CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)
CO2(g)+2N2(g)+2H2O(l),向绝热恒容密闭容器中,通入CH4(g)和NO(g),逆反应速率随时间的变化如下图2所示,下列分析正确的是▲.
A.正反应为放热反应B.n点的温度低于m点
C.m点反应达到平衡D.m点转化率高于n点
(5)250℃时,以镍合金为催化剂,向初始体积为10L的密闭容器中通入2mol的CH4,8mol的NO,在恒压条件下发生上述反应,平衡体系中甲烷的物质的量变化见表,则此温度下平衡常数K=▲.
反应时间(s)
2
4
6
8
CH4物质的量(mol)
1.6
1.4
1.0
1.0
(6)C2H4也可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图3所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是▲.
31.【加试题】(10分)(根据浙江省温州市2018届选考适应性测试二模化学试题改编)某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
第31题图1
请回答:
(1)步骤Ⅰ反应后分离操作可用右图所示方法,该方法称为___▲____。
(2)写出步骤Ⅱ中发生反应的离子方程式___▲____。
上述实验过程中试剂X可以选用___▲____
A.SO2B.酸性高锰酸钾C.氯水D.H2O2
(3)若步骤Ⅴ很难析出晶体,可以采用的措施是___▲__。
(4)下列有关实验说法正确的是___▲____。
A.步骤Ⅳ蒸发浓缩所需的仪器从下到上依次为酒精灯,三脚架,泥三角,石棉网,坩埚,玻璃棒
B.步骤Ⅵ过滤用右图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:
取晶体试样ag溶于20mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250mL。
步骤二:
取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mLZnCl2溶液。
已知:
M[Al2(SO4)3·18H2O]=666gmol-1,EDTA分别能与Al3+或Zn2+以物质的量之比1:
1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___▲____(用含字母的代数式表示)。
计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:
___▲____。
32.【加试题】(10分) (根据浙江省金华市十校2018届高三上学期期末联考化学试题改编)某蓝色荧光材料D的合成路线如下:
已知:
Ⅰ.
Ⅱ.
回答下列问题:
(1)①的反应类型为,化合物D的结构简式为。
(2)反应②的另一产物为甲醇,其化学方程式为。
(3)下列说法正确的是。
A.可以用NaHCO3溶液鉴别化合物A与C
B.化合物B能与FeCl3溶液发生显色反应
C.化合物不能发生水解反应
D.1mol A最多能与7molH2加成
(4)写出同时符合下列条件的化合物
的同分异构体结构简式。
①含苯环;②1H-NMR 谱表明分子中有2 种氢原子。
(5)设计以
和
为原料制备
的合成路线(用流程图表示,无机试剂任选)。
2018年浙江省普通高校招生选考科目模拟考试
化学
化学卷答题纸
考点学校班级姓名考场座位号
一、选择题部分(50分)
学校.班级姓名学号试场编号座位号.
〇○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○
○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○
密封线
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
题号
21
22
23
24
25
答案
二、非选择题(本大题共7小题,共50分)
学校.班级姓名学号试场编号座位号.
〇○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○
○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○
密封线
2018年浙江省普通高校招生选考科目模拟考试
化学
答案及评分细则
一、选择题部分(25*2=50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
C
B
C
C
D
D
D
C
题号
11
12
13
14
15
16
17
18
19
20
答案
D
B
C
C
C
C
A
B
A
D
题号
21
22
23
24
25
答案
A
D
B
B
B
二、非选择题部分
26.(6分)
(1)碳碳双键(1分)加成反应(1分)
(2)CH3COOH+CH3CH(OH)CH3CH3COOCH(CH3)2+H2O(2分)
(3)BC(2分)
27.(6分)
(1)LiNH2 (1分)
(1分)
(2)LiNH2+2H
Cl=LiCl+NH4Cl(2分)
(3)①3LiNH2
Li3N+2NH3↑(2分)
28.(4分)
(1)吸收氯气,防止环境污染,防倒吸(1分);
(2)先变红,后褪色