电解质溶液习题答案.docx
《电解质溶液习题答案.docx》由会员分享,可在线阅读,更多相关《电解质溶液习题答案.docx(15页珍藏版)》请在冰点文库上搜索。
电解质溶液习题答案
第五章电解质溶液
1.写出下列分子或离子的共轭碱:
H2O、H3O+、H2CO3、HCO-3、NH+4、NH+3CH2COO-、H2S、HS-。
写出下列分子或离子的共轭酸:
H2O、NH3、HPO2-4、NH-2、[Al(H2O)5OH]2+、CO2-3、NH+3CH2COO-。
答:
(1)
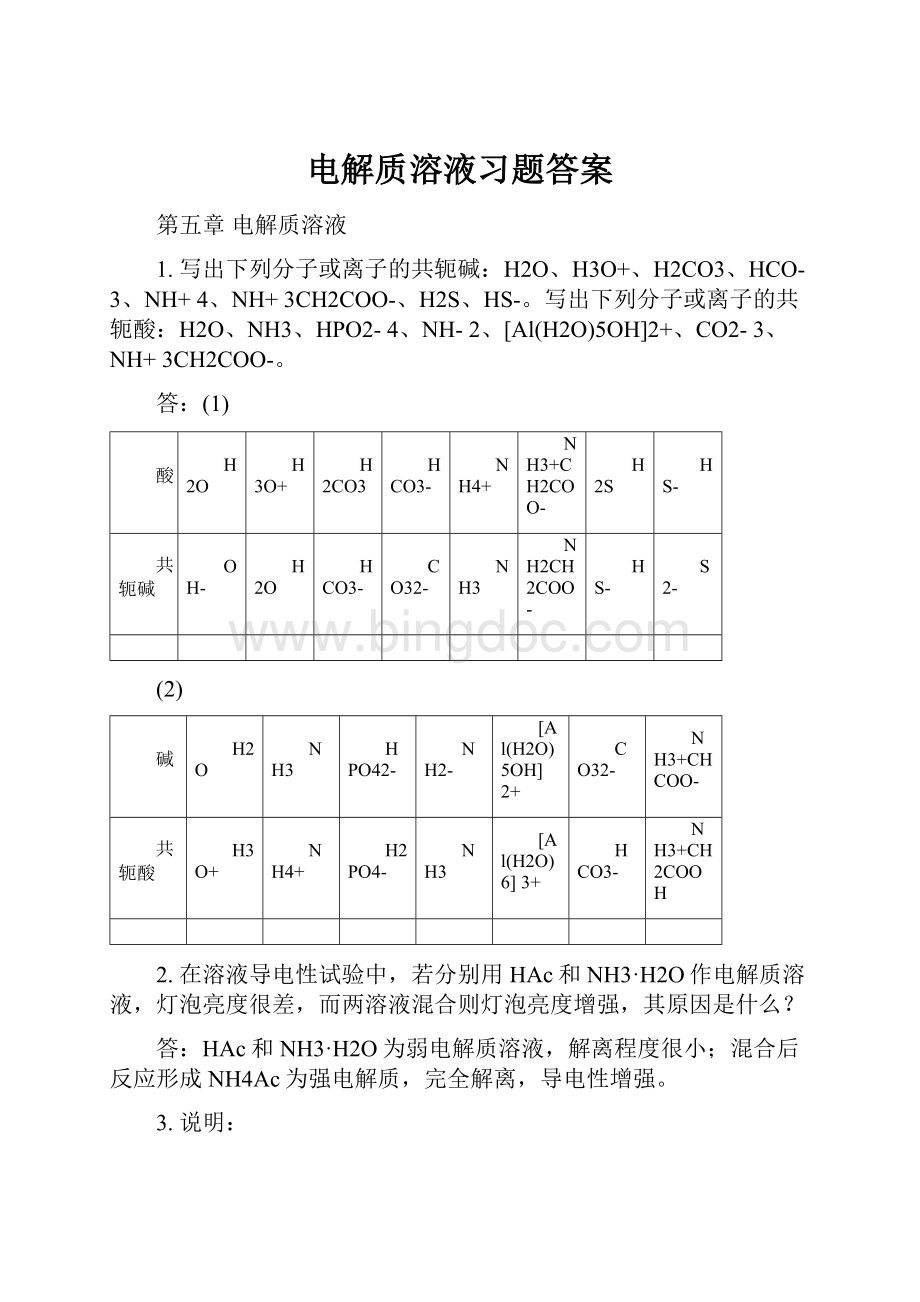
酸
H2O
H3O+
H2CO3
HCO3-
NH4+
NH3+CH2COO-
H2S
HS-
共轭碱
OH-
H2O
HCO3-
CO32-
NH3
NH2CH2COO-
HS-
S2-
(2)
碱
H2O
NH3
HPO42-
NH2-
[Al(H2O)5OH]2+
CO32-
NH3+CHCOO-
共轭酸
H3O+
NH4+
H2PO4-
NH3
[Al(H2O)6]3+
HCO3-
NH3+CH2COOH
2.在溶液导电性试验中,若分别用HAc和NH3·H2O作电解质溶液,灯泡亮度很差,而两溶液混合则灯泡亮度增强,其原因是什么?
答:
HAc和NH3·H2O为弱电解质溶液,解离程度很小;混合后反应形成NH4Ac为强电解质,完全解离,导电性增强。
3.说明:
(1)H3PO4溶液中存在着哪几种离子?
请按各种离子浓度的大小排出顺序。
其中H3O+浓度是否为PO3-4浓度的3倍?
(2)NaHCO3和NaH2PO4均为两性物质,为什么前者的水溶液呈弱碱性而后者的水溶液呈弱酸性?
答:
(1)若c(H3PO4)=O.10mol·L-1,则溶液中各离子浓度由大到小为:
离子H+H2PO4-HPO42-OH-PO43-
浓度/mol·L-12.4×10-22.4×10-26.2×10-84.2×10-135.7×10-19
其中H+浓度并不是PO43-浓度的3倍。
(2)当溶液的cKa2>20Kw,且c>20Ka1
NaHCO3:
pH=
(pKa1+pKa2)=
(6.37+10.25)=8.31碱性
NaH2PO4:
pH=
(pKa1+pKa2)=
(2.12+7.21)=4.66酸性
4.下列化学组合中,哪些可用来配制缓冲溶液?
(1)HCl+NH3·H2O
(2)HCl+Tris(三(羟甲基)甲胺)(3)HCl+NaOH
(4)Na2HPO4+Na3PO4(5)H3PO4+NaOH(6)NaCl+NaAc
答:
(1)
(2)(4)(5)
5.解释下列现象:
(1)CaC2O4溶于盐酸而不溶于乙酸。
(2)将H2S通入ZnSO4溶液中,ZnS沉淀不完全。
但如在ZnSO4溶液中先加入NaAc,再通入H2S,则ZnS沉淀相当完全。
(3)BaSO4不溶于盐酸,而BaCO3却可溶于盐酸。
答:
(1)CaC2O4
Ca2++C2O42-
HCl=Cl-+H+→H2C2O4平衡右移
(2)Zn2++S2-
ZnS↓
在ZnSO4溶液中先加入NaAc,再通入H2S,此时溶液中的Ac-可夺取H2S中的H+离子,使H2S的解离增大,提高溶液中S2-的浓度,使ZnS完全沉淀出来。
(3)BaCO3+H+
Ba2++H2CO3→H2O+CO2平衡右移
6.在含有固体AgCl的饱和溶液中,加入下列物质对AgCl的溶解度有什么影响?
并解释之。
(1)盐酸
(2)AgNO3(3)KNO3(4)氨水
答:
(1)盐酸和
(2)AgNO3,由于同离子效应将使AgCl的溶解度降低;但若加入HCl浓度较大的话,Ag+与Cl-可以生成配合物[AgCl2]-,此时AgCl的溶解度反而会增大。
(3)KNO3则由于盐效应,将使AgCl的溶解度稍有增加;
(4)氨水,由于NH3与Ag+形成了配离子将使游离的Ag+明显地减少,AgCl的溶解度大大地增加。
7.叠氮钠(NaN3)加入水中可起杀菌作用。
计算0.010mol·dm-3NaN3溶液的各种物种的浓度。
已知叠氮酸(HN3)的Kөa=1.9×10-5。
解设溶液中[OH-]=xmol·dm-3
(aq)+H2O(l)
HN3(aq)+OH-(aq)
初始浓度/(mol·L-1)0.010
平衡浓度/(mol·L-1)0.010-xxx
x=2.3×10-6(mol·dm-3)
c(OH-)=c(HN3)=2.3×10-6mol·dm-3
c(
)=c(Na+]=0.010mol·dm-3
c(H3O+)=Kw/c(OH-)=1.00×10-14/(2.3×10-6)=4.3×10-9mol·dm-3
8.某一元弱酸溶液的浓度为1.0mol·dm-3,其pH值为2.77。
求此弱酸的解离平衡常数和解离度。
解据题意可知c(H+]=1.70×10-3mol·dm-3
HA+H2O
A-+H3O+
平衡时(mol·dm-3)1.0-1.70×10-31.70×10-31.70×10-3
9.奶油腐败后的分解产物之一为丁酸(C3H7COOH),有恶臭。
今有一含有0.2mol丁酸的0.40dm3溶液,其pH值为2.50,求丁酸的解离平衡常数。
解丁酸为一元弱酸,据题意该溶液中[H+]=3.16×10-3mol·dm-3
HA+H2O
A-+H3O+
平衡时(mol·dm-3)0.5-3.16×10-33.16×10-33.16×10-3
10.若使1.0dm3浓度为8mol·dm-3氨水的解离度增大2倍,需加水多少dm3?
解根据稀释定律,
浓度为0.1mol·dm-3氨水的解离度为
当解离度增大2倍时,设溶液的浓度为xmol·dm-3
则
解得x=2(mol·dm-3)
故需要加水0.3dm3
11.计算下列溶液的pH值:
(1)0.010mol·dm-3HCl和0.10mol·dm-3NaOH等体积混合;
(2)0.010mol·dm-3NH4Cl溶液;(3)1.0×10-4mol·dm-3NaCN溶液;(4)0.1mol·dm-3溶液H2C2O4溶液;(5)0.10mol·dm-3的H3PO4溶液。
解
(1)因为NaOH过量,酸碱反应后,溶液为0.018mol·dm-3NaOH
则溶液的pH=14-lg0.018=12
(2)NH4Cl溶液按照一元弱酸处理:
查表Kb,NH3=1.76×10-5
则Ka,NH4+=Kw/Kb=5.68×10-10
因为c/Ka,NH4+>500,故可用最简式计算
(mol·dm-3)
所以,pH=5.62
(3)NaCN溶液按照一元弱碱处理:
查表Ka,,HCN=6.2×10-10
则Kb,CN-=Kw/Ka=1.61×10-5
因为c/Kb,CN-<500,故不能用最简式计算
CN-+H2O=HCN+OH-
平衡时(mol·dm-3)1..0×10-4-xxx
解得x=1.21×10-4(mol·dm-3)
所以pH=9.92
(4)H2C2O4=HC2O4-+H+Ka1=5.6×10-2
0.1-xxx
HC2O4-=H++C2O42-Ka2=1.5×10-4
yy
因为Ka1/Ka2=373>100,即H2C2O4二级电离出的氢离子浓度很小,可以忽略不计,所以可按一元弱酸处理。
又因为c/Ka1<500,故不能用最简式计算
解得x=0.0519(mol·dm-3)故PH=1.28
(5)因为Ka1/Ka2=6.9×10-3/6.1×10-8>>100,Ka2/Ka3=6.1×10-8/4.8×10-13>>100,即H3PO4二、三级电离出的氢离子浓度很小,可以忽略不计,所以可按一元弱酸处理。
又因为c/Ka1<500,故可用最简式计算
解得x=0.0263(mol·dm-3)故PH=1.58
12.在H2S饱和溶液中加入HCl使溶液的pH=2.0,计算溶液中c(S2-)。
解H2S饱和溶液中,c(H2S)=0.1mol·dm-3
H2S+H2O=HS-+H3O+Ka1=1.3×10-7
0.11.0×10-2
解得x=1.3×10-6(mol·dm-3)
HS-+H2O=S2-+H3O+Ka2=7.1×10-15
1.3×10-6y1.0×10-2
解得y=9.2×10-19(mol·dm-3)即溶液中c(S2-)为9.2×10-19mol·dm-3
13.在1.0dm3的0.10mol·dm-3氨水溶液中,应加入多少克NH4Cl固体才能使溶液的pH等于9.00(忽略固体的加入对溶液体积的影响)?
解NH3+H2O=NH4++OH-Kb=1.76×10-5
0.10mol·dm-3xmol·dm-31.0×10-5mol·dm-3
解得x=0.176(mol·dm-3)
则所需NH4Cl固体为:
0.176×1.0×53.5=9.4(g)
14.向100cm3某缓冲溶液中加入200mgNaOH固体,所得缓冲溶液的pH为5.60。
已知原缓冲溶液共轭酸HB的pKөa=5.30,c(HB)=0.25mol·dm-3,求原缓冲溶液的pH值。
解HB=H++B-
原缓冲液(mol·dm-3)0.25xc(B-)
加入NaOH后(mol·dm-3)0.25-0.0510-5.6c(B-)+0.05
根据
加入NaOH后,
解得c(B-)=0.35(mol·dm-3)
加入NaOH前,
所以加入NaOH前后溶液的pH基本无变化。
15.用0.025mol·dm-3的H2C8H4O4(邻苯二甲酸)溶液和0.10mol·dm-3的NaOH溶液,配制pH为5.60的缓冲溶液100cm3,求所需H2C8H4O4溶液和NaOH溶液的体积比。
解缓冲系为
—
查表,pKa2=5.432。
设需H2C8H4O4溶液V1mL,需NaOH溶液的总体积为V2mL,依题意第一步反应需NaOH溶液的体积亦为V1mL。
对于较复杂的平衡体系,可用列表法找出平衡时各物质的量。
(1)H2C8H4O4(aq)+NaOH(aq)
(aq)+H2O(l)
起始量mmol+0.025V1+0.025V1
变化量mmol-0.025V1-0.025V1+0.025V1
平衡量mmol00+0.025V1
(2)
(aq)+NaOH(aq)
(aq)+H2O(l)
起始量mmol+0.025V1+(0.10V2-0.025V1)
变化量mmol-(0.10V2-0.025V1)-(0.10V2-0.025V1)+(0.10V2-0.025V1)
平衡量mmol[0.025V1-(0.10V2-0.025V1)]0(0.10V2-0.025V1)
=(0.050V1-0.10V2)
pH=pKa2+lg
=5.432+lg
=5.60
解得
16.取100gNaAc·3H2O,加入13cm36.0mol·dm-3HAc溶液,然后用水稀释至100dm3,此溶液的pH是多少?
若向此溶液中通入0.10molHCl气体(忽略溶液体积变化),求溶液的pH变化多少?
解查表可知Ka,HAc=1.76×10-5,pKa,HAc=4.75;Mr(NaAc·3H2O)=136
所加入NaAc为0.735mol;加入NaAc后,该体系为缓冲溶液,则
通入0.10molHCl气体后
∆pH=0.42
17.已知298K时Fe(OH)3的Kөsp=2.64×10-39,求Fe(OH)3的溶解度。
解设Fe(OH)3的溶解度为s
Fe(OH)3=Fe3++3OH-
s3s
则Kөsp=s×(3s)3=2.64×10-39解得s=4.6×10-14(mol·dm-3)
18.计算下列难溶电解质的溶度积:
(1)CaF2在纯水中的溶解度为1.46×10-10mol·dm-3;
(2)PbI2在纯水中的溶解度为1.35×10-3mol·dm-3;
(3)PbCl2在0.130mol·dm-3的Pb(NO3)2溶液中的溶解度是5.7×10-3mol·dm-3。
解
(1)CaF2=Ca2++2F-
s2s
Kөsp=s×(2s)2=4s3=4×(1.46×10-10)3=1.25×10-29
(2)PbI2=Pb2++2I-
s2s
Kөsp=s×(2s)2=4s3=4×(1.35×10-3)3=9.84×10-9
(3)PbCl2=Pb2+2Cl-
s2s
Kөsp=(s+0.13)×(2s)2s+0.13≈0.13
19.若向Mg2+浓度为1.0×10-4mol·dm-3溶液中加入固体NaOH,使OH-浓度为2.0×10-4mol·dm-3,是否有Mg(OH)2沉淀生成?
解查表可知Mg(OH)2Kөsp=5.61×10-12
因为溶液中c(Mg2+)×c(OH-)2=1.0×10-4×(2.0×10-4)2=4.0×10-12所以不会有Mg(OH)2沉淀生成。
20.在10cm3的0.0015mol·dm-3的MnSO4溶液中,加入5cm30.15mol·dm-3氨水,能否生成Mn(OH)2沉淀?
如在上述MnSO4溶液中先加0.49g固体(NH4)2SO4,然后再加5cm30.15mol·dm-3氨水,是否有沉淀生成?
解
(1)加入5cm30.15mol·dm-3氨水后溶液中OH-浓度设为x
NH3+H2O=NH4++OH-Kb=1.76×10-5
xx
解得x=1.2×10-3(mol·dm-3)
c(Mn2+)×c(OH-)2=
=1.2×10-9>Kөsp,Mn(OH)2=2.06×10-13
所以有Mn(OH)2沉淀生成。
(2)先加入0.49g固体(NH4)2SO4,再加入5cm30.15mol·dm-3氨水后溶液中OH-浓度设为y
NH3+H2O=NH4++OH-Kb=1.76×10-5
y
解得y=2.7×10-6(mol·dm-3)
则c(Mn2+)×c(OH-)2=
=7.29×10-15所以没有Mn(OH)2沉淀生成。
21.将0.010mol的CuS溶于10.0dm3盐酸中,计算盐酸所需的浓度。
从计算结果说明盐酸能否溶解CuS?
解查表Kөsp,CuS=6.3×10-36Ka1,H2S=1.3×10-7,Ka2,H2S=7.1×10-15
设盐酸所需的浓度为xmol·dm-3
若使CuS溶解,即c(Cu2+)=c(S2-)=0.0010mol·dm-3,而S2-与HCl反应转化为H2S:
CuS+2HCl=CuCl2+H2S
t=0x
t=∞x-0.0020.0010.001
解得x=1.2×104(mol·dm-3)
盐酸的这一浓度是无法达到的,故盐酸无法使CuS溶解。
22.往Cd(NO3)溶液中通入H2S时可以生成CdS沉淀。
要使溶液中所剩Cd2+浓度不超过2.0×10-6mol·dm-3,问溶液允许的最大酸度是多少?
解据题意
(mol·dm-3)
解得
H+)=0.15(mol·dm-3)
23.已知溶液中NaCl和K2CrO4浓度分别为0.010mol·dm-3和0.0010mol·dm-3,向该溶液中滴加AgNO3溶液(忽略体积变化),问:
(1)哪一种沉淀先生成?
(2)当第二种离子刚开始沉淀时,溶液中的第一种离子浓度为多少?
(忽略溶液体积的变化)
(3)两种负离子可否完全分离?
解
(1)AgCl开始沉淀时
c(Ag+)AgCl=Ksp(AgCl)/c(Cl-)=(1.77×10-10/0.01)mol·dm-3=1.77×10-8mol·dm-3
Ag2CrO4开始沉淀时
c(Ag+)Ag2CrO4=[Ksp(Ag2CrO4)/c(CrO42-)]1/2=(1.12×10-12/0.001)1/2mol·dm-3
=3.35×10-6mol·dm-3
沉淀Cl-所需c(Ag+)较小,AgCl沉淀先生成。
(2)当c(Ag+)=1.0×10-5mol·dm-3时,Ag2CrO4开始沉淀,此时溶液中剩余的Cl-浓度为:
c(Cl-)=Ksp(AgCl)/c(Ag+)=1.77×10-10/(1.0×10-5)(mol·dm-3)=1.77×10-5mol·dm-3
(3)由于Ag2CrO4开始沉淀时,Cl-浓度为1.77×10-5mol·dm-3,基本沉淀完全,所以两种负离子可以完全分离。
24.某溶液中含有Pb2+和Ba2+金属离子,其浓度都是0.010mol·dm-3。
若向此溶液滴加溶液,问哪种金属离子先沉淀?
这两种离子有无分离的可能?
解Pb2+离子开始沉淀时
c(CrO42-)PbCrO4=Ksp(PbCrO4)/c(Pb2+)=(1.8×10-14/0.010)mol·dm-3=1.8×10-12mol·dm-3
Ba2+离子开始沉淀时
c(CrO42-)BaCrO4=Ksp(BaCrO4)/c(Ba2+)=(1.17×10-10/0.010)mol·dm-3=1.17×10-8mol·dm-3
沉淀Pb2+离子所需较小,Pb2+离子先沉淀。
当Pb2+离子沉淀完全,即c(Pb2+)=1.0×10-5mol·dm-3时,此时溶液中剩余的c(CrO42-)浓度为:
c(CrO42-)PbCrO4=Ksp(PbCrO4)/c(Pb2+)=(1.8×10-14/1.0×10-5)mol·dm-3=1.8×10-9mol·dm-3
此时,c(Ba2+)×c(CrO42-)BaCrO4=0.010×1.8×10-9=1.8×10-11Ba2+离子尚未沉淀,故两种离子可以分开。
25.计算300cm3的1.5mol·dm-3Na2CO3溶液?
解∵Ksp(BaSO4)=1.08×10-10,Ksp(BaCO3)=2.58×10-9
BaSO4(s)+CO32-=BaCO3(s)+SO42-
转化前x0.3×1.5mol0
转化后0(0.3×1.5-x)molxmolxmol
K=Ksp(BaSO4)/Ksp(BaCO3)=1.08×10-10/2.58×10-9=0.0419
∴只要c(CO32-)比c(SO42-)大24倍以上经过多次转化,就可以将BaSO4变成BaCO3
解得:
x=0.18(mol)
故可以使0.18×233=42(克)BaSO4固体转化为BaCO3
26.一种混合溶液中含有3.0×10-2mol·dm-3Pb2+和2.0×10-2mol·dm-3Cr3+,若向其中逐滴加入浓NaOH溶液(忽略溶液体积的变化),Pb2+与Cr3+均有可能形成氢氧化物沉淀。
问:
(1)哪种离子先沉淀?
(2)若要分离这两种离子,溶液的pH应控制在什么范围?
解
(1)混合液中开始析出Pb(OH)2、Cr(OH)3所需的c(OH-)最低浓度分别为:
因为c(OH-)Pb(OH)2<(2)当Pb2+沉淀完全时,c(Pb2+)=1.0×10-5mol·dm-3,此时
c(H+)=Kw/c(OH-)=1×10-14/3.78×10-7=2.64×10-8(mol·dm-3)
即pH=7.4
当Cr(OH)3开始沉淀时,c(OH-)=6.8×10-7mol·dm-3,pOH=6.2,pH=7.8
因此只要将pH值控制在7.4~7.8之间,可以将Pb2+与Cr3+分离开来。