实验室常用试剂配制.docx
《实验室常用试剂配制.docx》由会员分享,可在线阅读,更多相关《实验室常用试剂配制.docx(28页珍藏版)》请在冰点文库上搜索。
实验室常用试剂配制
实验室常用溶液及试剂配制
实验室常用溶液、试剂的配制
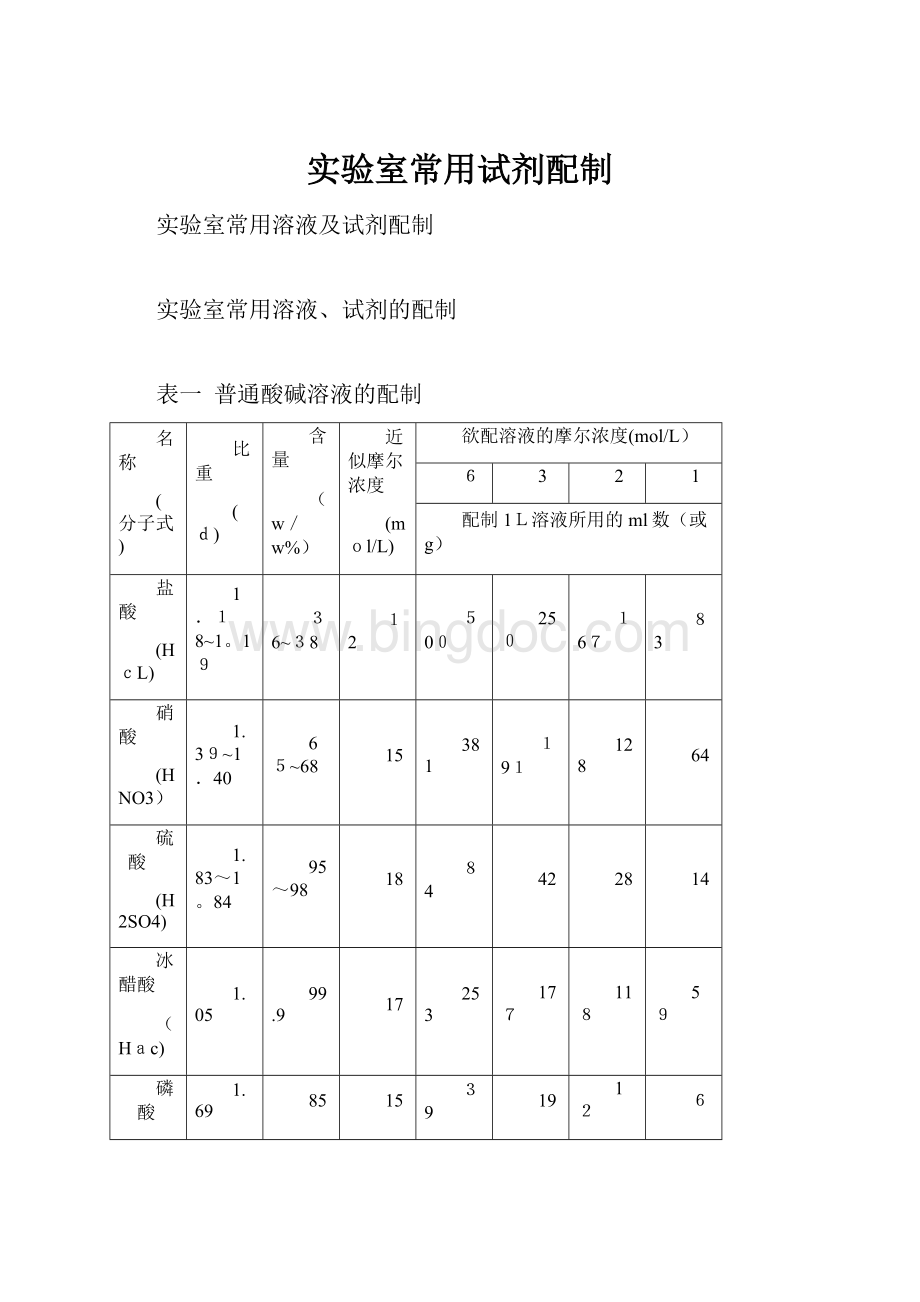
表一 普通酸碱溶液的配制
名称
(分子式)
比重
(d)
含量
(w/w%)
近似摩尔浓度
(mol/L)
欲配溶液的摩尔浓度(mol/L)
6
3
2
1
配制1L溶液所用的ml数(或g)
盐酸
(HcL)
1.18~1。
19
36~38
12
500
250
167
83
硝酸
(HNO3)
1.39~1.40
65~68
15
381
191
128
64
硫 酸
(H2SO4)
1.83~1。
84
95~98
18
84
42
28
14
冰醋酸
(Hac)
1.05
99.9
17
253
177
118
59
磷 酸
(H3PO4)
1.69
85
15
39
19
12
6
氨水(NH3·H2O)
0.90~0。
91
28
15
400
200
134
77
氢氧化钠(NaOH)
(240)
(120)
(80)
(40)
氢氧化钾(KOH)
(339)
(170)
(113)
(56.5)
表二 常用酸碱指示剂
指示剂
PKHIn
变色范围pH
酸色
碱色
配制方法
百里酚蓝
(麝香草酚蓝)
1.65
12。
~2.8
红
黄
0.1%的20%乙醇溶液
甲基橙
3.4
3。
1~4。
4
红
橙黄
0.05%水溶液
溴甲酚绿
4。
9
3。
8~5.4
黄
蓝
0.1%的20%乙醇溶液或0。
1g指示剂溶于2。
9ml0.05mol/L NaOH加水稀释至100ml
甲基红
5。
0
4。
4~6.2
红
黄
0。
1%的60%乙醇溶液
溴百里酚蓝
(麝香草酚蓝)
7.3
6。
2~7.3
黄
蓝
0。
1%的20%乙醇溶液
中性红
7。
4
6。
8~8.0
红
黄橙
0。
1%的60%乙醇溶液
百里酚蓝
(第二变色范围)
9。
2
8.0~9.6
黄
蓝
0。
1%的20%乙醇溶液
酚酞
9.4
8.0~10.0
无色
红
0.5%的90%乙醇溶液
百里酚酞
10。
0
9.4~10.6
无色
蓝
0.1%的90%乙醇溶液
表三 混合酸碱指示剂
指示剂组成(体积比)
变色点pH
酸色
碱色
备注
一份0。
1%甲基橙水溶液
一份0。
25%靛蓝二磺酸钠水溶液
4。
1
紫
绿
灯光下可滴定
一份0.02%甲基橙水溶液
一份0。
1溴甲酚绿钠盐水溶液
4.3
橙
蓝绿
PH3。
5黄色
PH4.05绿黄
PH4.3浅绿
三份0.1%溴甲酚绿20%乙醇溶液
一份0.2%甲基红60%乙醇溶液
5。
1
酒红
绿
颜色变化极鲜明
一份0。
2%甲基红乙醇溶液
一份0。
1%次甲基蓝乙醇溶液
5。
4
红紫
绿
PH5.2红紫
PH5.4暗蓝
PH5。
6绿色
一份0。
1%溴甲酚绿钠盐水溶液
一份0.1%绿酚红钠盐水溶液
6.1
黄绿
蓝紫
PH5.6蓝绿
PH5.8蓝色
PH6。
0浅紫
PH6。
2蓝紫
一份0.1%溴甲酚紫钠盐水溶液
一份0。
1溴百里酚蓝钠盐水溶液
6。
7
黄
紫蓝
PH6。
2黄紫
PH6.6紫
PH6.8蓝紫
一份0.1中性红乙醇溶液
一份0。
1次甲基蓝乙醇溶液
7.0
蓝紫
绿
PH7.0为蓝绿
必须保存在棕色瓶中
一份0.1甲酚红钠盐水溶液
三份0。
1%百里酚蓝钠盐水溶液
8.3
黄
紫
PH8。
2玫瑰色
PH8。
4紫色
一份0。
1%百里酚蓝50%乙醇溶液
三份0.1酚酞50%乙醇溶液
9。
0
黄
紫
PH9。
0绿色
表四 容量分析基准物质的干燥
基准物质
干燥温度和时间
基准物质
干燥温度和时间
碳酸钠(NaCO3)
500~650℃,40-50min
氯化物(NaCl)
500-650℃,干燥40—50min
草酸钠(H2C2O4)
150—200℃,1—1。
5h
硝酸银(AgNO3)
室温,硫酸干燥器中至恒温
草酸(H2C2·2H2O)
室温,空气干燥2-4h
碳酸钙(CaCO3)
120℃,干燥至恒重
硼砂(Na2B2O·10H2O)
室温,在NaCl和蔗糖饱和液的干燥器中,4h
氧化锌(ZnO)
800℃灼烧至恒重
邻苯二甲酸氢钾(KHC6H4O4)
100—120℃,干燥至恒重
锌(Zn)
室温,干燥器24h以上
重铬酸钾(K2Cr2O7)
100-110℃,干燥3—4h
氧化镁(MgO)
800℃灼烧至恒重
表五 缓冲溶液的配制
1、 氯化钾—盐酸缓冲溶液
0.2mol/LKCl(ml)
50
50
50
50
50
50
50
0。
2mol/LHCl(ml)
97。
0
64.3
41.5
26.3
16.6
10.6
6。
7
水(ml)
53.0
85。
5
108。
5
123.7
133.4
139。
4
143.3
PH(20℃)
1。
0
1.2
1。
4
1.6
1.8
2.0
2.2
2、 邻苯二甲酸氢钾—氢氧化钾缓冲溶液
0.2mol/LKHC6H4O4(ml)
50
50
50
50
50
0。
2mol/LHCl(ml)
46。
70
32.95
20。
32
9.90
2。
63
水(ml)
103.30
117。
05
129.68
140。
10
147.37
PH(20℃)
2。
2
2.6
3。
0
3.4
3。
8
3、 邻苯二甲酸氢钾-氢氧化钾缓冲溶液
0。
2mol/LKHC6H4O4(ml)
50
50
50
50
50
0。
2mol/LHCl(ml)
0.40
7。
50
17。
70
29.95
39。
85
水(ml)
149。
60
142。
50
132.20
120。
05
110。
15
PH(20℃)
4.0
4。
4
4。
8
5。
2
5。
6
4、 乙酸—乙酸钠缓冲溶液
0.2mol/LHAc(ml)
185
164
126
80
42
19
0.2mol/LNaAc(ml)
15
36
74
120
158
181
PH(20℃)
3。
6
4。
0
4.4
4。
8
5.2
5。
6
5、 磷酸二氢钾—氢氧化钠缓冲溶液
0.2mol/LKH2PO4(ml)
50
50
50
50
50
50
0。
2mol/LNaOH(ml)
3.72
8.60
17。
80
29。
63
39.50
45。
20
水(ml)
146。
26
141.20
132。
20
120.37
110。
50
104。
80
PH(20℃)
5.8
6。
2
6.6
7。
0
7.4
7.8
6、 硼砂—氢氧化钠缓冲溶液
0。
2mol/L硼砂(ml)
90
80
70
60
50
40
0.2mol/LNaOH(ml)
10
20
30
40
50
60
PH(20℃)
9.35
9.48
9.66
9。
94
11.04
12.32
7、 氨水-氯化铵缓冲溶液
0。
2mol/LNH3·H2O(ml)
1
1
1
2
8
32
0。
2mol/LNH4Cl(ml)
32
8
2
1
1
1
PH(20℃)
8。
0
8。
58
9.1
9。
8
10。
4
11.0
8、 常用缓冲溶液的配制
PH
配制方法
3.6
NaAc·3H2O 8g,溶于适量水中,加6mol/LHAc134ml,稀释至500ml
4.0
NaAc·3H2O20g 溶于适量水中,加6mol/LHAc 134ml,稀释至500ml
4。
5
NaAc·3H2O 32g 溶于适量水中,加6mol/LHAc 68ml,稀释至500ml
5.0
NaAc·3H2O50g 溶于适量水中,加6mol/LHAc 34ml,稀释至500ml
8。
0
NH4Cl 50g 溶于适量水中,加15mol/LNH3·H2O 3.5ml,稀释至500ml
8。
5
NH4Cl 40g 溶于适量水中,加15mol/LNH3·H2O 8.8ml,稀释至500ml
9.0
NH4Cl 35g 溶于适量水中,加15mol/LNH3·H2O 24ml,稀释至500ml
9.5
NH4Cl 30g 溶于适量水中,加15mol/LNH3·H2O 65ml,稀释至500ml
10
NH4Cl 27g 溶于适量水中,加15mol/LNH3·H2O 197ml,稀释至500ml
实验室常用试验方法2
九、柠檬酸(C6H8O7·H2O)
称取试样1。
5g(精确到0.0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:
X%(一水)=(V1—V0)×C×0。
06404 m×(1—0。
08566)×100
X%(无水)=(V1—V0)×C×0.06404 m×100
V1——---消耗氢氧化钠标准溶液的体积,ml;
V0-——-—空白所消耗氢氧化钠标准溶液的体积,ml;
C--—--—氢氧化钠标准溶液浓度,mol/L;
m—-—样品质量。
十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)
称取2g(精确到0.0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0。
1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0.05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点.
Ca%= C×V×0.4008 m×100
C----——EDTA标准溶液的浓度,mol/L;
V-—---消耗EDTA标准溶液的体积,ml;
m--—-样品质量。
(二)氟(Fˉ)含量的测定:
1、标准曲线的绘制;
2、试样含量的测定:
称取0。
5g(精确到0。
0002g)置于50ml纳氏比色管中,加1mol/L盐酸10ml,密闭提取1h(不时摇动),避免粘于管壁,提取后加总离子强度缓冲液25ml,加水至刻度,以滤纸过滤。
以氟电极测平衡电位值。
结果计算:
X=C×50×1000 m×1000=50C m
X—-—--试样中氟含量,
m—--试样质量,g;
C—-—--据电位值查得的浓度,
总离子强度缓冲液:
现配现用,3mol/L乙酸钠;0。
75mol/L柠檬酸钠,配成(1+1).
测定时,用蒸馏水洗电极装置至值为—370以后。
(三)磷(P)的测定
磷标准曲线的绘制:
准确移取磷标准溶液(分析纯的磷酸二氢钾,在105℃干燥1h,冷却后称取0.2195g,溶于1L的容量瓶中,加硝酸3ml,用水稀释至刻度,得到50ug/ml溶液),分别吸取0。
0、1。
0、2.0、4。
0、6。
0、8.0、10。
0、12。
0、15.0ml于50ml容量瓶中,各加入磷显色液(钒—钼酸铵显色液:
偏钒酸铵1。
25g,加250ml硝酸于1000ml容量瓶中;钼酸铵25g于烧杯中,加400ml水溶解,冷却下,将此液倒入容量瓶中,定容)10ml,用蒸馏水定容,摇匀放置10min以上,以0。
0为参比,在400nm波长测定各溶液的吸光度。
以横坐标为磷含量,纵坐标为吸光度,作标准曲线。
样品的测定(磷酸氢钙):
移取测钙时所用的试样溶液5ml于100ml容量瓶中,用水定容,摇匀,准确移取2ml于50ml容量瓶中,加磷显色液10ml,用水定容,测其吸光度。
P%=W×稀释倍数 m×106×100
W--——以吸光度算出的浓度,
m—---试样质量,g。
十一、硫酸铜(CuSO4·5H2O)
鉴别:
1、Cu2+,取试样溶液,加0.5ml乙二胺四乙酸二钠溶液(15%,m/v),0。
5ml氢氧化钠溶液(0。
1mol/L),1ml乙酸乙酯,振摇,有机层显黄棕色。
2、SO42—,取试样溶液,置于白色瓷板上,加BaCl2溶液(5%,m/v),即有白色沉淀生成,在盐酸和硝酸中不溶.
测定:
称取0。
35g左右(精确到0。
0002g)置于碘量瓶中,加50ml水溶解,40ml冰乙酸,2g碘化钾(10mlKI溶液),摇匀,于暗处放置10min,用Na2S2O3标准溶液滴定至淡蓝色,加2ml淀粉,继续滴定至无蓝色(或蓝色刚刚消失为终点)。
硫酸铜%=C×V×0.06355 m×100
C——-———Na2S2O3标准溶液的浓度,mol/L;
V--———消耗Na2S2O3标准溶液体积,ml;
m--—-—样品质量,g。
十二、硫酸锌(ZnSO4·H2O)
称取0。
2g试样,加50ml水溶解,加3g酒石酸钾钠,2ml浓氨水,50mg络黑体,用EDTA标准溶液(0.05mol/L)滴定至紫色变为纯蓝色。
ZnSO4%=C×V×0。
06537 m ×100%
C--———EDTA标准溶液的浓度,mol/L;
V--—-—消耗EDTA标准溶液的体积,ml;
m—--—样品质量。
十三、硫酸亚铁(FeSO4·H2O)
称取0。
35g试样于250ml三角瓶中,加50ml水,5ml浓硫酸(缓慢加入),2ml浓磷酸,冷却至室温,用0。
1mol/L高锰酸钾标准溶液滴定至粉红色即为终点。
FeSO4%=C×V×0。
05585 m×100%
C—-—--高锰酸钾标准溶液的浓度,mol/L;
V-—---消耗高锰酸钾标准溶液的体积,ml;
m——--试样的质量。
十四、砷
1、 原理:
在酸性介质中,金属锌将砷化物还原为砷化氢,砷化氢在溴化汞试纸上形成棕黄色砷斑与标准砷进行比较。
2、试剂:
盐酸(HCl),碘化钾(KI),氧化亚锡盐酸溶液(40%、m/v),无砷金属锌,乙酸铅棉花·溴化汞试纸,砷标准溶液(1ug/ml)。
3、测定:
称取1g试样(精确到0。
01g)置于广口瓶中,用水稀释至70ml,加6ml盐酸,摇匀,加1g碘化钾(5mlKI溶液、200g/L),再滴加氯化亚锡,直到溶液由黄色变成无色或白色,摇匀,放置10min,加2.5g无砷金属锌,装好置于暗处25—30℃放置1—1.5h,溴化汞试纸所呈棕黄色不得深于标准。
十五、硫酸镁(MgSO4)
无色结晶或白色粉末.
称取试样1g(精确到0.0002g),用水溶解,转移至100ml容量瓶中,定容,准确吸取25ml溶液至250ml锥形瓶中,加30ml水,10ml氨-氯化铵缓冲溶液(PH=10),及5滴铬黑体指示剂(0.5%),用EDTA滴定至溶液由紫红色变为纯蓝色为终点.
X%= C×V×0.02431 m×100
C—-—---EDTA标准溶液的浓度,mol/L;
V——--—消耗EDTA标准溶液的体积,ml;
m——--样品质量,g.
另:
沸石粉、滑石粉、石膏粉和膨润土,只测Pb、Cd和As。
三、维 生素
一、甜菜碱盐酸盐
1、原理,采用非水滴定法,用乙酸汞将甜菜碱盐酸盐转化为乙酸盐和难电离的氯化汞,在乙酸介质中用高氯酸滴定溶液对生成的乙酸盐进行滴定。
2、试剂,①冰乙酸;②乙酸汞溶液,将50g乙酸汞研细,加1000ml冰乙酸溶解,置棕色瓶中,密闭保存。
③结晶紫指示剂;2g/L,取2g结晶紫,加100ml冰乙酸;④高氯酸标准滴定液,0.1mol/L的溶液。
3、测定
取试样预先在105℃烘箱中干燥至恒重,称取干燥试样0.4g(精确到0.0002g),加50ml冰乙酸加热溶解,加25ml乙酸汞溶液,冷却,加结晶紫指示剂2滴,用0。
1mol/L的高氯酸标准溶液滴定到溶液呈绿色,同时作空白试验.
X%= (V—V0)×C×0.01536 M×100
C-——-高氯酸标准溶液的浓度mol/L
V—-—试验组消耗高氯酸标准溶液的体积ml
V0———空白组消耗高氯酸标准溶液的体积ml
m--—试样质量。
二、氯化胆碱
称取经105℃干燥至恒重的试样1g(精确到0。
0002g),置于100ml容量瓶中,加水70ml混匀,在约80℃水浴上加热15min,取出,在电动振荡器振荡20min,用水定容至100ml,过滤,吸取10ml滤液于100ml高型烧杯中,在冰箱内冷却到5℃以下,加10ml雷氏盐溶液(2%),不时搅拌反应30min(再令沉淀静置陈化15min),然后将沉淀定量到转移到事先在105℃烘干至恒重的玻璃砂芯坩埚中,减压抽滤,在用水洗涤沉淀3—4次,每次10ml,将装有沉淀的坩埚滤器放入烘箱,105℃烘2h称重。
氯化胆碱%= 沉淀重×3。
3045 样品重量×100%
雷氏盐甲醇溶液(2%):
2g雷氏盐,溶于100ml甲醇中,放置于低温下保存.
胺盐定性分析:
称取3-4g试样,煮50ml水至70-80℃,在加样品,摇匀充分溶解,过滤于150ml三角瓶中,加入1ml浓硫酸,摇匀,将滤液煮沸,用氨制硝酸盐试剂沾滤纸测其气,观察试纸颜色是否发黑,继续煮1-2min,从电炉上取下放冷,加40%氢氧化钠5ml再煮沸,用PH湿润试纸测其蒸气的PH值,PH在7-8为合格.
氨制硝酸银溶液:
取硝酸银1g,加水20ml,滴加氨试剂(取浓氨水400ml,加水至1000ml),边加边搅拌,至棕色沉淀将近全溶,过滤,置于棕色瓶中,在暗处保存。
(二)仲裁法(非水滴定法):
原理:
采用非水滴定法,用乙酸汞将氯化胆碱转化成乙酸盐和难电离的氯化汞,在乙酸介质中,以高氯酸对生成的乙酸盐进行滴定.
试剂:
5%乙酸汞溶液、50g/L(称取5g乙酸汞研细,用微热的冰乙酸溶解并稀释至100ml,在棕色瓶中密封保存;0.2%结晶紫、2g/L(称取0.2g,加100ml冰乙酸)
测定步骤:
称取试样0。
3g(精确到0。
0002g)置于100ml锥形瓶中,加20ml冰乙酸,2ml乙酸酐,10ml乙酸汞溶液和2滴结晶紫指示剂,摇匀,用高氯酸标准溶液滴定至溶液呈纯蓝色。
即为终点。
同时做空白试验.
X%=C×(V1—V0)×139。
63 m×1000×100
C———-—高氯酸标准溶液的浓度,mol/L;
V1--—-试验组消耗高氯酸溶液的体积,ml;
V0—-—-空白组消耗高氯酸溶液的体积,ml;
m——-—样品的质量,g.
139。
63-----氯化胆碱的分子量。
三、维生素B6
称0。
15g样品(精确到0。
0002g),加冰乙酸20ml,乙酸汞溶液5ml,温热溶解,放冷,加结晶紫指示剂1滴,用高氯酸标准溶液滴定至溶液呈蓝绿色,同时做空白校正。
VitB6%= (V-V0)×F×0.02056 m×100
V——-—样品溶液耗高氯酸标准溶液的体积,ml;
V0---—空白溶液耗高氯酸标准溶液的体积,ml;
F—-———高氯酸标准溶液浓度,mol/L;
m-——--样品重,g。
本法适用于化学合成制得的vitB6。
四、维生素B2(核黄素)
避光操作,称取0.075g(精确到0。
0002g),置于烧杯中,加冰乙酸1ml和水75ml,加热溶解后,加水稀释放冷,移置500ml容量瓶中,用水定容。
摇匀,吸取10ml于100ml容量瓶中,加1。
4%乙酸钠溶液7ml。
并用水定容,同时做空白试验作对照。
以444nm波长测吸光度。
VitB2%=A 323×L×C×100= 50A 323m×100%
A-————样品吸光度;
323—-—-维生素B2的系数;
L—-——光路长度1cm;
C--——-100ml溶液中样品的g数.
五、维生素C(包被)
称取0.2g于250ml三角瓶中,加水100ml(煮沸,冷却),10ml冰乙酸,1ml1%淀粉指示剂,用0。
1mol/L碘标准溶液滴定至溶液为蓝色。
VitC%=V×F×0.00886 m×100
V—-——-消耗碘标准溶液的体积,ml;
m-—-—试样质量,g;
F—-—浓度校正系数(碘标液/样品液浓度)碘标准溶液的浓度,mol/L。
四、氨 基酸
一、赖氨酸硫酸盐含量的测定
1、标准曲线的绘制
标准贮备液:
称取L—赖氨酸2克左右于1000ml容量瓶中,加1mol/L盐酸1ml用水溶解,定容。
则浓度大约在0。
2mg/ml。
标准曲线的绘制:
分别吸取3.0,5.0,10。
0,11.0,12。
0,13。
0和14。
0ml标准贮备液于100ml容量瓶中,加水定容摇匀.在以上各容量瓶中分别吸取2.00ml于比色管中,然后在每只比色管中再加10ml印三酮显色液,不定容,用力振摇.于沸水浴中水浴40分钟.立即冷却至室温。
同时作空白(只是不加分解液)。
在分光光度计上于475nm波长处,以空白调零,测量各吸光度,以吸光度为纵坐标,浓度为横坐标,作图。
2、样品的测定:
:
称取样品1.5克左右,加1mol/L的盐酸7ml充分溶解样品,用水定容,过滤,吸取2。
00ml于100ml容量瓶中,加水定容,摇匀。
其它同作标准曲线的步骤。
测出吸光度。
3、计算:
于标准曲线上查出所测样品的浓度,代入公式
X(%)= C×500 M
C——---——-为从标准曲线上查得的样品的浓度。
M--——-——样品的质量。
500———--为样品稀释的倍数和转变为百分含量的系数。
(空白加样品液和空白试液.)
(一)原理:
赖氨酸在PH≤3.0是与茚三酮反应生成红色化合物,其颜色深浅与赖氨酸含量存在性性关系.
(二)试剂:
1、茚三酮A液,称取茚三酮1。
50g于烧杯中,量取110ml乙二醇—甲谜于烧杯中,溶解。
2、茚三酮B液,称取1.80g二水氯化铜(CuCl2·2H2O)于烧杯中,再量取0.1mol/L柠檬酸39ml于烧杯中,搅拌使其溶解.
3、将A、B两液全部转入1000ml容量瓶中定容,摇匀得茚三酮显色液。
4、赖氨酸空白显色液、称取1.80g二水氯化铜(CuCl2·2H2O)于烧杯中,再量取0.1mol/L柠檬酸39ml于烧杯中,搅拌使其溶解.转移至1000ml容量瓶中定容,摇匀即可。
二、苏氨