初三中考化学复习重点知识点总结.docx
《初三中考化学复习重点知识点总结.docx》由会员分享,可在线阅读,更多相关《初三中考化学复习重点知识点总结.docx(17页珍藏版)》请在冰点文库上搜索。
初三中考化学复习重点知识点总结
初三化学复习重点知识点总结
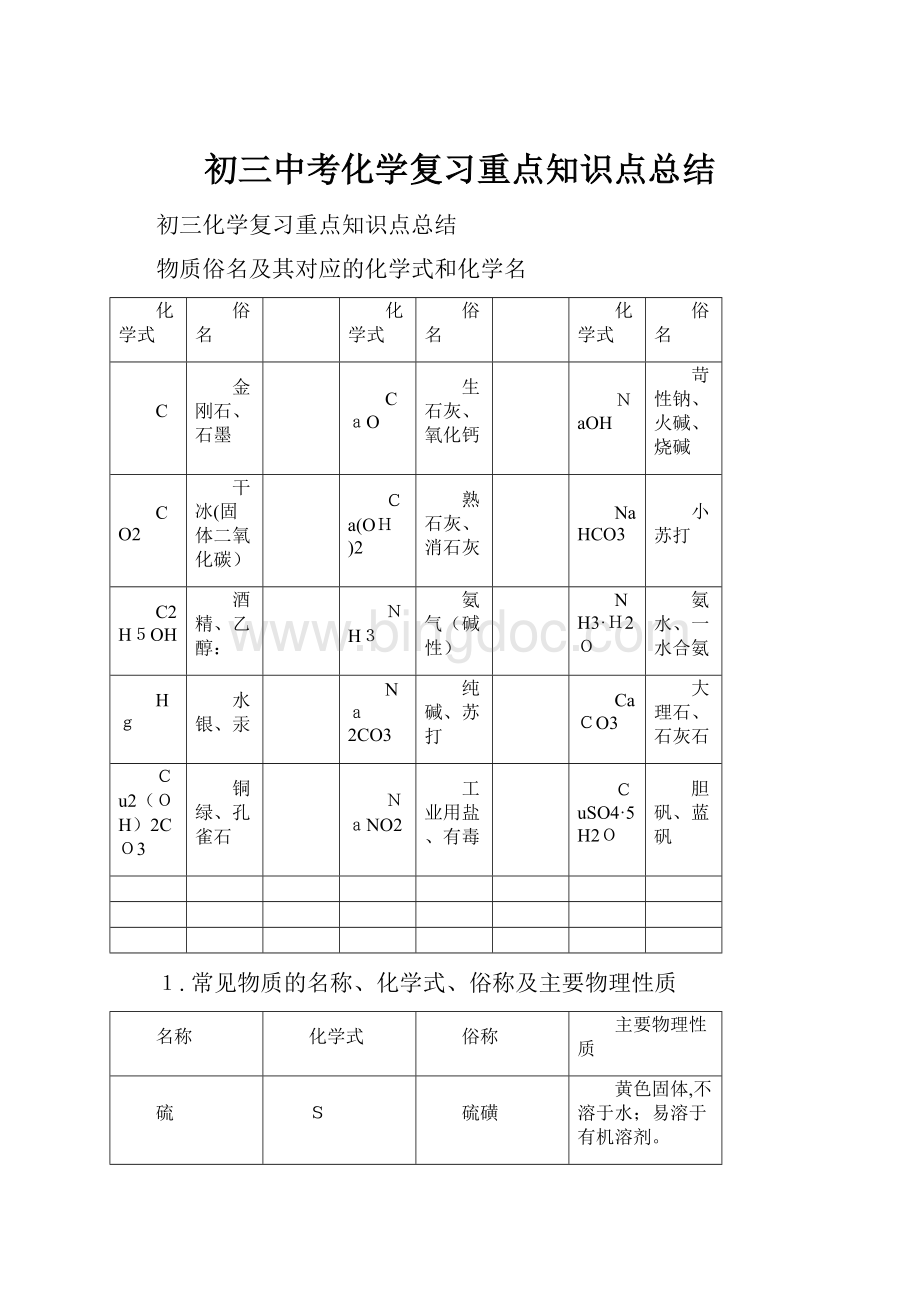
物质俗名及其对应的化学式和化学名
化学式
俗名
化学式
俗名
化学式
俗名
C
金刚石、石墨
CaO
生石灰、氧化钙
NaOH
苛性钠、火碱、烧碱
CO2
干冰(固体二氧化碳)
Ca(OH)2
熟石灰、消石灰
NaHCO3
小苏打
C2H5OH
酒精、乙醇:
NH3
氨气(碱性)
NH3·H2O
氨水、一水合氨
Hg
水银、汞
Na2CO3
纯碱、苏打
CaCO3
大理石、石灰石
Cu2(OH)2CO3
铜绿、孔雀石
NaNO2
工业用盐、有毒
CuSO4·5H2O
胆矾、蓝矾
1.常见物质的名称、化学式、俗称及主要物理性质
名称
化学式
俗称
主要物理性质
硫
S
硫磺
黄色固体,不溶于水;易溶于有机溶剂。
二氧化碳
CO2
固体俗称干冰
无色气体、能溶于水、密度比空气大,固体干冰易升华。
一氧化碳
CO
煤气
无色、无味气体、难溶于水,密度比空气略小,有毒性。
甲烷
CH4
沼气、坑气
无色、无味气体,极难溶于水,密度小于空气。
乙醇
C2H5OH
酒精
无色透明,具有特殊气味的易挥发的液体,可与水任意互溶。
乙酸
CH3COOH
醋酸、冰醋酸
无色有刺激性酸味的液体,易溶于水,固体称冰醋酸。
氧化钙
CaO
生石灰
白色固体,易吸水,有腐蚀性。
氧化铁
Fe2O3
铁锈、赤铁矿
红色固体,不溶于水。
四氧化三铁
Fe3O4
磁铁矿
黑色固体,不溶于水。
氢氧化钠
NaOH
火碱、烧碱、苛性钠
白色固体,极易溶于水,易潮解,有强腐蚀性。
氢氧化钙
Ca(OH)2
熟石灰、消石灰、石灰水
白色粉末状固体,微溶于水,有腐蚀性。
碳酸钠
Na2CO3
纯碱、口碱、苏打
白色粉末状固体,易溶于水且吸湿结块。
碳酸钠晶体
Na2CO3·10H2O
无色晶体,易失水风化。
碳酸氢钠
NaHCO3
小苏打
白色晶体,易溶于水,但溶解度比Na2CO3小。
氯化钠
NaCl
食盐
碳酸钙
CaCO3
石灰石、大理石
白色固体,不溶于水。
硫酸铜
CuSO4
白色粉末状固体,溶于水,其水溶液为蓝色。
硫酸铜晶体
CuSO4·5H2O
蓝矾、胆矾
蓝色晶体。
高锰酸钾
KMnO4
灰锰氧
紫色有光泽晶体,溶于水,其水溶液为紫色。
碱式碳酸铜
Cu2(OH)2CO3
铜绿
绿色粉末状固体,不溶于水。
氯化银
AgCl
新制得为白色凝乳状沉淀,不溶于稀硝酸。
硫酸钡
BaSO4
天然产称重晶石
白色固体,不溶于水,不溶于稀硝酸。
氢氧化铁
Fe(OH)3
新制得为红褐色沉淀。
氢氧化铜
Cu(OH)2
新制得为蓝色沉淀。
2.几种常见药品的存放
药品
性质
保存方法
白磷
着火点低,易自燃,不跟水反应
放入冷水中
浓硫酸
易吸收空气中的水分(吸水性)
放入玻璃瓶内,瓶塞要严
浓盐酸
易挥发
放入玻璃瓶内,瓶塞要严
浓硝酸
易挥发
放入玻璃瓶内,瓶塞要严
氧化钙
易吸水,易与空气中二氧化碳反应而变质
密封于干燥试剂瓶中
固体氢氧化钠
易潮解,易与空气中二氧化碳反应而变质
密封于干燥试剂瓶中
1.地壳中含量最多的金属元素是铝(Al)。
2.地壳中含量最多的非金属元素是氧(O2)。
3.空气中含量最多的物质是氮气(N2)
4.天然存在最硬的物质是金刚石(C)。
5.最简单的有机物是甲烷。
(CH4)
6.金属活动顺序表中活动性最强的金属是钾(K)。
7.相对分子质量最小的氧化物是水(H2O)。
最简单的有机化合物CH4
常见物质的颜色的状态
1.白色固体:
MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2.黑色固体:
石墨、炭粉、铁粉、CuO、MnO2、Fe3O4
KMnO4为紫黑色。
3.红色固体:
Cu、Fe2O3、HgO、红磷▲硫:
淡黄色▲Cu2(OH)2CO3为绿色
4.溶液的颜色:
凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般为无色。
(高锰酸钾溶液为紫红色)
5.沉淀(即不溶于水的盐和碱):
①盐:
白色↓:
CaCO3、BaCO3(溶于酸) AgCl、BaSO4(不溶于稀HNO3) 等
②碱:
蓝色↓:
Cu(OH)2 红褐色↓:
Fe(OH)3 白色↓:
Mg(OH)2。
6.
(1)具有刺激性气体的气体:
NH3、SO2、HCl(皆为无色)
(2)无色无味的气体:
O2、H2、N2、CO2、CH4、CO(剧毒)
▲注意:
具有刺激性气味的液体:
盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7.有毒的,气体:
CO 液体:
CH3OH;固体:
NaNO2CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)
解题技巧和说明
推断题解题技巧
看其颜色,观其状态,察其变化,初代验之,验而得之。
黑色:
MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)
蓝色:
CuSO4•5H2O、Cu(OH)2.CuCO3.含Cu2+溶液、液态固态O2(淡蓝色)
红色:
Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)
黄色:
硫磺(单质S)、含Fe3+的溶液(棕黄色)
绿色:
FeSO4•7H2O、含Fe2+的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]
无色气体:
N2、CO2、CO、O2、H2、CH4
有色气体:
Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:
NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:
H2S
(二)解实验题
看清题目要求是什么,要做的是什么,这样做的目的是什么。
实验用到的气体要求是比较纯净,除去常见杂质具体方法:
①除水蒸气可用:
浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等;
②除CO2可用:
澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等;
③ 除HCl气体可用:
AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液;
除气体杂质的原则:
用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
2.实验注意的地方:
①防爆炸:
点燃可燃性气体(如H2、CO、CH4)前,要检验气体纯度。
②防暴沸:
稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中。
③防中毒:
进行有关有毒气体(如:
CO、SO2、NO2)的性质实验时,在通风厨中进行;并要注意尾气的处理:
CO点燃烧掉; SO2、NO2用碱液吸收。
④防倒吸:
加热法制取并用排水法收集气体,要注意熄灯顺序
实验室制取三大气体中常见的要除的杂质:
(1)制O2要除的杂质:
水蒸气(H2O)
(2)用盐酸和锌粒制H2要除的杂质:
水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)
(3)制CO2要除的杂质:
水蒸气(H2O)、氯化氢气体(HCl)
除水蒸气的试剂:
浓流酸、CaCl2固体、碱石灰(主要成份是NaOH和CaO)、生石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)等;
除HCl气体的试剂:
AgNO3溶液(并可检验出杂质中有无HCl)、澄清石灰水、NaOH溶液(或固体)、KOH溶液(或固体);[生石灰、碱石灰也可以跟HCl气体反应]
常见气体的性质
(1)氧气O2 (通常状况下)化学性质及用途(O2)无色无味的气体,不易溶于水,密度比空气略大a. 供呼吸;b. 炼钢;c.气焊。
(注:
O2具有助燃性,但不具有可燃性,不能燃烧。
)
(2)氢气(H2)无色无味的气体,难溶于水,密度比空气小,是最轻的气体。
①可燃性:
a.填充气、飞舰(密度比空气小)b.合成氨、制盐酸c.气焊、气割(可燃性)4.提炼金属(还原性)
②还原性:
3H2+Fe2O3△2Fe +3H2O
(3)二氧化碳(CO2) 无色无味的气体,密度大于空气,能溶于水,固体的CO2叫“干冰”。
①CO2+H2O==H2CO3(酸性)(H2CO3 ===H2O+CO2↑)(不稳定)
a.用于灭火(应用其不可燃烧,也不支持燃烧的性质)b.制饮料、化肥和纯碱
CO2+Ca(OH)2 ==CaCO3↓+H2O(鉴别CO2)CO2+2NaOH==Na2CO3+H2O
②氧化性:
CO2+C== 2CO CaCO3==CaO+CO2↑(工业制CO2)
(4)一氧化碳(CO) 无色无味气体,密度比空气略小,难溶于水,有毒气体。
①可燃性:
2CO+O2== 2CO2
(火焰呈蓝色,放出大量的热,可作气体燃料)a. 作燃料b. 冶炼金属
②还原性:
3CO+Fe2O3高温2Fe+3CO2(跟血液中血红蛋白结合,破坏血液输氧的能力)
基本化学反应
物质反应
化学方程式
伴随现象
化合反应
镁在空气中燃烧
2Mg + O2点燃2MgO
耀眼的白光、放出热量、生成白色粉末
铁在氧气中燃烧
3Fe + 2O2 点燃Fe3O4
剧烈燃烧,火星四射、放出热量、黑色固体生成
氢气中空气中燃烧
2H2+ O2点燃2H2O
淡蓝色火焰、放出热量、烧杯内壁出现水雾
红(白)磷燃烧
4P+5O2点燃2P2O5
发出白光、放出热量、生成大量白烟。
碳在氧气中充分燃烧
C+O2点燃CO2
发出白光、放出热量、澄清石灰水变浑浊
碳不充分燃烧
2C + O2点燃2CO
CO2通过灼热碳层
C+ CO2高温 2CO
(吸热反应)
氧化钙溶于水
CaO+H2O==Ca(OH)2(放大量热)
白色块状固体变为粉末、生石灰制备石灰浆
二氧化碳溶于水
CO2+H2O===H2CO3
石蕊试液由紫色变成红色。
分解反应
水在通电分解
2H2O通电 2H2↑+O2↑
两电极上有气泡产生、(正氧负氢)
加热高锰酸钾
2KMnO4 △ K2MnO4+MnO2+O2↑
紫色变为黑色、生成使带火星木条复燃的气体
双氧水制氧气
2H2O2MnO22H2O+ O2↑
有气泡产生,带火星的木条复燃。
锻烧石灰石
CaCO3高温CaO+CO2↑
(二氧化碳工业制法)工业制备二氧化碳和生石灰
碳酸不稳定而分解
H2CO3=== H2O+ CO2↑
石蕊试液由红色变成紫色。
小苏打受热分解
2NaHCO3△Na2CO3+H2O+CO2↑
产生使澄清石灰水变浑浊的气体小苏打蒸馒头
置换反应 基本形式:
A+BC=AC+B单质和化合物反应生成另一种单质和另一种化合物
酸与金属反应
Zn+H2SO4==ZnSO4+H2↑ Fe+H2SO4==FeSO4+H2↑ Mg+2HCl== MgCl2+H2↑
放出气体
盐与金属反应
2Al+3CuSO4==Al2(SO4)3+3Cu
银白色金属表面覆盖有红色物质
铁溶于稀硫酸
Fe+H2SO4=FeSO4 + H2↑
有气体生成、溶液显浅绿色
CuSO4+Zn==ZnSO4+Cu
银白色金属表面覆盖有红色物质
Fe+CuSO4==Cu+FeSO4
银白色金属表面覆盖有红色物质、湿法炼铜、镀铜
焦炭还原氧化铁
3C+2Fe2O3 高温 4Fe+ 3CO2↑
木炭还原氧化铜
C+ 2CuO高温2Cu+CO2↑
黑色粉未变成红色,澄清石灰水变浑浊。
其他反应
苛性钠暴露在空气中变质 或 CO2通入氢氧化钠溶液
2NaOH+CO2====Na2CO3+H2O
CO2通入澄清石灰水
CO2+Ca(OH)2==CaCO3↓+ H2O
澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)
冶炼金属铁
Fe2O3+3CO 高温2Fe+3CO2
红色逐渐变为黑色
甲烷燃烧
CH4+2O2点燃 CO2 +2H2O
甲烷在空气中燃烧
酒精燃烧
C2H5OH+3O2 点燃2CO2+ 3H2O
酒精在空气中燃烧
复分解反应
复分解反应条件:
任意一个条件:
有水、气体、沉淀 生成
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
有白色沉淀生成 工业制烧碱、实验室制少量烧碱
Ca(OH)2+2HCl==CaCl2+2H2O
无明显现象
NaOH+HCl==NaCl+H2O
无明显现象
2NaOH+H2SO4==Na2SO4+2H2O
无明显现象
Fe2O3+6HCl==2FeCl3+3H2O
铁锈溶解、溶液呈黄色铁器除锈
Fe+ 2HCl === FeCl2+H2↑
固体溶解、溶液显浅绿色
Fe+CuSO4==Cu+FeSO4
银白色金属表面覆盖一层红色物质湿法炼铜、镀铜、溶液由蓝色变为浅绿色
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
2NaHCO3 △ Na2CO3+H2O+CO2↑
产生使澄清石灰水变浑浊的气体小苏打蒸馒头
CaCO3+2HCl==CaCl2+H2O+CO2↑
固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢
3HCl+Al(OH)3 ====AlCl3+ 3H2O
氢氧化铝药物治疗胃酸过多
NaHCO3 + HCl===NaCl+H2O + CO2↑
小苏打治疗胃酸过多
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
气体放出
CaCO3 +2HCl=== CaCl2 + H2O+CO2↑
气体放出
NaHCO3+HCl===NaCl+H2O+CO2↑
气体放出
Ca(OH)2+CO2====CaCO3↓+ H2O
消石灰放在空气中变质,生成白色不溶于水的固体
2NaOH +CO2 ====Na2CO3+ H2O
苛性钠暴露在空气中变质,遇水潮解,遇二氧化碳变质
HCl+AgNO3==AgCl↓+HNO3
白色沉淀生成、不溶于稀硝酸
Ba(OH)2+H2SO4==BaSO4↓+2H2O
白色沉淀生成、不溶于稀硝酸
CuO+H2SO4==CuSO4+H2O
黑色氧化铜溶于稀硫酸
CaCl2+Na2CO3==CaCO3↓+2NaCl
Na2SO4+BaCl2==BaSO4↓+2NaCl
初中化学敞口置于空气中质量改变的
(一)质量增加的;ﻫ
1、由于吸水而增加的:
氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2、由于跟水反应而增加的:
氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜ﻫ3、由于跟二氧化碳反应而增加的:
氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙
(二)质量减少的ﻫ
1、由于挥发而减少的:
浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2、由于风化而减少的:
碳酸钠晶体Na2CO3•10H2O失去结晶水
物质溶于水的吸热放热情况
NaOH固体、CaO固体、浓H2SO4、Ca(OH)2固体溶于水
放出热量、使周围温度升高
硝酸铵(NH4NO3)溶于水(多数的分解反应)
吸热,使周围温度下降
蔗糖、NaCl溶于水
不放热
初中化学溶液的酸碱性
1、显酸性的溶液:
酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:
碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:
水和大多数的盐溶液(CaCl2、NaCl)
金属和非金属单质、氧化物、酸、碱、盐之间的相互转化
物质
所用试剂
检验的方法、步骤
现象
化学反应实例
酸(H+)
⑴紫色石蕊试液
取少量酸于试管并加入几滴石蕊试液。
石蕊试剂由紫色变为红色。
⑵ 无色酚酞试液
取少量酸于试管并加入几滴酚酞试液。
无色酚酞试液不变色。
⑶pH试纸
蘸取少量酸滴在pH试纸上。
pH<7
碱
(OH-)
⑴ 紫色石蕊试液
取少量碱液于试管中并加入几滴石蕊试液。
石蕊试剂由紫色变为蓝色。
⑵无色酚酞试液
取少量碱液于试管中并加入几滴酚酞试液。
无色酚酞试液由无色变为红色。
⑶ pH试纸
蘸取少量碱液滴在pH试纸上。
pH>7
盐酸及可溶性氯化物
(Cl-)
AgNO3试剂和稀HNO3
⑴取少量待测液于试管中
⑵滴入几滴AgNO3试剂并滴加稀HNO3
产生不溶于稀HNO3的白色凝乳状沉淀。
HCl+AgNO3=AgCl↓+HNO3
NaCl+AgNO3=AgCl↓+NaNO3
硫酸及可溶性硫酸盐
(SO42-)
BaCl2试剂和稀HNO3
⑴取少量待测液于试管中
⑵滴入几滴BaCl2试剂并滴加稀HNO3
生成不溶于稀HNO3的白色沉淀。
H2SO4+BaCl2=BaSO4↓+2HCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
碳酸盐
(CO32-)
HCl或稀HNO3,澄清石灰水
⑴取少量待测固体或溶液于试管;
⑵ 加入几滴稀HCl或稀HNO3;
⑶ 将生成的气体通入澄清石灰水。
冒出气泡,气体能使澄清石灰水变浑浊。
CaCO3+HCl=CaCl2+CO2↑+2H2O
Na2CO3+2HCl=NaCl+CO2↑+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
1. 有关化学式的计算:
基本公式:
(1)相对分子质量=(化学式中各原子的相对原子质量×化学式中该元素原子个数)之和
(2)化合物中某元素质量分数=
(3)元素质量=物质质量×该元素的质量分数
2.有关溶液的计算
溶液质量=溶质质量+溶剂质量
溶液质量=溶液体积×密度
溶质的质量分数
饱和溶液溶质的质量分数
稀释公式:
浓溶液质量×稀释前浓度=稀溶液质量×稀释后浓度
浓溶液质量×大浓度+稀溶液质量×小浓度=混合溶液×中浓度
2.解题:
计算题的类型有
a.有关质量分数(元素和溶质)的计算
b.根据化学方程式进行计算
c.由a和b两种类型混合在一起计算
(1)溶液中溶质质量分数的计算
溶质质量分数 =溶质的质量/溶液的质量×100%
(2)化合物(纯净物)中某元素质量分数的计算
某元素质量分数=某元素的原子质量和/化合物的质量 ×100%
(3)混合物中某化合物的质量分数计算
化合物的质量分数=某化合物的质量/混合物的质量× 100%
(4)混合物中某元素质量分数的计算
某元素质量分数=某元素的质量和/混合物的质量×100%
或:
某元素质量分数=化合物的质量分数×该元素在化合物中的质量分数
(5)解题技巧
a.审题:
看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。
找出解此题的有关公式。
b.根据化学方程式计算的解题步骤:
①设未知量
②书写出正确的化学方程式
③写出有关物质的相对分子质量、已知量、未知量
④列出比例式,求解
⑤答。