实施指南无菌.docx
《实施指南无菌.docx》由会员分享,可在线阅读,更多相关《实施指南无菌.docx(39页珍藏版)》请在冰点文库上搜索。
实施指南无菌
14.6过滤除菌
本节旨在提供系统的方法对除菌过滤工艺进行选择和验证。
除菌过滤过程中的关键设备为除菌(级)过滤器,对其进行的具体确认和验证项目的相关原理和要求等,将在以下14.6.1~14.6.3中详细阐述。
按照不同药品分类,需要、推荐、可选和评估后确定是否进行的确认和验证项目,总结为下表。
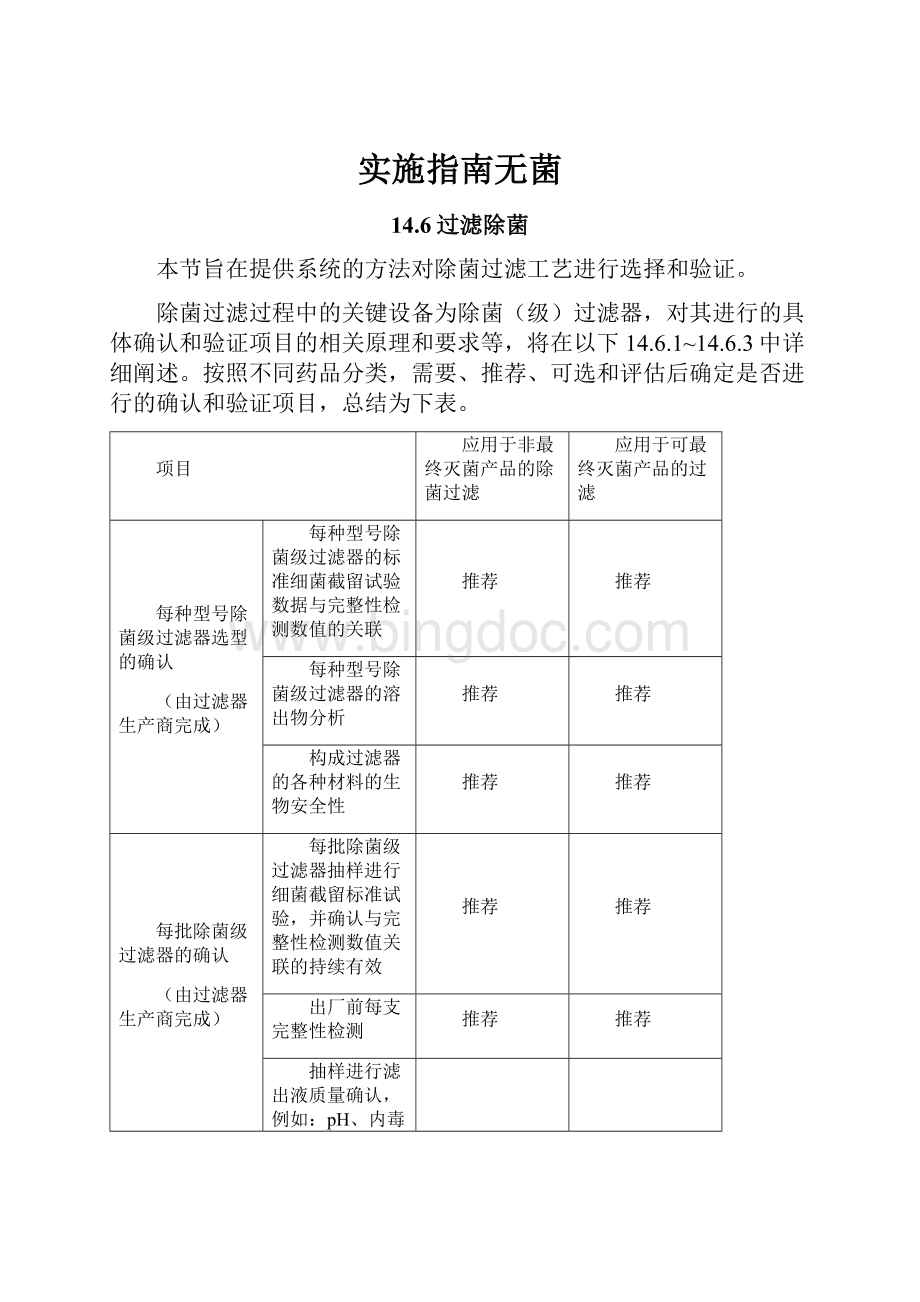
项目
应用于非最终灭菌产品的除菌过滤
应用于可最终灭菌产品的过滤
每种型号除菌级过滤器选型的确认
(由过滤器生产商完成)
每种型号除菌级过滤器的标准细菌截留试验数据与完整性检测数值的关联
推荐
推荐
每种型号除菌级过滤器的溶出物分析
推荐
推荐
构成过滤器的各种材料的生物安全性
推荐
推荐
每批除菌级过滤器的确认
(由过滤器生产商完成)
每批除菌级过滤器抽样进行细菌截留标准试验,并确认与完整性检测数值关联的持续有效
推荐
推荐
出厂前每支完整性检测
推荐
推荐
抽样进行滤出液质量确认,例如:
pH、内毒素、总TOC和洁净度
抽样进行湿热灭菌耐受测试
推荐
推荐
工艺验证
细菌截留
需要
可选
溶出物
需要
需要
化学兼容性
需要
可选
产品润湿的完整性
可选
可选
吸附
评估
评估
很多生产最终灭菌产品的企业,在最终灭菌前,为控制微生物污染水平,使用过滤器对最终灭菌前的产品进行过滤。
此时,不论该企业采用了何种过滤器,包括精度(标称)为0.45μm的过滤器、0.2μm的微生物污染控制过滤器,甚至0.2μm除菌级过滤器,因为这些过滤器的使用目的都是在最终灭菌之前对微生物污染水平进行控制,而不是作为产品生产过程中最后一步的灭菌手段,对这些过滤器的工艺验证要求,低于非最终灭菌产品除菌过滤过程中所使用的除菌级过滤器。
14.6.1除菌级过滤器的验证/细菌截留
【法规要求】
《药品生产质量管理规范》2010修订版:
附录1无菌药品
第九十条对可最终灭菌的产品不得以除菌过滤工艺替代最终灭菌工艺。
如果药品不能在其最终包装容器中灭菌,可用0.22m(更小或相同过滤效力)的除菌过滤器将药液滤入预先灭菌的容器内。
由于除菌过滤器不能将病毒或支原体全部滤除,可采用热处理方法来弥补除菌过滤的不足。
第九十一条与其它灭菌方法相比,除菌过滤的风险最大,因此,宜安装第二只已灭菌的除菌过滤器再过滤一次药液。
最终的除菌过滤滤器应尽可能接近灌装点。
第九十三条除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。
常用的方法有起泡点试验、扩散流试验或压力保持试验。
过滤工艺应经过验证,验证中应确定过滤一定量药液所需时间及过滤器二侧的压力;任何明显偏离正常时间或压力的情况应有记录并进行调查,调查结果应归入批记录。
第九十四条同一规格和型号的过滤器,应经过验证确定其使用时限。
编者理解:
在这里法规要求的第一个要点是在采用除菌过滤方法时,首先确认采用的过滤器为“除菌级”的,即“除菌过滤器”。
达到此要求后,除菌过滤法中的其它无菌保障措施才有意义。
定义过滤器是否为除菌级,需要依据过滤器的微生物截留能力,并完成相关的标准方法确认和工艺验证。
而过滤药液所用的时间、流速、温度、滤出总量、过滤器二侧压力(压差)、药液对微生物的生存性的影响和过滤器的重复使用等情况,都是可能影响过滤器细菌截留能力的重要因素,需要在验证过程中考虑并确证。
【背景介绍】
除菌过滤是指除去流体中微生物的工艺过程,该过程不应对产品质量产生不良影响。
包括液体和气体除菌过滤。
药品生产中采用的除菌过滤膜的孔径一般不超过0.22um(或者0.2um,这两种标称没有区别)。
当膜过滤器在1960年代出现在市场上时,0.45um孔径的膜被认为是“除菌级”的液体过滤器,并被成功应用于注射剂的除菌过滤。
这些过滤器采用黏质沙雷氏菌(Serratiamarcescens)进行挑战确认。
在1960年发布的论文中,美国FDA的FrancesBowman博士观察到经0.45um过滤器“除菌”过滤后的培养基被某种可以在104~106/cm2挑战水平下穿透该孔径滤膜的微生物反复污染。
这导致ASTMF-838标准的出台,该挑战水平成为验证液体除菌级过滤器的标准方法。
因为缺乏工业界内的统一标准来衡量孔径,孔径的标称对预测微生物截留和比较不同生产商生产的过滤器产品没有实际的意义。
因而,需要用微生物截留能力来定义除菌级过滤器。
通常,除菌级液体过滤器指在工艺条件下每cm2有效过滤面积可以截留107CFU(colonyformingunit,集落/菌落形成单位)的缺陷假单胞菌(Brevundimonasdiminuta,ATCC19146)的过滤器。
【技术要求】
A.除菌级过滤器的细菌截留验证
细菌挑战实验验证过滤器滤膜的级别并采用有代表性的挑战微生物证明其从某产品或该产品家族中完全去除微生物。
除菌级过滤器的验证需要考虑两个主要因素:
●滤膜级别,使用可适用的标准化试验或类似的方法以细菌挑战的方式进行。
●工艺验证,由过滤器的使用者或指派的实验设施(例如,过滤器的生产者或合同实验室),使用有代表性的微生物进行挑战,证明过滤器在生产条件下,可以完全去除每个产品或产品家族中的微生物。
应建立针对每个产品组的科学解释并可能需要在实施验证前经合适的监管机构审查。
这两种过滤器测试理念是不能互换的,并应当被独立验证。
这些测试的目的是为了证明过滤生产过程产生无菌的滤出液。
B.影响细菌截留的因素
应对可能影响细菌截留的因素进行风险评估,包括但不限于:
(1)过滤器源的因素,包括过滤器类型、结构、基础聚合物、表面改性化学、孔径分布和过滤膜的厚度等。
(2)工艺源的因素
生产工艺、产品或者料液对挑战微生物的生存性、理化形态的影响;实际微生物污染水平决定缺陷假单胞菌是否可以作为相关微生物;产品或者料液中的实际微生物污染水平(是否低于10CFU/100ml)影响过滤除菌工艺的设计和效能;还应考虑潜在的因产品配方或工艺条件,影响微生物的细胞大小或其它生理和形态学特性,从而造成微生物穿透的情况。
应考虑评估的工艺源因素:
●流体组分(配方、表面活性剂、添加剂)
●流体性质(pH值、粘度、渗透压,离子强度)
●工艺条件(时间、温度、压差、流速、灭菌方法和重复使用)
●产品、料液和生产环境中实际微生物污染的特点和水平
C.气体除菌过滤器
对于气体除菌过滤器的细菌截留要求,尚没有统一的标准。
但是,液体细菌挑战被认为是气体除菌过滤器的“最差条件”,因而,参照液体除菌级过滤器执行的细菌截留验证是被广泛接受的。
其它可以选择的方法,包括细菌(孢子)气溶胶挑战和噬菌体/病毒气溶胶挑战试验。
【实施指导】
本部分实施指导,均为针对液体过滤器的。
下文的实例分析部分会介绍一个气体除菌过滤器参照执行的例子。
A.细菌截留验证研究
细菌截留验证研究的目的是获得文件证据,证明在模拟工艺条件下,过滤过程可以持续去除悬浮于产品或替代流体中的高水平的标准细菌或相关微生物污染分离物。
研究的目的决定是使用膜片还是全尺寸工艺过滤器。
如果研究的目的是验证特定膜材的细菌截留效能,那么使用小的测试膜片通常被认为是可以满足条件的。
被用来确定工艺过滤器物理完整性的检测方法应当与细菌截留测试结果关联。
工艺时间和压差会影响细菌截留实验的结果。
在完整的工艺时间进行细菌挑战实验可以对那些与时间有关的因素进行评估,这些因素包括过滤器兼容性,完整性的维持和发生时间依赖的穿透等。
细菌挑战实验验证过程中的压差应达到或超过工艺过程的最大压差和/或最大的工艺流速(在过滤器制造商的设计规范内)。
在验证过程中同时模拟压差和流速可能是不可能的。
在设计模型挑战条件时过滤器的使用者应该确认哪个参数与特定工艺的相关性更高,并形成基本解释以支持相关决定。
对膜过滤器进行产品细菌截留验证时需要考虑以下事项:
●应对过滤工艺进行一次彻底评估,包括溶剂性质(例如水基的、酸、碱、有机的)、过滤时间、工艺压差、工艺流速、工艺温度和过滤器设计规范。
●产品细菌截留验证研究应包括多个过滤膜批次(通常三个批次)。
有些情况下,产品性质被认为对过滤膜有攻击性,过滤器的确切数目和实验设计视工艺而定。
●在用于细菌截留验证研究的三个批次中至少应有一个批次是进行预研究时或使用前物理完整性测试时的数值通过但是接近(例如,10%之内)过滤器生产商提供的合格规范限值的。
●细菌截留验证研究中使用的过滤膜的物理完整性检测数值应包括在实验报告中。
物理完整性检测应使用已有规范值的水、产品或其它润湿流体来进行测试,并在进行微生物挑战前完成。
●如果细菌挑战实验后测试用微生物在任何过滤器的下游被回收到,那么就需要对此进行调查。
如果调查确认测试用微生物穿透完整性检测达标的过滤器,那么就应重新考虑此种过滤器在这些工作条件下的适用性。
●具有相同组分而只有浓度不同的同一族产品,可以用挑战极限浓度的方法进行验证,替代性地接受中间的浓度。
如果某一产品被确定为最差情况的代表,对此的解释和数据需要和模型一起提供。
●过滤器的重复使用对于制药过程来说通常是不实际的或者不被推荐的。
然而,如果除菌级过滤器被重复使用了,需要说明理由,重复使用的参数也需要经过验证。
B.细菌截留验证研究——风险评估
不同等级的风险与过滤工艺参数是相联系的,有些与过滤前产品中的微生物繁殖有关,而另外一些与较高的细菌穿透过滤器的风险相关。
见表2。
表14-7工艺风险评估因素
较高风险
因素
较低风险
较高水平、小的生物体
微生物污染水平
较低水平、大的生物体
较高
压差
较低
较高
流速
较低
促进生长的
产品
杀菌的,或含防腐剂的
室温或更高
温度
冷藏
较长
时间
较短
C.挑战微生物选择标准
缺陷假单胞菌(B.diminuta)ATCC®19146TM(历史上为P.diminuta),被选择作为细菌挑战实验的微生物。
如果使用了其它细菌,这些细菌必须小至可以挑战除菌级过滤器的截留能力,并可以模拟在产品中发现的最小微生物。
相应地,替代挑战微生物可被用于验证研究,只要原有的过滤前微生物污染水平被发现是更相关的。
如果可能,自有微生物污染水平应该被描述、计数和鉴别,因为这些微生物有穿透除菌级过滤器的潜在可能性。
被分离的微生物形态也要考虑。
挑战微生物的尺寸需要通过穿透0.45微米孔径的膜来确认,这是每个挑战实验的阳性对照。
在标准培养基条件下生长的缺陷假单胞菌(见下“培养基维护和挑战微生物制备”)在高挑战水平下(通常≥107)会少量透过0.45微米滤膜。
有些情况下,缺陷假单胞菌不一定是代表最差条件的模型。
如果选用了不同的挑战微生物,需要提供文件解释。
D.培养基维护和挑战微生物制备
缺陷假单胞菌ATCC®19146TM可以冻干的形式从美国典型培养物中心(ATCC)或者本国的同等机构获得。
在按照ATCC的规程复壮微生物后,可以按照微生物操作规范在适宜的培养基中冷藏或冷冻保存。
需要建立用于挑战研究的工艺分离物的储存条件。
两种标准技术被公认适宜用于细菌挑战实验用缺陷假单胞菌的制备和维护。
它们是SLB法和FCP法(冷冻细胞浆法)。
两种方法都被发现可有效生产适宜的缺陷假单胞菌悬液,缺陷假单胞菌的尺寸大约为直径0.3-0.4微米,长度0.6-1.0微米。
替代的培养基和培养方法也可能同样有效制备缺陷假单胞菌,只要这些方法可以生产出单一的,分散的细胞,尺寸适宜穿过0.45微米孔径的膜过滤器。
替代培养法需要被验证。
库存的细菌挑战培养物的聚集情况可用光学显微镜检查。
如果观察到聚集现象,将保存培养物置于超生波清洗槽的冷水中10分钟是可将团聚物分散的一个方法。
水浴的气穴作用可将细菌细胞分散,不影响细胞活性。
应使用光学显微镜、活性计数和0.45微米孔径对照过滤器的下游回收来确认分散效果。
细菌挑战实验浓度应保证在目标工艺时间里提供始终如一的挑战,挑战的水平达到基于过滤器表面积至少107CFU/cm²。
当计算细菌挑战浓度时,应综合考虑诸如流速、时间和压差等操作参数。
大于等于107/cm²的细菌挑战水平就是对除菌级过滤器的要求(历史上用0.2微米孔径来标称的过滤器)。
这一水平来源于Bowman的观察和她的建议,即缺陷假单胞菌在大于104-106CFU/cm²细菌挑战水平时可穿透0.45微米标称的膜,应当用107CFU/cm2缺陷假单胞菌来证明0.2微米标称的膜为“除菌级”,以确保有足够的灵敏度发现超尺寸孔。
细菌挑战浓度(CFU/ml)不应与细菌挑战水平(CFU/cm2)相混淆。
缺陷假单胞菌悬液的生存力和滴度应使用合适的回收培养基来确认,例如大豆酪蛋白消化肉汤或者米勒辛顿琼脂。
当进行过滤器挑战时,细菌挑战菌悬液的活力滴度应当在挑战前和挑战后立刻被确定。
上游细菌滴度应使用被认可的微生物学测试方法确认。
应使用同样的培养基确认任何在下游回收的缺陷假单胞菌。
E.测试程序和方案形成
应使用标准方法确证膜过滤器的微生物截留能力。
然而,对于某种产品来说,仅证明缺陷假单胞菌在水溶液中被截留,而不是在特定产品中,不足以验证此产品的除菌过滤工艺。
为了确定正确的挑战测试方法,应将测试微生物直接接种在承载流体(产品或替代品)中以证明其生存性。
微生物应以与挑战实验中使用的同等方式培养,以保留其生物形态特征和生理特征。
用于生存性研究的测试暴露时间应该等于或超过实际工艺过滤时间。
当测试微生物在产品中的生存性已经完成测试,就应该形成挑战方法和方案了。
细菌挑战实验的条件应模拟实际生产工艺。
既然细菌挑战实验通常都在实验室里进行,那么方法的规模也应相应调整。
通量应调整到每单位面积的流速,表示为基于滤芯表面积的形式(ml/min)/cm2。
如果过滤过程按压差控制,则挑战实验压差至少等同于最大工艺压差。
如果制订方案过程中遇到关于测试方法可接受性的问题,则建议联系相关管理机构以获取指导。
图1列出了在为特定过滤器和产品/工艺组合选择合适的验证策略时需要考虑的关键步骤。
(1)非杀菌性的工艺和流体
直接在产品中接种测试微生物是测试除菌级过滤器微生物截留能力的首选方法。
当产品和工艺流体被证明在产品和工艺条件下没有杀菌效力的时候,这样是可行的。
在这些工艺中,应使用足够浓度的挑战微生物在产品中接种,而且要在实际工艺条件下,包括时间、压差、流速和其它关键变量(例如温度),应尽量减少稀释,以避免不必要的产品改变。
(2)抑菌的/杀菌的/非分散的挑战流体
在杀菌性的产品中进行细菌截留测试,使得与验证相关的一些问题更难回答,例如:
产品对过滤器有什么影响,产品对其中的生物菌落有什么影响。
在杀菌性产品中或是在不利于微生物活性的条件(例如,温度上升)下进行的细菌截留测试不一定能得到正确的结果。
为了评估产品/工艺对过滤器的潜在影响,可以使用产品和实际的工艺条件,包括流速、压差、温度和时间,对过滤器进行预处理。
这种预处理可在一个闭路系统中将产品循环通过测试过滤器或者单路通过测试过滤器,接着对滤芯进行细菌挑战。
(具体方法见下文实例分析部分测试方法修改的例子,这些修改被用于适应这种细菌挑战测试。
)
F.滤出液分析
对全部挑战滤出液的分析对确认除菌级过滤器截留细菌挑战的能力是必要的。
可以从安装在测试过滤器下游的合适的分析过滤器或膜片上直接通过,或者先收集滤出液在无菌容器中然后再用分析膜片过滤,两种方法均可。
通常,使用0.45微米或除菌级膜片来收集缺陷假单胞菌菌或其它微生物污染挑战细菌。
安装分析过滤器不应影响测试过滤器的预定压差。
对滤出液部分取样的作法不足以验证除菌过滤,因为一小部分细菌可能已经穿过过滤器,存在于未取样和分析的滤出液中。
G.结果判读
在阳性对照有效的情况下,三支测试过滤器都没有检测到挑战细菌的透过,则达到除菌级过滤器的接受标准。
如果有一支被发现细菌穿过,但没有确认是什么原因引起的,那么在调查和风险评估后,可重新测试(例如,从失败膜所属批次中选三支过滤器)。
如果可以找到导致测试失败的确定原因,那么疑问批次的过滤器应被重新检测。
H.连续过滤
两个或多个过滤器在一起使用,以达到:
●确保滤出液是无菌的。
●至少一个过滤器通过完整性测试。
●到达最后一级过滤器的细菌浓度小于10CFU/100ml。
这样的组合中,最后的最接近滤出液的过滤器,称为首要过滤器,另外一个或多个,为冗余过滤器,是对除菌过滤工艺的再次保障。
当怀疑发生细菌穿过除菌级过滤器的情况时,可以使用串联在一起的两个或多个过滤器滤器,实际为两个或者多个过滤器是作为一个除菌过滤单元在使用。
在这样的工艺条件下,所有过滤器均要达到完整性测试接受标准。
这种情况下的两个或多个过滤器的总称为组合过滤器。
图14-20除菌过滤工艺验证策略决策树
I.再验证
经过验证被用于特定除菌过滤工艺的除菌过滤器,在工艺条件发生改变或者过滤器制造方面发生改变是,需要进行再验证。
包括但不限于下列情况,需要考虑进行再验证:
●单位面积的流速高于已验证的参数
●过滤压差超过被验证参数
●暴露时间超过被验证的时间
●过滤面积不变的情况下提高过滤量
●过滤温度改变
●产品配方改变,包括浓度、pH或电导率
●过滤器的灭菌程序改变
●改变过滤器的制造商,或者过滤器的生产者改变了过滤膜的配方以及过滤器的其它结构性材料
【实例分析】
A.修改的方法
如前述,如果在工艺条件下挑战微生物不能存活或者生存力受到影响,在用产品预处理过滤器后,采用修改的方法进行测试。
下面给出一些方法修改的例子,实际应用时,可采用一种或几种进行组合测试。
应当认识到,如果有良好的科学解释,其它方式的方法修改也可能是适合的。
(1)减少暴露时间
有些情况下,挑战微生物不一定在整个工艺时间下都能在产品中存活。
在挑战实验预处理阶段接近尾声的时候直接用足够浓度(见前文实施指导“D.培养基维护和挑战微生物制备”)的挑战微生物接种产品。
有一点是很重要的,将一个0.45微米阳性对照过滤器与测试过滤器平行运行,以确证微生物的尺寸和存活。
另一个办法是将挑战微生物在静态状态下置于挑战流体中。
将挑战微生物以工艺温度暴露在产品中,并在模拟工艺条件下用产品循环对过滤器进行预处理后,就可在最差条件(压差和流速)下挑战过滤器了。
挑战时间应被缩减,以确保在实际暴露、挑战和回收期间挑战微生物存活。
0.45微米阳性对照过滤器与测试过滤器平行运行,以确认微生物的存活。
(2)修改测试方法的参数
在挑战有杀菌能力的产品时,测试方法参数修改是有用的,因为这种方法可以只改变一个工艺变量,例如温度。
使用这种方式以维持产品和细菌的相互反应。
这种方法不能解决所有可能的工艺/产品/挑战微生物的交互反应,但是可以实现标准挑战微生物的运用。
在实际工艺条件下使用产品对过滤器进行预处理后,工艺中的杀菌部分如温度被修改了,细菌挑战可以进行了。
应使用足够浓度的细菌挑战微生物直接接种产品。
(见前文实施指导“D.培养基维护和挑战微生物制备”)
(3)修改测试产品配方
另一种修改的方法在用产品预处理滤芯后,将产品的杀菌成分移除。
这也许很容易,调节pH值至产品非杀菌的范围,去除或者稀释杀菌成分或使用替代流体。
经修改的配方应在实际产品工艺条件下使用足够浓度的挑战微生物直接接种(见前文实施指导“D.培养基维护和挑战微生物制备”)杀菌成分应被去除到不干扰挑战微生物的水平。
(4)使用有耐受性的自身微生物污染分离物
尽管可能在正常工艺条件下,某种产品对缺陷假单胞菌有杀灭能力,但其它微生物可能在相同条件下可以生存。
另外一种对杀菌性产品进行细菌挑战的方法是使用“自身污染微生物”。
自身污染微生物由分离自制造环境或产品制剂的细菌组成,被证实可在实际生产工艺条件下在产品制剂中存活。
自有的细菌在产品中应繁殖或保持均衡,以确保他们的生物形态和生理学特性在工艺分离物中有代表性。
应使用最小的或最坏情况下的自身微生物。
关于挑战微生物制备与使用的更多讨论请见前文实施指导“D.培养基维护和挑战微生物制备”。
如果较小的微生物确认在产品中存在,那么这些微生物或某一合适的模式微生物可被用来挑战测试过滤器。
例如使用在恶劣条件下生长的皮氏罗尔斯顿氏菌(Ralstoniapickettii)。
通常,这些挑战是在缺陷假单胞菌挑战之外进行的。
B.气体过滤器的液体微生物挑战试验
挑战微生物和挑战水平,与液体除菌级过滤器相同。
但是,针对气体过滤器进行液体细菌挑战实验,需要注意以下几点:
●挑战前完整性检测。
可以使用的方法包括起泡点、扩散/前进流(压力保持/衰减)和水侵入。
方法参见14.6.2完整性检测。
●因为气体过滤器的疏水特性,在进行水基的微生物挑战前,需要用低表面张力的液体进行引导润湿(例如,25%体积比的叔丁醇水溶液或者60%异丙醇水溶液)。
●挑战之前,去除醇溶液,以防止影响挑战试验。
●挑战实验,同液体过滤器。
参照前文实施指导。
●挑战后完整性检测。
确证过滤器没有在挑战过程中损坏。
此时,与挑战前不同,不再可以选用水侵入方法,或者直接用水进行其它检测。
因为仍然存活或者不再存活的污染微生物都对过滤器的疏水性有影响,另外,任何仍然润湿的过滤器材质都可能影响实验结果。
可以选择挑战前完整性实验所使用的溶液,进行起泡点或者扩散/前进流测试。
●滤出液分析,同液体过滤器。
参照前文实施指导。
●结果判读。
对除菌级的气体过滤器,尚没有统一的标准。
但是,现在市场上获得的除菌级气体过滤器,有的已经可以达到液体除菌级过滤器的标准。
即大于107/cm2有效过滤面积的挑战微生物截留(通常为B.diminuta)。
14.6.2完整性检测
【法规要求】
《药品生产质量管理规范》2010修订版:
附录1无菌药品
第四十三条进入无菌生产区的生产用气体(不包括可燃性气体)均应经过除菌过滤。
用于无菌生产的公用介质(如压缩空气、氮气)的除菌过滤器和呼吸过滤器的完整性应定期检查。
第九十三条除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。
常用的方法有起泡点试验、扩散流试验或压力保持试验。
过滤工艺应经过验证,验证中应确定过滤一定量药液所需时间及过滤器二侧的压力;任何明显偏离正常时间或压力的情况应有记录并进行调查,调查结果应归入批记录。
编者理解:
细菌截留测试是一种破坏性试验,会对过滤器和生产环境造成污染,不能用来确证用于生产的过滤器的性能。
法规要求在这里指出了日常生产中用来确证过滤器性能的常规方法和注意事项。
【背景介绍】
细菌截留测试是一种破坏性试验,不能用来证明将用于生产的过滤器的完整性。
非破坏性物理性完整性测试的主要目的,是在不破坏过滤器的前提下确定是否存在可能危及过滤器截留能力的缺陷。
除此之外,完整性测试在相关工艺条件下建立测试过滤器与已被验证的细菌挑战过的过滤器的同一性。
该同一性的建立,是通过完整性试验结果与细菌截留测试相关联来达成的。
过滤器制造商通过对一系列具有不同完整性测试值的过滤器进行细菌挑战实验,直至观察到某些过滤器发生细菌透过,据此来为该类型的过滤器设定物理完整性检测的限值。
在完整性测试中,要在一定的压力范围内评估润湿的滤膜的气体流动特性。
在整个过滤器的滤膜被充分润湿后,在膜的上游侧引入低压气体,毛细管作用力会阻止水从小孔中被排出。
当在过滤器上游加压时,气体会溶解入润湿液体,扩散穿过润湿的膜,在膜的下游,即大气压下,被释放。
当施加于上游侧的压力升高时,扩散也加剧。
测量透过膜的气体量,就得到了此种膜过滤器的膜特性曲线。
显示在图14-21中的是在润湿膜下游测量到的空气流,为对类似孔隙率和孔径分布但是不同面积的膜进行的比较。
这些曲线的三个特征部分将作为膜过滤器完整性测试的基础:
●压力轴低端的线性部分表示扩散气流通过膜上有液体保持的孔。
●随压力升高,