河北狮州中学届高中化学毕业班下学期第一次月考试题Word格式.docx
《河北狮州中学届高中化学毕业班下学期第一次月考试题Word格式.docx》由会员分享,可在线阅读,更多相关《河北狮州中学届高中化学毕业班下学期第一次月考试题Word格式.docx(11页珍藏版)》请在冰点文库上搜索。
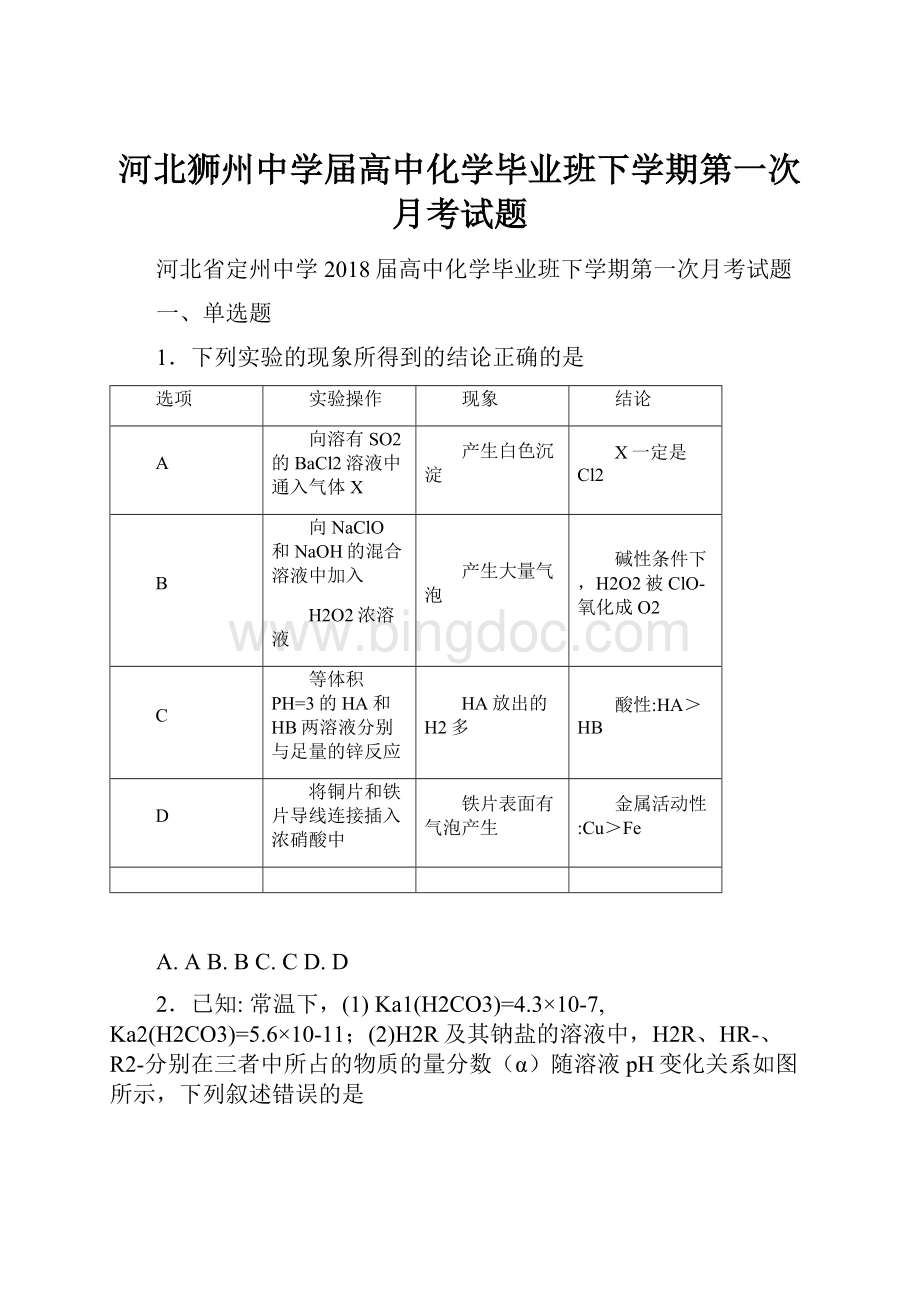
HA>HB
D
将铜片和铁片导线连接插入浓硝酸中
铁片表面有气泡产生
金属活动性:
Cu>Fe
A.AB.BC.CD.D
2.已知:
常温下,
(1)Ka1(H2CO3)=4.3×
10-7,Ka2(H2CO3)=5.6×
10-11;
(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是
A.在pH=4.3的溶液中:
3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C.在pH=3的溶液中存在c(R2−)×
c(H2R)/c2(HR−)=10-3
D.向Na2CO3溶液中加入少量H2R溶液,发生反应:
2CO32-+H2R=2HCO3-+R2-
3.某溶液中除H+、OH—外,还有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量之比为1:
1:
6,下列有关该溶液的判断正确的是
A.向该溶液中加入稀NaOH溶液,立即产生白色沉淀
B.将该溶液滴在KI淀粉试纸上,试纸变蓝
C.若该溶液的pH为1,则c(Mg2+)=0.2mol/L
D.向该溶液中加入过量铁粉,只有一种阳离子与铁反应
4.下列有关实验装置进行的相应实验,能达到目的的是
5.能证明乙酸是弱酸的实验事实是
A.常温下0.1mol/LCH3COONa溶液的pH大于7
B.CH3COOH溶液与Zn反应放出H2
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol/LCH3COOH溶液可使紫色石蕊变红
6.用电解法可制取有广泛用途的Na2FeO4:
Fe+2H2O+2NaOH
Na2FeO4+3H2↑,工作原理如图1所示。
装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。
若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
下列说法不正确的是
A.a是电源的正极
B.电解一段时间后,c(OH-)降低的区域在阴极室
C.电解过程中,阳极发生的电极方程式为Fe+8OH--6e-==FeO42-+4H2O
D.如图2,N点c(Na2FeO4)低于最高值的原因是氢氧化钠溶液浓度过高
7.室温下,1mol·
L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
A.H2A的电离方程式为:
H2A==H++HA-HA-
A2-+H+
B.室温下,电离平衡HA-
A2-+H+的平衡常数Ka=10-3。
C.等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:
c(Na+)>
c(HA-)>
c(A2-)
D.在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
8.已知:
2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1,如图为质子膜H2S燃料电池的示意图。
下列说法正确的是
A.电极a上发生的电极反应式为:
H2S-2e-=S+2H+
B.电池工作时,电流从电极b经过负载流向电极a
C.电路中每流过1mol电子,电池内部释放158kJ的热能
D.每11.2LH2S参与反应,有1molH+经固体电解质膜进入正极区
9.分子式为C6H12Cl2的有机物,分子中只含有一个甲基的结构有(不考虑立体异构)
A.5种B.7种C.9种D.11种
10.常温下,向20mL0.2mol·
L-1H2A溶液中滴加0.2mol·
L-1NaOH溶液。
有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,pH<
7
B.当V(NaOH)=20mL时,溶液中离子浓度大小关系为c(Na+)>
c(A2-)>
c(OH-)>
c(H+)
C.当V(NaOH)=10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D.当V(NaOH)=30mL时,2c(H+)+3c(H2A)+c(HA-)=2c(OH-)+c(A2-)
11.用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,利用生成的Fe2+可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如图。
A.由b口加入物质为O2
B.燃料电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
C.电解过程中,Fe(I)质量减少,Fe(Ⅱ)上有气体产生
D.电路中每转移6mol电子,最多有1molCr2O72-被还原
12.下列实验操作、现象和结论均正确的是
向包有Na2O2粉末的脱脂棉滴2滴水
脱脂棉燃烧
Na2O2与水反应放热
Fe(NO3)2样品中加入稀硫酸,再滴加KSCN溶液
溶液变为血红色
Fe(NO3)2样品已经变质
向FeCl3溶液中加入Mg(OH)2悬浊液,振荡
沉淀由白色变为红褐色
Fe(OH)3的溶度积小于Mg(OH)2
向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸
无红色沉淀生成
蔗糖没有发生水解反应生成葡萄糖
13.前20号元素W、X、Y、Z原子序数依次递增,W原子最外层电子数是次外层的3倍,X的简单离子半径在同周期中最小。
W、Z的质子数之和等于X、Y的质子数之和,X、Y、Z的最外层电子数之和等于W的核外电子数。
下列说法错误的是
A.W与X的简单离子具有相同的电子层结构
B.1molY的最高价氧化物含共价键数目为4NA
C.X、Z分别与W形成的化合物都具有相同类型的化学键
D.X、Y的单质均可以和Z的最高价氧化物对应的水化物溶液反应
14.化合物a、b的结构简式如图所示,下列说法正确的是
A.化合物b不能使酸性高锰酸钾溶液褪色B.a的消去产物中最多有15个碳原子共面
C.a、b均能发生还原反应、取代反应、消去反应D.b分子发生加成反应最多消耗4molH2
15.设NA为阿伏加德罗常数的值,下列说法正确的是
A.S+2KNO3+3C=K2S+3CO2↑+N2↑每生成0.5molN2,反应中转移电子数为6NA
B.agC2H4和C3H6混合气体含有的原子数目为aNA/14
C.lL0.2mol/LNaHCO3溶液中含HCO3-和CO32-的离子数之和为0.2NA
D.1mol·
L-1的NaClO溶液中含有ClO-的数目小于NA
16.常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如下图所示(不考虑C2O42-的水解)。
下列叙述正确的是
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04
17.a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。
A.若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B.若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C.若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D.若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
18.常温下,用0.100mol/L的AgNO3溶液滴定50.0mL,0.0500mol/LKCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-)、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×
10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×
10-12,Ksp(Ag2SO4)=1.4×
10-5,下列说法错误的是()
A.AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B.为防止指示剂失效,溶液应维持中性或弱碱性
C.滴定中指示剂的有效浓度应维持在2.0×
10-2mol/L
D.滴定完后加入1mL0.01mol/LH2SO4会产生新的沉淀
19.镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。
镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:
LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。
放电时总反应为LiAO2+nC=Li1-xAO2+LixCn(0<
x<
1),工作原理如下图所示,则以下说法错误的是()
A.放电时Ni元素最先失去电子
B.放电时电子从a电极由导线移向b电极
C.充电时的阳极反应式为LiAO2-xe-=Li1-xAO2+xLi+
D.充电时转移1mol电子,理论上阴极材料质量增加7g
20.常温下,分别向体积相同、浓度均为1mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lgC)间的关系如图。
下列对该过程相关分析正确的是
A.HB的电离常数(KA)数量级为10-3
B.其钠盐的水解常数(Kh)大小关系是:
NaB>
NaA
C.a、b两点溶液中,水的电离程度b<
a
D.当lgC=-7时,两种酸溶液均有pH=7
二、实验题
21.某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:
Cu2O在酸性溶液中会发生反应:
Cu2O+2H+=Cu+Cu2++H2O
探究一:
用如图所示装置进行实验,回答下列问题:
(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片
B.稀硝酸和铁片C.氢氧化钠溶液和铝片
D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:
①________③(填序号).
①打开止水夹
②熄灭C处的酒精喷灯③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;
乙同学认为观点不正确,其原因是_____________;
丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;
丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
三、计算题
22.向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1.00mol·
L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
已知:
图中V1:
V2=1:
2,当加入V2mLNa2CO3溶液时,所得溶液的浓度为1.00mol·
L-1,体积为200mL。
求:
(1)混合溶液中CaCl2和HCl物质的量之比n(CaCl2)∶n(HCl)=_______。
(2)m2=______g。
参考答案
BBBBABCBCDCACBADDDCB
21.向装置A中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变AC⑥⑤④②生成的铜与铁离子反应Cu2OCu2O+6H++2NO3-=2Cu2++2NO2+3H2O取丙同学反应后的溶液加KSCN溶液,若溶液变红色,则存在;
若不变红,则不存在0.55
22.1:
25.00