物理化学---知识点总结.doc
《物理化学---知识点总结.doc》由会员分享,可在线阅读,更多相关《物理化学---知识点总结.doc(34页珍藏版)》请在冰点文库上搜索。
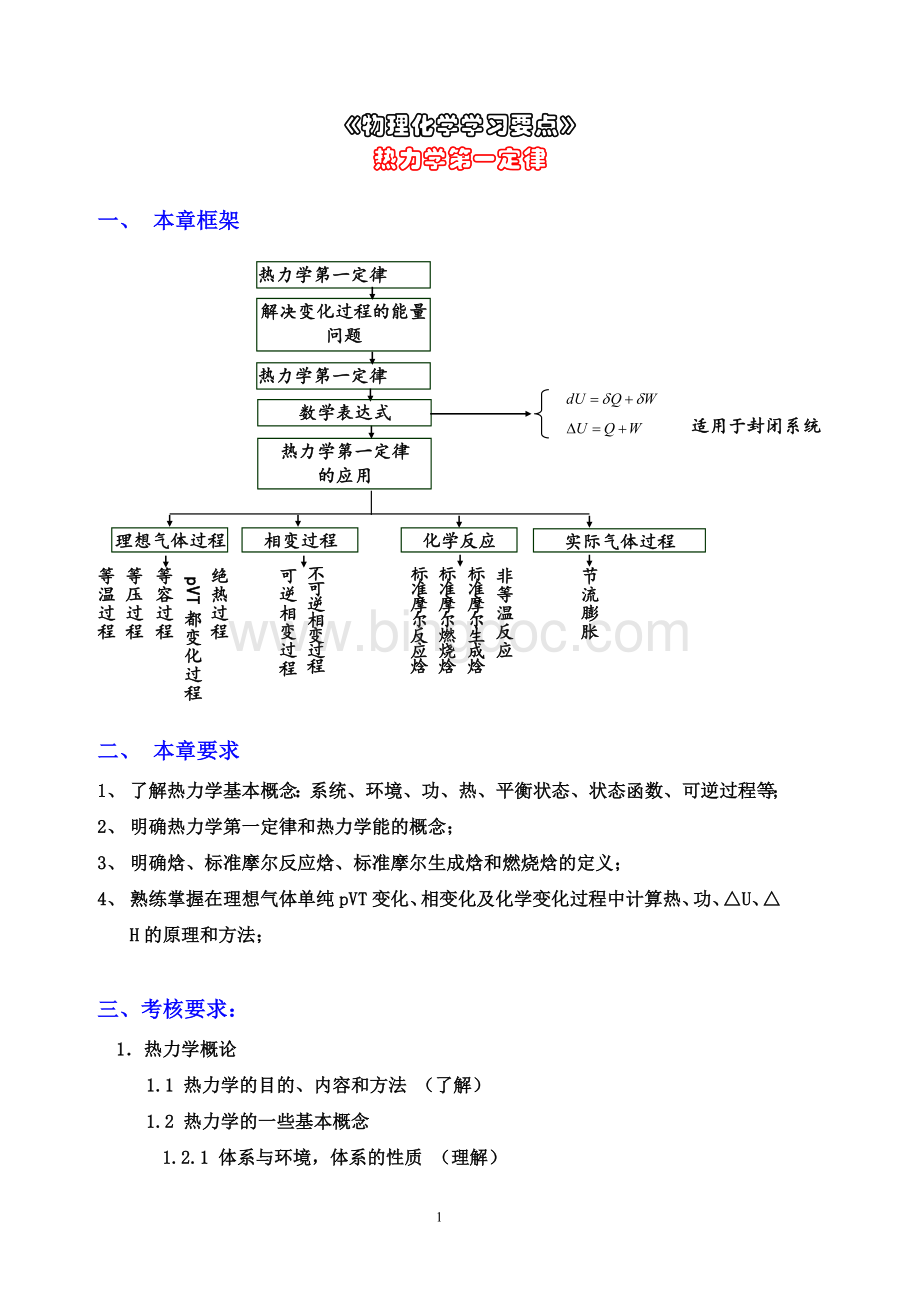
《物理化学学习要点》
热力学第一定律
一、本章框架
热力学第一定律
解决变化过程的能量问题
热力学第一定律
热力学第一定律
的应用
数学表达式
适用于封闭系统
理想气体过程
相变过程
化学反应
实际气体过程
等温过程
等压过程
等容过程
pVT都变化过程
绝热过程
可逆相变过程
不可逆相变过程
标准摩尔反应焓
标准摩尔燃烧焓
标准摩尔生成焓
非等温反应
节流膨胀
二、本章要求
1、了解热力学基本概念:
系统、环境、功、热、平衡状态、状态函数、可逆过程等;
2、明确热力学第一定律和热力学能的概念;
3、明确焓、标准摩尔反应焓、标准摩尔生成焓和燃烧焓的定义;
4、熟练掌握在理想气体单纯pVT变化、相变化及化学变化过程中计算热、功、△U、△H的原理和方法;
三、考核要求:
1.热力学概论
1.1热力学的目的、内容和方法(了解)
1.2热力学的一些基本概念
1.2.1体系与环境,体系的性质(理解)
1.2.2 热力学平衡态和状态函数(理解)
2.热力学第一定律
2.1热和功(掌握)
2.2热力学能(掌握)
2.3热力学第一定律的表述与数学表达式(应用)
3.体积功与可逆过程
3.1等温过程的体积功(应用)
3.2可逆过程与最大功(理解)
4.焓与热容
4.1焓的定义(了解)
4.2焓变与等压热的关系(应用)
4.3等压热容和等容热容(理解)
5.热力学第一定律对理想气体的应用
5.1理想气体的热力学能和焓(掌握)
5.2理想气体的Cp与Cv之差(理解)
5.3理想气体的绝热过程 (掌握)
6.热力学第一定律对实际气体的应用
6.1节流膨胀与焦耳-汤姆逊效应(了解)
7.热力学第一定律对相变过程的应用(掌握)
8.化学热力学
8.1化学反应热效应
8.1.1等压热效应与等容热效应(掌握)
8.1.2反应进度(了解)
8.2赫斯定律与常温下反应热效应的计算
8.2.1赫斯定律(应用)
8.2.2标准摩尔生成焓与标准摩尔燃烧焓 (掌握)
8.3标准反应焓变与温度的关系—基尔霍夫定律(应用)
四、重要概念
1、系统与环境;
2、隔离系统、封闭系统、敞开系统;
注意:
隔离系统Q=0,W=0
3、广度性质(加和性:
V,U,H,S,A,G)
强度性质(物质的量,T,p);
4、功W和热Q;
注意W与Q的符号;W与Q均为途径函数(非状态函数)
5、热力学能;
6、焓;
7、热容;
8、状态与状态函数;
9、平衡态;
10、 可逆过程;
11、节流过程;
12、真空膨胀过程;
13、标准态;
14、标准摩尔反应焓,标准摩尔生成焓,标准摩尔燃烧焓
五、重要公式与适用条件
1.体积功:
W=-p外dV(封闭系统,计算体积功)
2.热力学第一定律:
DU=Q+W,dU=Q+W(封闭系统)
3.焓的定义:
H=U+pV
4.热容:
定容摩尔热容CV,m=QV/dT=(¶Um/¶T)V
定压摩尔热容Cp,m=Qp/dT=(¶Hm/¶T)P
理想气体:
Cp,m-CV,m=R;
凝聚态:
Cp,m-CV,m≈0
理想单原子气体CV,m=3R/2,Cp,m=CV,m+R=5R/2
5.标准摩尔反应焓:
由标准摩尔生成焓DfHBy(T)或标准摩尔燃烧焓DcHBy(T)计算
DrHmy=SvBDfHBy(T)=-SvBDcHBy(T)
6.基希霍夫公式(适用于相变和化学反应过程)
DrHmy(T2)=DrHmy(T1)+
7.等压摩尔反应热与等容摩尔反应热的关系式
Qp-QV=DrHm(T)-DrUm(T)=SvB(g)RT
8.理想气体的可逆绝热过程方程:
六、各种过程Q、W、DU、DH的计算
1、理想气体:
等温过程dT=0,DU=DH=0,Q=W;
非等温过程,DU=nCV,mDT,DH=nCp,mDT,
单原子气体CV,m=3R/2,Cp,m=CV,m+R=5R/2
2、对于凝聚相,状态函数通常近似认为与温度有关,而与压力或体积无关,即
DU≈DH=nCp,mDT
3.等压过程:
p外=p=常数,非体积功为零W'=0
(1)W=-p外(V2-V1),DH=Qp=,DU=DH-D(pV),Q=DU-W
(2)真空膨胀过程p外=0,W=0,Q=DU
理想气体结果:
dT=0,W=0,Q=DU=0,DH=0
(3)等外压过程:
W=-p外(V2-V1)
4.等容过程:
dV=0
W=0,QV=DU=,DH=DU+VDp
5.绝热过程:
Q=0
(1)绝热可逆过程W==DU=,DH=DU+DpV
理想气体:
(2)绝热一般过程:
由方程W=DU=建立方程求解。
6.节流过程(等焓过程):
DH=0,Q=0
焦耳-汤姆逊系数μJ-T=(¶T/¶p)H,理想气体μJ-T=0,实际气体μJ-T≠0
7.相变过程:
(1)可逆相变(正常相变或平衡相变):
在温度T对应的饱和蒸气压下的相变,如水在常压下的0℃结冰或冰溶解
(2)不可逆相变
《物理化学学习要点》
热力学第二定律
一、本章框架
二、本章要求
1.了解自发过程的共同特征;
2.理解第二、第三定律的表述;
3.了解卡诺循环的意义;
4.理解克劳修斯不等式;
5.掌握熵增原理和平衡判据的一般准则;
6.明确熵、赫姆霍兹函数、吉布斯函数、标准摩尔熵及标准摩尔生成吉布斯自由能的定义并会应用;
7.熟练掌握在理想气体单纯pVT变化、相变及化学变化过程中计算△S、△A、△G的原理和方法;
8.理解热力学基本方程;
9.掌握推导热力学公式的演绎方法;
10.了解麦克斯韦关系式的推导及应用;
三、重要概念
1.卡诺循环
2.热机效率
3.熵
4.亥姆霍兹函数
5.吉布斯函数
四、主要公式与定义式
1.热机效率:
η=-W/Q1=(Q1+Q2)/Q1=1-T2/T1
2.卡诺定理:
任何循环的热温熵小于或等于0
不可逆
可逆
Q1/T1+Q2/T2≤0
3.熵的定义式:
dS=Qr/T
4.亥姆霍兹(Helmholtz)函数的定义式:
A=U-TS
5.吉布斯(Gibbs)函数的定义式:
G=H-TS,G=A+pV
6.热力学第三定律:
S*(0K,完美晶体)=0
7.过程方向的判据:
(1)等温等压不做非体积功过程(最常用):
dG<0,自发(不可逆);dG=0,平衡(可逆)。
(2)一般过程用熵判据:
DS(隔离系统)>0,自发(不可逆);
DS(隔离系统)=0,平衡(可逆)。
DS(绝热系统)>0,自发(不可逆);
DS(绝热系统)=0,平衡(可逆)。
(3)等温等容不做非体积功过程:
dA<0,自发(不可逆);dA=0,平衡(可逆)。
8.热力学基本方程与麦克斯韦关系式
基本式:
dU=TdS-pdV
其他式:
dH=d(U+pV)=TdS+Vdp
dA=d(U-TS)=-SdT–pdV
dG=d(H-TS)=-SdT+Vdp
以上系列式,应重点掌握dG=-SdT+Vdp
在恒压下的关系式dG=-SdT和恒温时的关系式dG=-Vdp。
麦克斯韦关系式(了解):
若dF=Mdx+Ndy,则(¶M/¶y)x=(¶N/¶x)y
即:
利用dU=TdS-pdV关系有:
-(¶T/¶V)S=(¶p/¶S)V
dH=TdS+Vdp关系有:
(¶T/¶p)S=(¶V/¶S)p
dA=-SdT-pdV关系有:
(¶S/¶V)T=(¶p/¶T)V
dG=-SdT+Vdp关系有:
-(¶S/¶p)T=(¶V/¶T)p
五、DS、DA、DG的计算
1.DS的计算
(1)理想气体pVT过程的计算
dS=Qr/T=(dU-Wr)/T=(nCV,mdT-pdV)/T
(状态函数与路径无关,理想气体:
p=nRT/V)
积分结果:
DS=nCV,mln(T2/T1)+nRln(V2/V1)(代入:
V=nRT/p)
=nCp,mln(T2/T1)+nRln(p1/p2)(Cp,m=CV,m+R)
特例:
等温过程:
DS=nRln(V2/V1)
等容过程:
DS=nCV,mln(T2/T1)
等压过程:
DS=nCp,mln(T2/T1)
(2)等容过程:
DS=(nCV,m/T)dT
(3)等压过程:
DS=
(4)相变过程:
可逆相变DS=DH/T
(5)环境过程:
认为是恒温的大热源,过程为可逆
DS=Qr(环)/T(环)=-Q(系)/T(环)
(6)绝对熵的计算:
利用热力学第三定律计算的熵为绝对熵,过程通常涉及多个相变过程,是一个综合计算过程。
(7)标准摩尔反应熵的计算
DrSmy=SvBSmy(B,T)
2.DG的计算
(1)平衡相变过程:
DG=0
(2)等温过程:
DG=DH-TDS
(3)非等温过程:
DG=DH-DTS=DH-(T2S2-T1S1)=DH-(T2DS-S1DT)
诀窍:
题目若要计算DG,一般是恒温过程;若不是恒温,题目必然会给出绝对熵S的值。
3.DA的计算
(1)恒温恒容不做非体积功可逆过程:
DA=0
(2)恒温:
DA=DU-TDS=DG-D(pV)
(3)非恒温过程:
DG=DU-DTS=DU-(T2S2-T1S1)=DU-(T2DS-S1DT)
诀窍:
题目若要计算DA,一般是恒温过程;若不是恒温,题目必然会给出绝对熵。
二、本章要求
1. 了解自发过程的共同特征;
2. 理解第二、第三定律的表述;
3. 了解卡诺循环的意义;
4. 理解克劳修斯不等式;
5. 掌握熵增原理和平衡判据的一般准则;
6. 明确熵、赫姆霍兹函数、吉布斯函数、标准摩尔熵及标准摩尔生成吉布斯自由能的定义并会应用;
7. 熟练掌握在理想气体单纯PVT变化、相变及化学变化过程中计算△S、△A、△G的原理和方法;
《物理化学学习要点》
化学势
一、 本章框架
多组分系统
多相(可分为若干单相)
单相
溶液
混合物
液态溶液
固态溶液
理想稀溶液
实际溶液
电解质溶液
非电解质溶液
气态混合物
液态混合物
固态混合物
按导电性分
理想混合物
实际混合物
按聚集态分
按聚集态分
按规律分
按聚集态分
二、本章要求
1、掌握组成表示法及其相互关系;
2、掌握拉乌尔定律和亨利定律并会用于计算;
3、理解偏摩尔量及化学势的含义及意义;
4、掌握有关依数性的计算;
5、了解理想气体混合物、理想液态混合物、理想稀溶液中各组分化学势的表达式、逸度和活度的标准态及对组分活度系数的简单计算。
三、重要概念
1、组成表示:
物质B的摩尔分数xB、质量分数wB、(物质的量)浓度cB、质量摩尔浓度bB.
注意:
混合物(各组分标准态相同)与溶液(分溶剂和溶质,标准态不同);
2、拉乌尔定律和亨利定律;
3、偏摩尔量与化学势;
4、理想液态混合物;
5、理想稀溶液;
6、非理想溶液混合物;
7、逸度和逸度系数;
8、活度和活度系数;
9、稀溶液的依数性。
四、重要定理与公式
1.拉乌尔定律:
稀溶液溶剂A的蒸气压与纯溶剂的蒸气压关系pA=pA*xA
2.亨利定律:
稀溶液挥发性溶质B的蒸气压pA=kxA,k为亨利常数
3.稀溶液的依数性:
(1)蒸气压下降:
DpA=pA*-pA=pA*xB
(2)凝固点降低:
DTf=KfbB,Kf–溶剂有关的凝固点降低常数
(3)沸点升高:
DTb=KbbB,Kf–溶剂有关的沸点升高常数
(4)渗透压:
在半透膜两边的平衡压力差π=cRT
4.化学势定义μ=(¶G/¶nB)T,p,nc≠nB
(1)理想气体的化学势
μ=μy+RTln(p/py)
(2)实际气体的化学势与逸度f
μ=μy+RTln(fB/py)
其中逸度系数fB=γBpB,理想气体γB=1。
5.过程方向判据:
dT=0,dp=0,W'=0时
(1)相变过程:
自发过程方向Dμ<0。
可逆相变Dμ=0
(2)化学反应:
恒温恒压下自发过程方向DvBμB<0。
6.理想液态混合物的性质
理想液态混合物:
任一组分在全部组成范围内都符合拉乌尔定律的混合物。
(1)化学势μB=μBy+RTlnxB
(2)混合过程性质的变化量
DmixV=0,DmixH=0,
DmixS=-nRSxblnxB,
DmixG=DmixH-TDmixS=nRTSxblnxB,
7.真实液态混合物:
浓度用活度代替
μB=μBy+RTlnaB
其中aB=fBxB,fB–活度系数。
五、典型题型
1.根据稀溶液的性质作依数性等方面的计算
2.在多相平衡一章中常用拉乌尔定律和亨利定律。
《物理化学》学习要点
化学平衡
一、 本章框架
化学反应方向
反应限度---化学平衡
化学平衡
判断方法
ΔrGm
等
温
方
程
式
平衡常数
表示方法
Kθ的计算
影响因素
压力
的
影响
温度的
影响
惰性组分的
影响
热力学法
由反应式算
气相
液相
复相
由
生
成
吉
布
斯
函
数
算
二、 本章要求
1、理解标准平衡常数的含义;
2、掌握有关理想气体、简单复相化学平衡的计算方法;
3、掌握标准摩尔反应吉布斯自由能的求算和应用;
4、能判断一定条件下化学反应可能进行的方向和限度;
5、会分析温度、压力、组成等因素对平衡的影响;
6、会计算不同温度下的标准平衡常数及平衡组成;
7、了解Kf、Ka等概念;
三、主要内容
1、化学反应平衡条件;
2、化学反应等温方程式;
3、压力商;
4、标准平衡常数;
5、复相化学平衡;
6、标准摩尔反应吉布斯自由能;
7、平衡常数与温度的关系--范特霍夫等压方程式;
8、各种因素对平衡组成的影响;
四、主要公式
1.理想气体反应的等温方程:
DrGm=DrGmy+RTlnQp
其中:
(1)压力商Qp=
注意:
对于多相反应,通常只考虑气相组分,固相或液相的活度近似认为不变。
(2)标准反应摩尔吉布斯函数变:
DrGmy==-RTlnKy
(3)标准平衡常数:
Ky=exp(-DrGmy/RT)=QP(平衡)
(即平衡常数的两种计算方法)
(4)等温等总压时,DrGm=DrGmy+RTlnQp=RTln(Qp/Ky)<0即Qp2.平衡常数与温度的关系-化学反应的等压方程
dlnKy/dT=DrHmy/(RT2)(微分式)
(1)DrHmq为常数ln(K2y/K1y)=-(DrHmy/R)(1/T2-1/T1)(定积分)
(不定积分)
(2)DrHmy与温度有关:
DrHmy(T2)=DrHmy(T1)+
再利用DCp=Da+DbT+DcT2代入基本式进行计算。
(了解)
3.各种平衡常数的关系与影响理想气体反应平衡的其它因素
Ky=Kpy(py)-Dv=Ky(p/py)Dv=Kcy(cyRT/py)Dv=Kn(p/pySnB)Dv
其中:
Dv=SvB,pB=pyB=pnB/SnB=(cB/cBy)cByRT
(1)若反应的Dv>0,总压p增大,Ky不变,Ky减少,产物分压减少,反应朝反应物方向移动。
Ky=Ky(p/py)Dv
(2)惰性组分的影响:
Ky=Kn(p/pySnB)Dv,相当于降低总压。
五、典型类型
1.标准摩尔反应吉布斯函数DrGmy的计算
(1)由标准生成吉布斯函数计算:
DrGmy=SvBDfGmyB
(2)由DrHmy和DrSmy计算:
DrGmy=DrHmy-TDrSmy
(3)由平衡常数计算:
DrGmy=-RTlnKy
(4)由相关反应计算:
利用状态函数的加和性进行。
(5)等温等压下,DrGm=DrGmy+RTlnQp<0反应正向进行
2.平衡常数的计算
(1)由DrGmy计算:
Ky=exp(-DrGmy/RT)
(2)由平衡组成计算:
Ky=QP(平衡)
(3)由相关反应的平衡常数进行计算
(4)由Ky(T1)计算Ky(T2):
利用等压方程。
《物理化学》学习要点
多相平衡
一、 本章框架
二、 本章要求
1、理解相律的推导、意义、应用;
2、掌握单组份系统T—p图和二组份系统典型p—X图、T—X图的特点和绘制方法;
3、理解相图中各相区、线和特殊点的意义;
4、理解步冷曲线和热分析法;
5、掌握二组分低共熔系统相图的绘制;
6、会用杠杆规则进行计算;
7、了解精馏原理、三组份系统相图的表示方法;
8、理解克拉佩龙方程和克劳修斯—克拉佩龙方程的推导及应用。
三、主要内容
1、相律;
2、克拉佩龙方程;
3、单组份系统相图;
4、二组份系统相图;
5、理想液态混合物气液平衡;
6、真实液态混含物气液平衡;
7、部分互溶液—液及液一液-气平衡;
8、完全不互溶气液平衡;
9、液固平衡;
10、精馏原理;
11、热分析法;
12、杠杆规则三组份系统相图的表示方法。
四、主要概念
组分数;
自由度;
相图;
共熔点;
三相线;
步冷曲线
五、重要定律与公式
1、相律:
f=K-Φ+n,其中:
K=S-R-R’
(1)强度因素T,p可变时n=2
(2)对单组分系统:
K=1,f=3-Φ
(3)对双组分系统:
K=2,f=4-Φ;应用于平面相图时恒温或恒压,f=3-Φ。
2、相图
(1)相图:
相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:
实验主要是测定系统的相变点。
常用如下四种方法得到。
对于气液平衡系统,常用方法蒸气压法和沸点法;
液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图
对于单组分系统K=1,f=K-Φ+2=3-Φ。
当相数Φ=1时,自由度数f=2最大,即为双变量系统,通常绘制蒸气压-温度(p-T)相图,见下图。
(a)正常相图(b)水的相图(c)硫的相图
4、二组分系统的相图
类型:
恒压的t-x(y)和恒温的p-x(y)相图。
相态:
气液相图和液-固(凝聚系统)相图。
(1)气液相图
根据液态的互溶性分为完全互溶(细分为形成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p-x(压力-组成)图或恒压下的t-x(温度-组成)图,见图6-2和图6-3。
(a)理想混合物(b)最大负偏差的混合物(c)最大正偏差的混合物
(a)理想或偏差不大的混合物(b)具有最高恒沸点(大负偏差)(c)具有最低恒沸点(大正偏差)
(d)有最高会溶点的部分互溶系统(e)有最高和最低会溶点的部分互溶系统(f)沸点与会溶点分离
(g)液相部分互溶的典型系统(h)液相有转沸点的部分互溶系统(i)液相完全不互溶的系统
(2)液-固系统相图:
通常忽略压力的影响而只考虑t-x图。
简单的相图也可分为固相部分完全互溶(形成固溶体a,b)、固相部分互溶(细分为有一低共溶点和有一转变温度的系统)、固相完全不互溶(形成低共熔混合物)、固相形成稳定化合物和固相形成不稳定化合物的相图,见下。
液相完全互溶,固相完全互溶、固相部分互溶和完全不互溶的液固相图与液相完全互溶、部分互溶和完全不互溶的气液相图的形状相似,只不过在液固相图中的固态和液态在气液相图中变为液态和气态。
稳定化合物熔化时固相和液相组成相同,其相图见下图,相当于两个双组分系统A-C和C-B相图的组合。
不稳定化合物加热到一定温度后分解成一种固体和溶液,溶液组成与化合物组成不同,典