博明教育实验探究题型Word下载.docx
《博明教育实验探究题型Word下载.docx》由会员分享,可在线阅读,更多相关《博明教育实验探究题型Word下载.docx(22页珍藏版)》请在冰点文库上搜索。
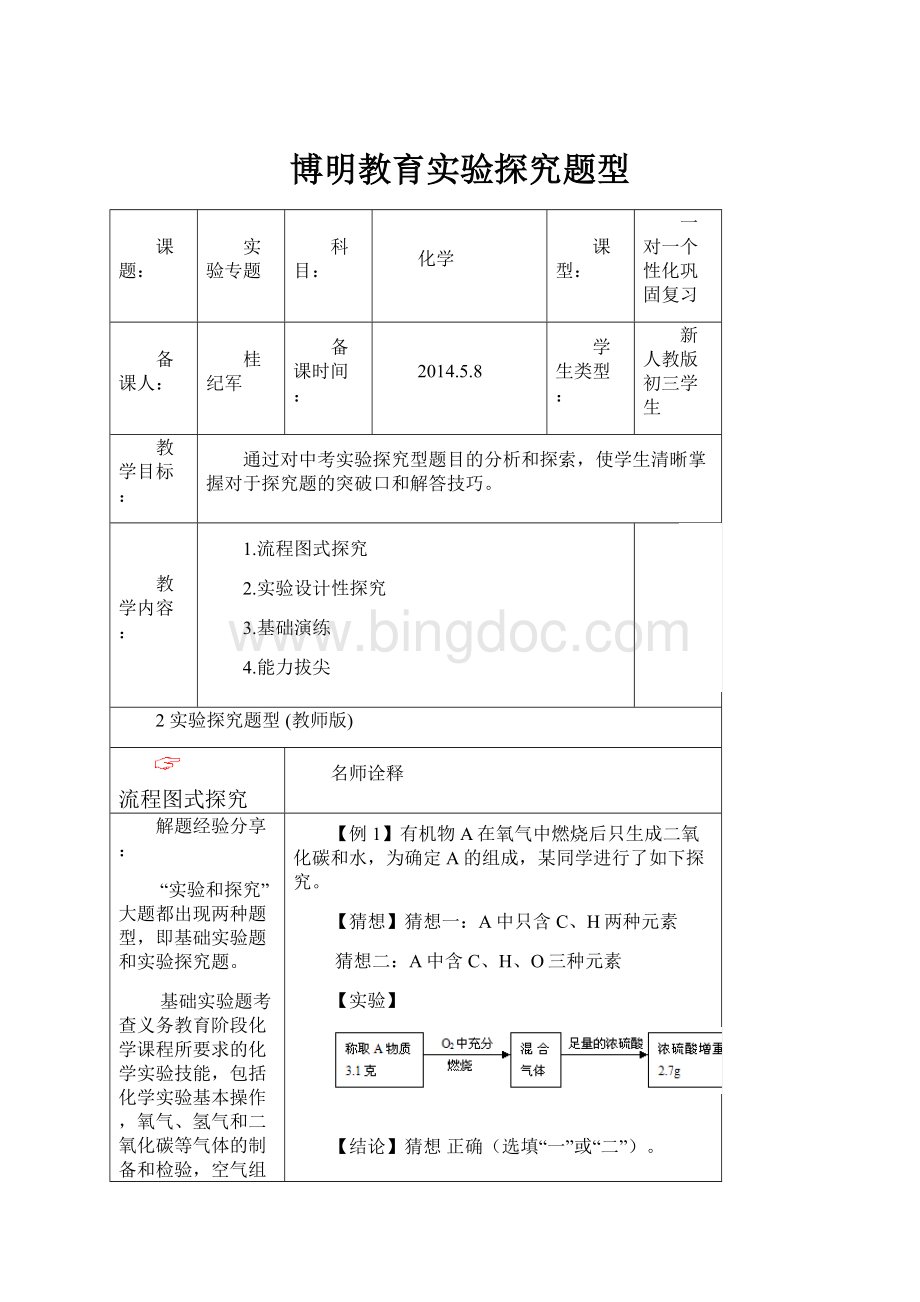
【结论】猜想正确(选填“一”或“二”)。
【反思】有机物A中所含元素的质量比为。
【解】
【例2】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+4HCl=====4NaCl+2CO2↑+O2↑+2H2O
【实验装置】
【交流与讨论】
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)装置②的作用是:
;
(2)装置③的作用是:
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。
但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是;
(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:
称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g。
则该样品的纯度为。
【例3】一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学,
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据
(1)中所写的化学方程式.合成气中CO和H2的质量比为。
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:
【设计买验步骤】
①连接好装置并检查气密性。
②装入药品,通人一段时间合成气。
③分别称量装置D、E的质量。
④缓缓通入合成气,加热装置C,使其充分反应。
⑤停止加热,继续通入合成气至恢复到室温。
⑥再次分别称量装置D、E的质量。
【完善实验设计】经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤(填实验步骤的序号)中点燃(点燃前应对气体验纯)。
【进行实验】该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
装置D的质量
装置E的质量
反应前
292.4g
198.2g
反应后
296.0g
201.5g
①装置C中出现色物质。
②称量数据如右表所示。
【现象分析和数据处理】
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO。
试通过计算说明他的推测依据。
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。
你认为该误差对乙同学的推测结果是否有影响?
(选填“是”或“否”,并说明理由)。
【拓展探究】该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究。
【查阅资料】甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;
白色的无水硫酸铜遇水会变成蓝色。
【实验设计】该小组同学拟用纯净的甲烷气体和如下装置进行实验。
①上图装置F中盛放的试剂名称是。
②上图装置的正确连接顺序是(填字母,且每套装置限用一次)。
【实验反思】除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为(写出一个原因,并说明理由)。
【例4】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润________。
【Na2CO3质量分数测定】工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
装置A的作用是_____。
设计的实验步骤为:
①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹,_____;
⑤再次称量装置C。
计算碳酸钠含量至少需要测定______(填数字)个数据。
根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因。
【NaN3纯度测定】精确称量0.140gNaN3样品,设计如图装置,测定其纯度。
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(1)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(2)使小试管中的NaN3样品与M溶液接触的操作是______。
(3)使用冷水冷凝的目的是______。
反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(4)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A.100mLB.1LC.2L
(6)计算NaN3样品的纯度(写出计算过程)。
实验设计性探究
★实验探究题容易出现的考查题型有:
1、过程型探究:
即按照题中给出的探究过程填写完成相关内容的题型。
这种题型往往已经给出问题、猜想和实验过程,学生在解答中要理解好出题意图,填写实验现象和结论,并联系学习的知识和生活经验能对结论拓展应用。
这种题型比较易于解答。
2、结果目的型探究:
即按照题目后部分给出的实验步骤和结论,答出猜想和探究的目的。
这种题型解答起来较上一种稍难。
要求大家在阅读分析整个题目内容,填写后面的实验现象、结论等要求作答的相关内容后,理解好考查意图提出正确的猜想和探究目的。
3、方案判断型探究:
即按题目给出的问题和多种设计方案,判断并选择最优方案,并按要求作答相关问题。
要求学生较熟练地掌握化学反应的可能性和实验现象,在明确探究目的的基础上,选择切实可行、现象明显的实验方案。
4、问题型探究:
即按题目中给出的发现的问题和事实,提出猜想和假设,设计方案,制定实验步骤,预计现象,得出结论。
这种题型是学生解答过程中难度最大的一种。
要求学生对所学化学知识要熟练掌握、灵活运用,具有较强的分析解决问题能力和创新意识。
★准确解答实验探究题要注意:
1、认真审题,根据题目中设定的情境、提出的问题和具体要求,明确隐含的探究目的,进行猜想和假设。
2、明确要考查的知识点,设计选择理论正确、操作简单易行、现象明显、经济合理、对环境无污染的实验方案。
在对比性实验设计中要注意实验的公平性。
3、认真分析实验过程,熟练掌握重要物质的性质、运用全面系统的思维、准确填写实验现象和得出结论。
同时联系学习和生活中的实际,进行有益可行的拓展和迁移。
【例1】甲同学在某食品包装袋内,发现有一个装有白色颗粒状固体A的小纸袋,上面写“生
石灰干燥剂,请勿食用”。
甲同学随手将小纸袋拿出来放在空气中,经过一段时间后,发现
纸袋内的白色颗粒粘在一起成为块状固体B。
请你与甲同学一起对块状固体B进行探究。
(1)猜想一:
块状固体B中除氧化钙外还可能有:
、。
写出白色颗粒状固体A在空气中转化为块状固体B的化学反应方程式:
。
(2)猜想二:
块状固体B溶于水可能有现象(填“放热”或“吸热”)。
请设计实验方案验证你的这一猜想(至少写出两种方案,如果写出三种正确方案奖励1分):
①;
②;
③。
(3)猜想三:
取适量块状固体B加入盛有一定量水的试管中,振荡、静置、过滤,得到少量白色固体C。
就白色固体C的成分,甲同学与乙同学进行讨论,一起猜想。
甲同学认为,白色固体C可能是:
氢氧化钙;
乙同学认为,白色固体C可能是:
碳酸钙;
你认为,白色固体C还可能是:
请设计实验证明你的猜想(填写下表):
【例2】铁暴露在空气中会生锈。
不知你注意了没有,将苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。
某化学活动小组对此进行了探究。
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:
可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想②:
可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:
可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想④:
可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
猜想⑤:
可能是果肉中的物质与空气中的氧气作用而“生锈”,并且苹果“生锈”的速度还可能与温度有关。
【收集证据】
(一)查阅有关资料:
已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质。
(二)实验探究:
针对上面的猜想①至猜想⑤,化学活动小组依次设计了实验方案,进行了实验验证,并依次观察到下列实验现象。
请你将他们设计的可行的实验探究方案,填写在下表中。
【得出结论】
根据以上实验可得出:
【反思与评价】
(1)在②—⑤四种猜想中,你认为猜想填代号)最不合理,理由是。
(2)在验证猜想①时,同学们发现,如果水不与空气隔绝,果肉放在水中时间长了也会变色,其可能的原因是。
【实验推广与应用】根据上述结论,要防止果汁变质,果品加工厂加工和保存果汁时可采取的措施是。
【例3】学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,再想探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。
请你一起参与他们的探究过程,并填写下列空白。
(1)
【问题】Al2O3能不能作过氧化氢分解的催化剂呢
(2)
【猜想】Al2O3能作过氧化氢分解的催化剂。
(3)
【实验验证】
(4)
【结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂。
(5)
【讨论与反思】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
【实验目的】探究
【实验步骤】
①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,,称量;
④对比反应前后Al2O3的质量。
【讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
(6)但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:
探究。
【例4】
如图是市场充气包装的食品,它使用的是什么气体呢?
某兴趣小组对此进行了研究。
(1)经访问有关人员,了解到这样包装的目的是为了防止食品挤压变形或食品腐败,且从经济性、环保等因素考虑,工厂使用的包装气体是空气或空气的成分之一。
请你以此调查结果为依据,对包装气体的成分提出三种猜想,并说明你猜想的依据:
(2)请设计实验,检验上述三种猜想的正确性。
填写下列实验报告:
(3)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:
【例5】已知某合金粉末除铝外,还含有铁、铜中的一种或两种。
某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究。
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑(产物NaAlO2溶于水);
Fe、Cu不与氢氧化钠溶液反应。
【猜想】猜想1:
该合金粉末中除铝外,还含有铁。
猜想2:
该合金粉末中除铝外,还含有(填名称)。
猜想3:
该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验仅供选择的试剂:
10%盐酸、30%NaOH溶液。
实验方案
实现现象
结论
①取一定量的合金粉末,加过量的,充分反应后过滤,滤渣备用。
粉末部分溶解,并有气体放出。
合金中一定含有
②取步骤①所得滤渣,加入过量的,充分反应。
滤渣部分溶解,并有气体放出,溶液呈浅绿色。
【探究结论】猜想3成立。
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。
写出铝与稀盐酸反应的化学方程式。
【例6】某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
【提出问题】这种淡黄色粉末是什么?
有什么性质和用途?
【查阅资料】
①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;
在呼吸面具中和潜水艇里常用作供氧剂。
【猜想与探究】
猜想:
淡黄色粉末可能是:
a.硫;
b.过氧化钠;
c.硫和过氧化钠的混合物。
探究:
过氧化钠与水反应的生成物的成分。
【实验与结论】
【继续探究】小组的同学对过氧化钠能作为供氧剂也很感兴趣,大家讨论认为可能是CO2在常温下能与过氧化钠反应有关,于是设计下图所示的装置继续实验探究。
【交流与比较】与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是(从两个不同角度回答):
__________________、_________________。
【例7】某实验小组对实验室中A、B、C、D四瓶无色溶液进行鉴别,它们分别是硫酸钠、稀硫酸、澄清石灰水、四种物质的一种。
可供使用的实验用品有:
稀盐酸、稀硫酸、碳酸钠、紫色石蕊溶液、硝酸钡溶液、硝酸银溶液、稀硝酸溶液、玻璃棒、试管、胶头滴管。
请利用提供的实验用品,鉴别出四种物质,并完成实验报告:
【发现问题】做完实验②后,该小组在网上查阅资料的时候发现,用稀硝酸酸化的硝酸钡溶液进行检验SO42-时,亚硫酸根离子(SO32-)的存在干扰了SO42-的检验。
如往亚硫酸钠(Na2SO3)溶液滴加硝酸钡溶液后有沉淀生成,再加足量的稀硝酸酸依然有白色沉淀。
【提出问题】若某无色溶液中可能含有硫酸根离子(SO42-)与亚硫酸根离子(SO32-)中的一种或两种,该如何检验?
【查阅资料】亚硫酸钡(Ba2SO3)是无色晶体或白色粉末,微溶于水,在水中是白色沉淀。
中性或碱性条件下NO3-不能和SO32-反应,但在酸性条件下,NO3-能和H+反应相遇时(HNO3)具有强氧化性,易把SO32-氧化生成SO42-。
往亚硫酸钡中加入盐酸能发生类似于碳酸钡与盐酸的反应,生成有刺激性的气体。
【猜想】该无色溶液中含有
(1)SO42-
(2)SO32-(3)。
【实验探究】请你将下列实验填写完整。
写出亚硫酸钠溶液与硝酸钡溶液发生复分解反应的化学方程式:
。
【得出结论】要鉴别一种离子的存在,必须排除其它离子的干扰,不然会得出错误的结论。
基础演练
能力拔尖
【演练1】“用双氧水和二氧化锰制氧气”的反应方程式为:
某同学做了该实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:
每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:
(其
他实验条件均相同)
请分析表中数据回答:
MnO2的用量对反应速率有没有影响呢?
如果有,是怎样影响的呢?
答:
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:
每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。
记录数据如下:
(实验均在20℃室温下进行,其他实验条件也均相同)
H2O2溶液的溶质质量分数对反应速率有没有影响呢?
由表中数据还可看出,该反应是个反应(填“放热”或“吸热”)。
(3)还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
【答案】
【演练2】化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应。
那么,铜与浓硫酸能否发生反应呢?
[猜想与假设]
猜想①在常温下能反应;
猜想②在常温下不能反应,但在加热条件下能反应;
猜想③在加热条件下不能反应。
[实验与事实]
操作①将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
操作②加热该试管,铜片上有气泡产生,并闻到刺激性气味;
操作③检验产生的有刺激性气味的气体(检验方法及现象略);
操作④立即停止加热;
操作⑤将试管中的残液慢慢倒入少量水中,溶液呈蓝色。
[结论与解释]
(1)由以上探究可知:
猜想______是正确的;
(2)经检验产生的气体是;
立即停止加热是为了避免产生更多
的;
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4。
[反思与评价]
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)_________将水倒入剩余的液体里。
(2)探究结论中对产物是SO2和CuSO4的判断是否正确__________,理由是________________。
[拓展与应用]
根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案。
甲方案:
利用废铜屑跟浓硫酸在加热条件下反应制取。
乙方案:
在加热条件下将废铜屑在空气中氧化成CuO,再将CuO与稀硫酸反应制取。
请你从安全、节约、环保等方面进行评价,较好的方案是_____,理由是(答出一点即可)_______________。
【演练3】某工地的仓库里有三包标签已磨损的白色粉末,分别是生石灰、熟石灰和碳酸钙粉末。
请你设计一个简便的方法进行鉴别,并完成该实验报告。
【演练4】小新拿来一片黄色的金属向同学们炫耀说他捡到了黄金。
小宝说他曾在网上看到过,有一种铜锌合金外观与黄金相似,常被误认为是黄金。
于是他与小新开始探究。
【提出问题】这块黄色的金属是黄金?
还是铜锌合金?
【提出猜想】①小新认为是黄金②小宝认为是铜锌合金
【查阅资料】合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】
①小新设计的实验是:
截取一小片黄色的金属放在石棉网上用酒精灯加热;
②小宝设计的实验是:
截取一小片黄色的金属放入硝酸银溶液中。
【现象与结论】
①小新在实验中观察到黄色的金属变黑,则他的猜想对吗?
;
黑色物质是
②小宝在实验中能观察到的现象
写出反应的化学方程式;
【反思与应用】
①假如你的观点和小宝的观点相同,你还可以设计一个实验是:
截取一小片黄色的金属放入溶液中,
②你设计的实验中观察到的现象是
【演练5】小明家住在山青水秀的月牙山脚下,几年前,村里为了发展经济,在村边建起一座氮肥厂。
近段时间,小明发现村里的井水,在烧水或用碱性洗衣粉洗衣服时,总闻到水里散发出一股与氮肥厂附近相似的刺激性气味。
【作出猜想】联想到所学的化学知识,小明猜想可能是氮肥厂排出的废水污染了井水。
他猜想的依据是。
【表达交流】请你根据上述信息帮助小明归纳污染物的化学性质:
(1);
(2)。
【设计实验】为了验证猜想,小明设计了如下实验方案:
(1)从氮肥厂取来氮肥作为样品。
(2)取适量样品放入玻璃杯中,加入井水充分溶解。
将所得溶液分为2份。
(3)一份加入碱性洗衣粉,搅拌后闻气味;
另一份加热后闻气味。
【反思评价】小明的实验方案存在着问题,你认为应怎样改进?
。
【获得结论】小明通过改进后的实验,确认是氮肥厂排出的废水污染了井水。
【探究启示】目前该村村民还需饮用井水,请你提出一条简便的处理方法:
【演练6】已知某合金粉末除铝外,还含有铁、铜中的一种或两种。
【猜想】
猜想1:
【演练7】某同学在实验结束进行废液处理时,将碳酸钠溶液、稀盐酸倒入到指定的洁净容器中,看到有气泡产生,待不再产生气泡时,又倒入了氢氧化钙溶液,发现该容器中有白色沉淀产生,这一现象引起了他的注意。
为了解以上三种物质之间的反应情况,他决定从反应后溶液中的溶质组成入手进行探究。
(1)他对反应后溶液中的溶质组成作出了两种猜想(猜想①和猜想②)。
请你再补充一种猜想(猜想③)。
猜想①:
溶质为氯化钠、氢氧化钠;
猜想②:
溶质为氯化钠、氢氧化钠、氢氧化钙;
猜想