化工流程题归纳Word格式文档下载.docx
《化工流程题归纳Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化工流程题归纳Word格式文档下载.docx(18页珍藏版)》请在冰点文库上搜索。
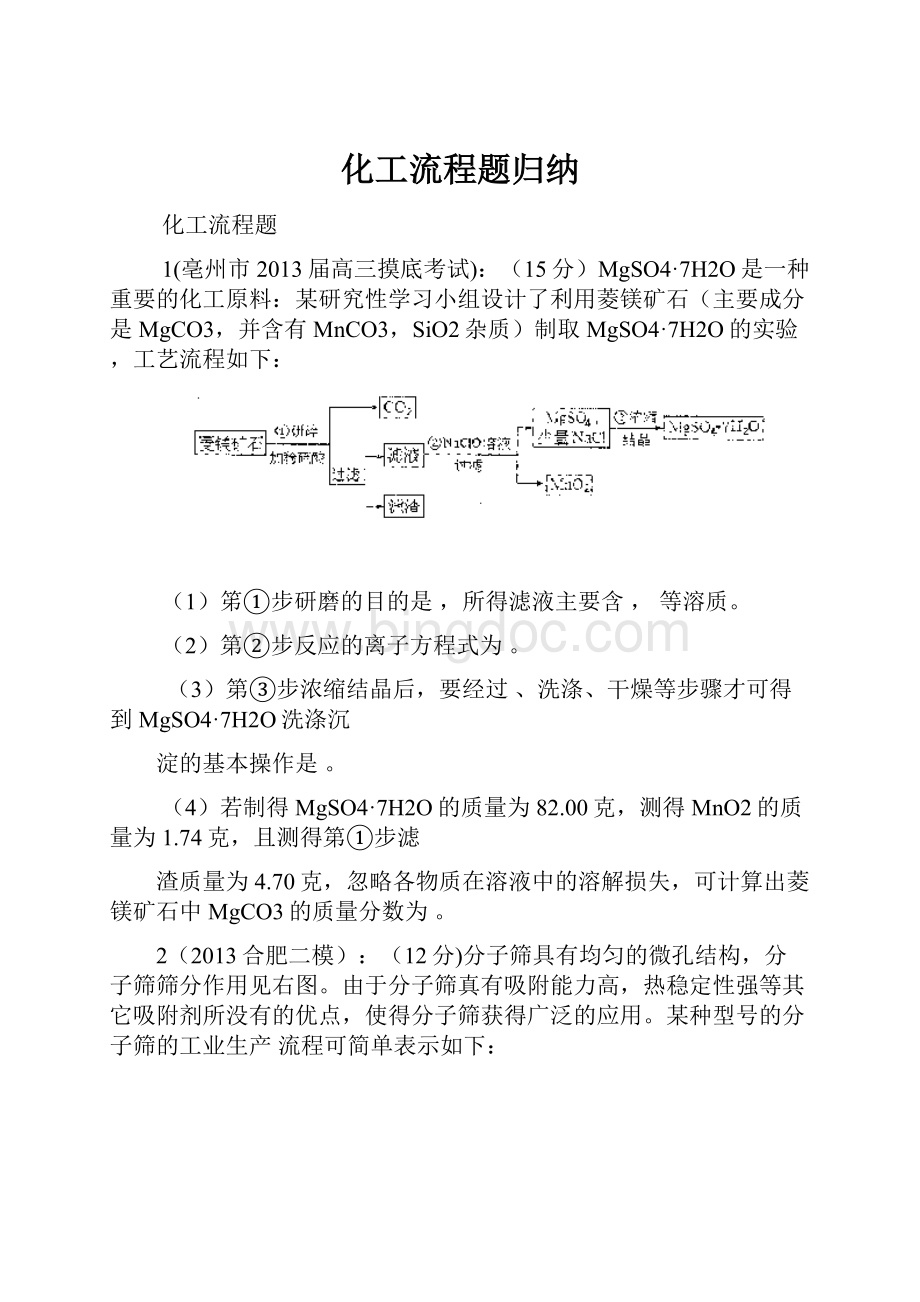
H2O调节pH后,加热到900C并趁热过滤的原因可能是______________
(5)该生产流程中所得分子筛的化学式为_______________
3(2013合肥三模):
(14分)利用酸解法制钛白粉产生的废液[含有大量FeS04、H2S04和少量Fe2(S04)3、TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。
其生产步骤如下:
请回答:
(1)步骤①中分离操作的名称是_______;
步骤⑥必须控制一定的真空度,原因是_______
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2•xH20)的化学方程式为_______;
步骤④的离子方程式为______________________
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:
_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMn04溶液滴定(杂质与KMn04不反应)。
若消耗0.1000mol·
L-1KMn04溶液20.00mL,则所得晶体中FeS04•7H2O的质量分数为(以含a的式子表示)______________。
4(2013黄山二模):
(14分)资料显示,在一定条件下磺胺铁钒在Ph=0.5~2.5范围内均能稳定存在,工业上用酸浸法制取硫酸铜的流程示意图如下
根据题意完成下列问题
(1)步骤(ⅱ)所加试剂起调节pH作用的离子是(填离子符号)
(2)在步骤(ⅲ)发生的反应中,加入少量的MnO2的作用是。
(3)步骤(ⅳ)出去杂质的离子方程式可表示为。
(4)实验室模拟酸式碳酸铜【Cu2(OH)2CO3】的制备,向大试管中加入碳酸钠溶液和硫酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、用热水洗涤、烘干,得到碱式碳酸铜产品。
根据上述碱式碳酸铜的制备方法,请完成下列问题:
①过滤后洗涤的目的是什么;
简述如何洗涤沉淀。
②若实验得到ag样品(只含CuO杂质)取此样品加热至分解完全后,得到bg固体,此样品中碱式碳酸铜的分数是。
5(2013届芜湖一中三模):
(15分)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·
6H2O]俗称“摩尔盐”,是分析化学中的重要试剂。
(1)查阅文献:
硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,则气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成分,设计如下实验装置。
隔绝空气加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,再通入氮气,目的是 。
②装置B的作用是为了检验分解产物中是否有 气体生成;
实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为 。
③甲同学设计实验验证A中残留物是否含有FeO,请帮他完成下表中内容。
限选试剂:
KSCN溶液、浓盐酸、稀硫酸、KMnO4溶液、稀硝酸、蒸馏水。
仪器和用品自选。
实验步骤
预期现象和结论
④乙同学认为只需精确称量加热前后固体的质量即可确定残留固体的成分,你是否同意乙同学的看法,并简述理由:
6(2013届芜湖一中一模):
(15分)
草酸亚铁晶体(FeC2O4·
2H2O)呈淡黄色。
某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4。
溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。
这说明草酸亚铁晶体具有(填“氧化性”、“还原性”或“碱性”)。
若反应中消耗1molFeC2O4·
2H2O,则参加反应的KMnO4为mol。
(2)资料表明:
在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧
化物,残留物为黑色固体。
课题组根据课本上所介绍的铁的氧化物的性质,对黑色
固体的组成提出如下假设,请你完成假设二和假设三:
假设一:
全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
【定量研究】课题组在文献中查阅到,FeC2O4·
2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·
2H2O晶体受热分解的化学方程式为:
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。
某同学由此得出结论:
假设一不成立。
你是否同意该同学的结论,并简述理由:
7(2013年安庆市示范中学联考):
(12分)过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。
査阅文献:
过氧化钙的制备方法一般有两种方案。
利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·
8H2O沉淀。
已知CaO2·
8H2O呈白色,微溶于发水,在60℃下烘0.5小时可形成CaO2·
2H2O,再在140℃下烘0.5小时,得无水CaO2。
加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下:
某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·
8H2O的化学方程式是:
。
(2)检验“水洗”是否合格的方法是:
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·
8H2O产率;
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:
准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:
向上述锥形瓶中加入几滴淀粉溶液。
第三步:
逐滴加入浓度为cmol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:
I2+2S2O32—=2I—+S4O62—】
①上述第三步滴定至终点,现象为。
②CaO2的质量分数为(用字母表示)
8(2013年马鞍山市三模):
(14分)钒的用途十分广泛,有金属“维生素”之称。
某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是
(写化学式)。
NH4VO3在焙烧前要洗涤2-3次,该步操作方法为。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)
2RAn(有机层)+nH2SO4
(水层)
步骤②中萃取时必须加入适量碱,其原因是
。
步骤③中X试剂为
。
(3)⑤的离子方程式为。
(4)该工艺流程中,可以循环利用的物质有
和
(5)若取VOSO4样品wg,测得消耗amol·
L—1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是g(用含w、V的代数式表示)。
9(2013年马鞍山市一模):
(14分)绿矾(FeSO4·
7H2O)可用于色谱分析剂、净水、照相制版等方面。
下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
已知:
在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;
FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是_________________________。
(3)操作Ⅲ中需要的玻璃仪器是烧杯、。
(4)通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______________________________________。
(5)操作Ⅳ的顺序依次为:
______________、冷却结晶、________________。
(6)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②____________________。
10(池州一中2013届高三年级第一次月考)(14分)
重铬酸钠晶体(Na2Cr2O7·
2H2O)是重要的化工产品和强氧化剂,俗称红矾钠。
工业制备的流程如下:
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·
SiO2,则
Fe(CrO2)2可写成。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
为了加快该反应的反应速率,可采取的措施是。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
①往混合溶液甲中加入硫酸必须适量的原因是。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。
工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。
通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。
a电极的电极反应式是__,
b电极附近反应的离子方程式是__。
11(皖南八校2013届二模):
(16分)明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重要原料,其步骤如下:
回答下列问题:
(1)明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2)沉淀物A中除含有Fe2Q3外,还含有________、________。
(3)操作①的名称为________、冷却结晶、过滤。
(4)用14mol.L-1的浓氨水配制480mL2mol.L1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?
________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:
________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中:
(5)确定钾氮复合肥中含有钾元素的方法是。
(6)为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL。
则钾氮复合肥中氮元索的质量分数为________(用含m、V的代数式表示)。
12(皖南八校2013届三模):
(15分)氨的催化氧化是氨重要的化学性质。
其实验设计也是大家探究的主要内容。
①演示实验“氨的催化氧化”装置甲一般如右图:
②改进实验装置乙如下:
(l)写出氨催化氧化反应的化学方程式。
(2)演示实验中,学生看到锥形瓶中的现象是瓶口附近有红棕色气体生成,且。
实验过程中,学生还常常会看到锥形瓶中有白色烟雾,除水外,
形成此烟雾的物质可能是硝酸和(填化学式)。
(3)改进后的实验与演示实验装置甲相比,除
了改变了催化剂和装置仪器外,还增加了两部
分具有新功能的实验装置,其中C装置中常用
干燥剂为,另一部分新功能设计的
装置是E和F,其作用是。
(4)工业上用氨气与空气(氯气氧气体积比为
5:
1)混合,通过“氨的催化氧化”等反应工
业合成硝酸,合成硝酸流程如图所示,其中甲、
乙、丙是工业设备。
其中发生氨催化氧化的设
备是,甲装置的作用是。
上方管
道中的气体与下方管道中的气体成分是否相同,如相同,写出主要气体成分;
如不同,分别写出主要气体成分。
(5)物质循环利用是工业生产提高综合效率的主要手段,请在图中用笔框出物质循环利用的部分。
(6)上述工业生产中理论上1mol氨气全部转化为硝酸需要空气mol。
实际工业生产中常要通入过量空气,以提高氨气的转化率等。
你
化工流程题答案及解析
1:
(1)使溶解充分并加快溶解速率,(2分)MgSO4,MnSO4(2分)
(2)Mn2++ClO-+H2O=MnO2↓+Cl-+2H+(3分)
(3)过滤(1分)将沉淀置于过滤器中,加蒸馏水(1分)至刚好浸没沉淀(1分),待水流尽,重复2-3次(1分)(共3分)你
(4)80%(4分)
2:
(1)5A
(2)2Al3++3SiO32-+6H2O=2Al(OH)3+3H2SiO3
(3)Na+NH4+SO42-将铂丝或铁丝放在酒精的外烟上灼烧至无色时,蘸取待测溶液再放在酒精灯外烟上灼烧,若火烟呈黄色,则说明待测液中有Na+
(4)加热能促进胶体凝聚,趁热过滤可防止其他杂质晶体析出
3:
(27题)
4:
6:
7
(1)CaCl2+H2O2+2NH3+8H2O=CaO2·
8H2O↓+2NH4Cl(3分)
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。
(2分)
(3)②温度低可减少过氧化氢的分解,提高过氧化氢的利用率。
(2分)
(4)①最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色(2分)
②
(3分)
8
(1)SiO2(1分);
在漏斗中加水至浸没沉淀,待水流尽后重复操作(2分)
(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率(或类似表述,如提高RAn(有机层)的浓度、百分含量等)(2分);
H2SO4(1分)
(3)NH3·
H2O+VO3-=NH4VO3↓+OH-(3分)
(5)氨气(或氨水)、有机萃取剂(2分);
(6)546av/w克(3分)
9
(1)测定溶液pH的操作是:
将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是:
使Sn2+完全沉淀,而Fe2+不沉淀;
(3)操作Ⅲ中需要的玻璃仪器是:
烧杯、玻璃棒、漏斗。
②防止Fe2+被氧化。
(5)操作Ⅳ的顺序依次为:
蒸发浓缩、冷却结晶、过滤。
(各2分)
(6)操作Ⅳ绿矾晶体用少量冰水洗涤目的是:
②减
少绿矾晶体洗涤中的损耗。
10
(1)+2(2分)
(2)FeO·
Cr2O3(2分)(3)粉碎矿石,升高温度。
(4)①少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。
②Na2Cr2O7和Na2SO4(2分)
(5)2H++2e-=H2↑(2分),Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O(2分)
11:
(26题)
12
(1)4NH3+5O2
4NO+6H2O(2分)
(2)铂丝继续保持红热;
(1分)NH4NO3(1分)
(3)无水CaCl2(1分)检验酸性物质生成;
吸收氮氧化物,防止污染环境。
(4)乙(1分)预热氨和空气混合物;
冷却氮氧化物;
相同,氮氧化物(1分)
(5)见右图(2分)
(6)12(2分)