全国普通高等学校统一招生考试上海卷化学考纲知识点分析Word文档格式.doc
《全国普通高等学校统一招生考试上海卷化学考纲知识点分析Word文档格式.doc》由会员分享,可在线阅读,更多相关《全国普通高等学校统一招生考试上海卷化学考纲知识点分析Word文档格式.doc(63页珍藏版)》请在冰点文库上搜索。
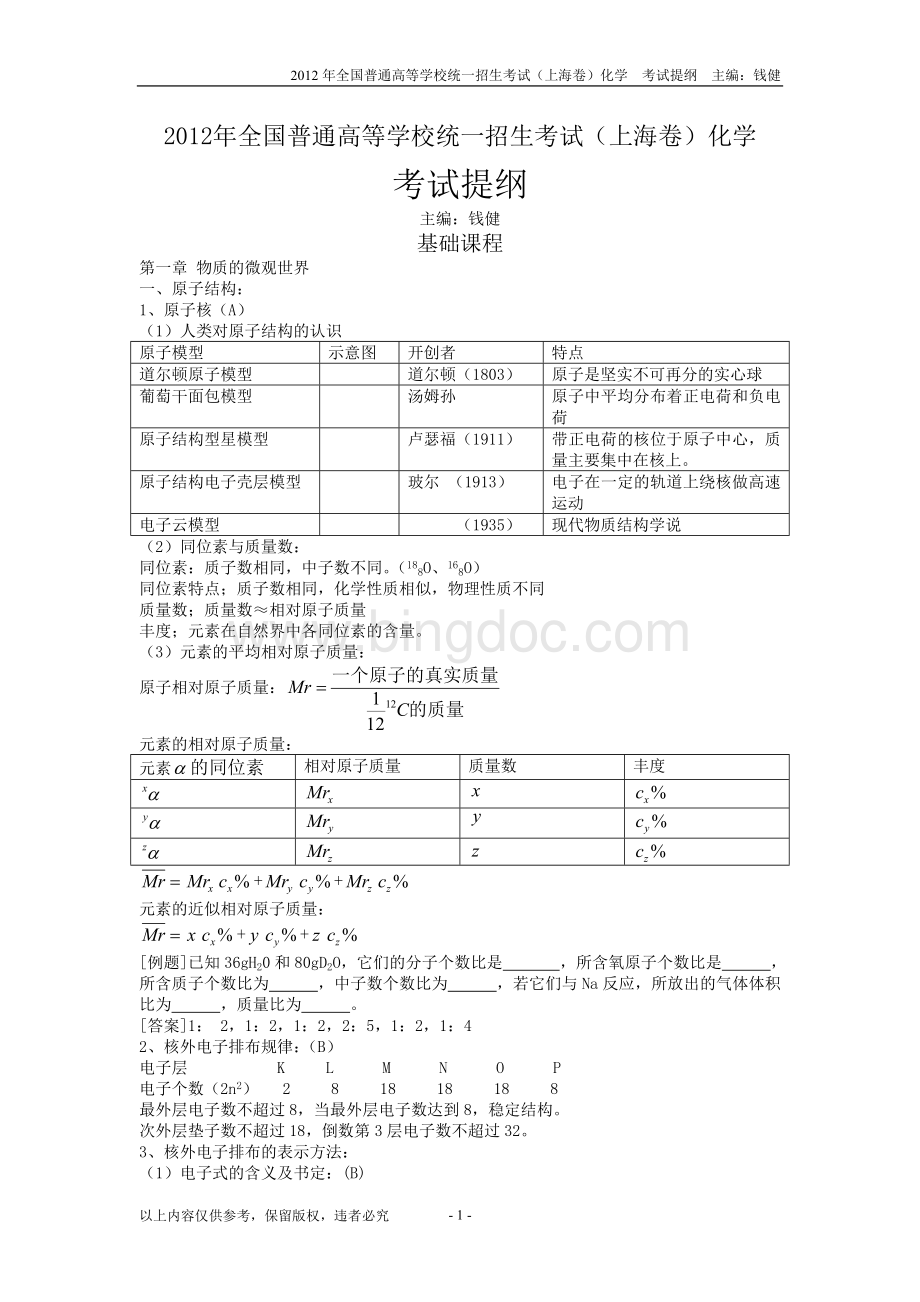
(1)电子式的含义及书定:
(B)
我们用小黑点表示元素的最外层上的电子。
[例如]氢H
氧O
钠Na.
(2)原子结构示意图的含义及书写(1~18号元素):
含义;
原子结构示意图表示原子的核外电子排布.
元素符号
H
He
Li
Be
B
C
N
O
F
原子结构示意图
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
二、原子结构;
1、离子;
(1)简单离子、氢氧根离子和铵根离子的电子式。
写出下列电子式:
简单离子
氢氧根离子:
[OH]-
H
铵根离子;
[HNH]+
(2)1~18号元素离子结构示意图的书写:
离子结构示意图
/
无
三、化学键;
1、离子键:
(1)概念:
阴阳离子间相互作用达到平衡
(2)存在离子键的条件及代表物质;
条件:
阴阳离子
①满足第一、二主族的金属元素与第六、七主族的非金属元素。
[例如]NaCl、CaCl2等
②金属阳离子与氢氧根离子
[例如]NaOHMg(OH)2等
③对于某些活泼金属与氢气反应所生成的固态氢化物
[例如]NaH
(3)用电子式表示离子键化合物;
[例如]NaCl的电子式是
CaCl2的电子式是
[例如]NaOH的电子式是
Mg(OH)2的电子式是
[例如]NaH的电子式是Na+[:
H]-
2、共价键;
原子间通过功用电子对形成的化学键
电子的重叠
①存在与非金属元素之间
②成键微粒为原子,且两原子间的电子自旋方向相反
[例如]H2O、HCl、N2、CO2、H2等
[例如]H2O的电子式是
HCl的电子式是
CO2的电子式是(含极性共价键非极性分子)
N2的电子式是(非极性共价键)
H2的电子式是(非极性共价键)
3、金属键;
(A)
金属阳离子与自由移动的电子的作用力。
金属通性;
导电性、导热性、金属光泽
(2)存在离子键的代表物质;
[例如]Na、Mg、Al、Cu等金属
第二章物质变化及其规律;
一、能的转化:
1、溶解过程及其能量变化;
(1)溶解平衡、结晶过程;
[例如]
溶质微粒;
离子、分子.
溶解过程中的能量平衡特征;
①等溶解速度=结晶速度
②动外形由不规则到规则。
③定达到平衡时,温度一定,饱和溶液C%一定。
④变外界条件发生改变,平衡变化
结晶过程;
(2)溶解过程中能的变化;
溶解时的热效应;
取决于水合,扩散过程能量相对大小.
降温[例如],
无明显变化[例如]
升温[例如],
2、化学反应中能的转化;
(1)反应热效应;
含义;
反应热效应是反应时所放出或吸收的热量
(2)放热反应和吸热反应(中和反应的放热反应);
放热()内能角度;
键能角度;
[例如]化合反应
吸热()内能角度;
[例如]分解反应
中和反应的放热反应
注意;
大部分化合反应和水解反应都是放热反应。
[特例]
、
(3)热化学方程式的意义和书写;
意义;
热化学方程式表明一个反应中的反应物和生成物,还表明一定量的物质在某种状态下所放出或吸收的热量。
此热化学方程式的意义;
1mol固体碳与1mol气体水生成气体一氧化碳,吸收131千焦热量。
书写热化学方程式;
写出反应无,生成物,以及对应系数和其状态(固态、液态、气态),整个反应所放出或吸收的总热量,(热量与反应无的系数对应)
[例题]已知
问;
1m3甲烷(1000L)在此状态下,燃烧所放出的热量。
(4)燃料的充分利用;
①燃料的充分燃烧(足量空气)
②热能的充分利用
如裹空气过多,会带走一部分热量,造成热量的损失.
二、化学反应速度与化学平衡;
1、化学反应速度;
,(是物质的量的浓度的变化)
单位;
mol/(L.s)
①表示一段时间内的平均速度,非瞬间速度。
②对于一个化学反应;
2、影响化学反应速率的因素;
(1)浓度、温度、压强、催化剂对化学反应速率的影响;
外界条件
化学反应速率
浓度
增大
减小
温度(显性因素)
压强
表面积
催化剂(主要因素)
催化剂注意事项;
①催化剂可以加快反应速度,减少时间
②催化剂可以使原不反应的化学反应反应。
③催化剂不改变平衡移动。
④不同的反应选用不同的催化剂,相同的反应选用不同的催化剂发生不同的反应
⑤催化剂有一定的活化温度
⑥催化剂会形成中间产物,从而改变反应途径
⑦催化剂中毒,在有杂质是使催化剂失效,因此,在反应前净化原料。
3、可逆反应、化学平衡状态;
定义;
当一个化学反应发生后,它的生成物在同一条件下又重新生成原来的反应物,这种化学反应称为可逆反应。
在同一条件下,高产量,高产率。
化学平衡状态;
①逆可逆反应
②等
③运动动态平衡
④定反应物和生成物各自的不变.
⑤变外界条件改变,平衡变化.
判断化学平衡方法;
已知
混合物体系中
各成分的含量
各物质的物质的量或各物质的物质的量分数一定
√
各物质的质量或各物质的质量分数一定
各气体的体积或体积分数一定
各物质的物质的量或各物质的物质的量分数相等
×
各物质的质量或各物质的质量分数相等
各气体的体积或体积分数相等
总物质的量/总体积/总压强一定
正、逆反应速率关系
在单位时间内消耗了mmolA,同时生成mmolA
在单位时间内消耗了nmolB,同时消耗pmolC
(v为反应速率)
在单位时间内生成了nmolB,同时消耗qmolD
时,总压力一定(其他条件一定)
混合气体的平均分子量()
时,一定
温度
任何化学反应都伴随着能量变化,总体系温度一定(其他不变)
密度
时,密度一定
恒容时,密度一定
其他
体系的颜色不再发生变化
4、影响化学平衡移动的因素;
(1)浓度、压强、温度对化学平衡的影响;
只改变物质的量的浓度;
(图像辨别;
有接点)
改变条件
增大反应物物质的量的浓度
增大生成物物质的量的浓度
减小反应物物质的量的浓度
减小生成物物质的量的浓度
平衡移动原因
正向移动
逆向移动
图像
只改变压强(反应物生成物中有气体,)
加压
减压
条件
只改变温度;
升温
降温
吸热反应
放热反应
5、勒夏特列原理;
(1)用勒夏特列原理解释浓度、压强、温度对化学平衡的影响;
如果改变可逆反应的条件(浓度、压强、温度),化学平衡被破坏,并向减弱这种变化的方向移动,这个原理称为勒夏特列原理。
6、化学平衡的应用;
(1)工业生产上(合成氨、制硫酸)反应条件上的选择。
A、合成氨;
化学方程式;
在常温常压下,合成氨的反应进行得非常慢,几乎不能察觉,达到平衡后,氨得含量还是很低,只有在催化剂的条件下,才有较大得反应速率。
合成氨对催化剂的要求是;
活性大,坚固不易破碎,不易中毒和老化,容易制作,价格低廉。
高温;
加快反应速率,反应向逆方向进行。
高压;
加快反应速率,反应向正方向进行。
催化剂(铁触媒);
加快反应速率,
选用500度高温合成氨是因为;
500度是催化剂的最佳活性温度。
B、工业制硫酸;
方法一;
以硫磺为原料;
缺点;
对大气污染严重,
方法二、以硫铁矿为原料;
为了使反应进行得迅速,要把矿石粉碎成很小的粉末,然后进入沸腾炉燃烧。
净化处理原料气,防止催化剂失效。
常压;
常压下转化率已经较大。
催化剂;
(2)有关“化学平衡与生活”的一些常见例子;
酸碱指示剂;
石蕊;
酒精测定仪中的化学平衡;
交警通常使用酒精测定仪确定司机是否违章酒后驾车。
血液输氧;
一氧化碳中毒;
人体血液中碳酸存在平衡
三、元素周期表;
1、元素周期律;
(1)同主族元素性质递变规律;
同主族元素,原子序数增大
原子半径依次增大,
离子半径依次增大,
元素金属性(还原性)增强,非金属性(氧化性)减弱。
氧化物对应的水化物碱性增强,酸性减弱。
氢化物稳定性减弱。
同主族元素,最外层电子数相同,最高化合价相同
(2)短周期中同周期元素性质递变规律;
同周期元素,原子序数增大
原子半径依次减小,
元素金属性(还原性)减弱,非金属性(氧化性)增强。
氧化物对应的水化物碱性减弱,酸性增强。
氢化物稳定性增强。
同周期元素,电子层数相同。
语句辨析;
碱性氧化物都是金属氧化物。
√
金属氧化物都是碱性氧化物。
×
[例如]是两性氧化物
酸性氧化物都是非金属氧化物×
[例如]
非金属氧化物都是酸性氧化物×
2、元素周期表;
(C)
发明家;
俄国门捷列夫.
(1)元素周期表的结构;
IA
1
IIA
IIIA
IVA
VA
VIA
VIIA
2
3
IIIB
IVB
VB
VIB
VIIB
VIII
IB
IIB
5
6
7
单个事例;
1H
氢
2n2
1.008
(2)元素周期表与原子结构的关系;
在同一周期中,各元素的原子核外的电子层虽然相同,但随着核电荷数的增多,从左到右原子半径依次减小,失电子能力减弱,得电子能力加强,元素的金属性减弱,非金属性加强。
同一主族的元素,随着核电荷数的递增,从上到下,电子层数递增,原子半径增大,失去电子能力增强,得电子能力逐渐减弱,元素金属性增强,非金属性减弱。
元素周期表;
右上角热稳定性最强,氧化性最强,
左下角还原性最强。
(3)元素周期表的应用;
人们通过元素性质的周期性变化,推测元素及其单质,化合物的性质.
由于周期表中位置相近的元素性质相似,人们在金属和非金属的分界线附近寻找半导体,在B族和VIII族中寻找催化剂,以及耐高温,耐腐蚀的合金材料。
农业;
位于周期表右上角的S、Cl、P。
安全高效农药。
高考考察;
根据元素在周期表中的位置,推测它的性质。
四、电解质溶液;
1、电解质、非电解质、强电解质、弱电解质;
㈠电解质;
在水溶液或熔融状态下导电的化合物。
[例如]酸、碱、盐、金属氧化物
㈡非电解质;
在水溶液和熔融状态下不导电的化合物。
[例如]、、、
电解质和非电解质的异同;
共同点;
均是化合物,单质与混合物无电解,所以单质与混合物没有电解质和非电解质之分。
差别;
①电解质本身不导电。
导电的物质不一定是非电解质。
[例如]NaCl晶体不导电在水溶液和熔融状态下导电。
HCl熔融状态下不导电,而在水溶液条件下导电。
金属单质导电,而金属不是电解质。
②非电解质不导电,不导电的物质是非电解质。
③、、、是非电解质。
㈢强电解质;
①强酸;
、、、、、等。
②强碱;
、、、等。
③盐;
、、等。
④金属氧化物;
、等。
㈣弱电解质;
①弱酸;
、、、、、、、、
②弱碱;
、、等。
③
判断依据;
在水溶液或熔融状态下导电;
电解质/非电解质。
电离是否完全;
强电解质/弱电解质。
物质结构;
离子化合物;
在水溶液和熔融状态下均导电。
共价化合物;
在水溶液中导电,部分在熔融状态下导电。
2、电离、电离方程式、电离平衡;
(1)碳酸的分步电离;
一级电离;
二级电离;
电离方程式;
强电解质电离;
(完全)
[例如]
弱电解质电离;
(不完全,用可逆符号表示)
电离平衡;
一定条件下,弱电解质分子电离成离子速率等于离子结合成分子速率。
特征;
①等②动③定④变
3、水的电离、pH;
(1)水是极弱的电解质;
水的电离平衡;
水的离子积常数;
室温时,
①只与温度有关,温度越高,越大。
②溶液呈中性,pH值不一定等于7;
pH=7,溶液不一定呈中性。
向纯水中加入酸或碱会抑制水的电离。
(2)pH值的含义;
(3)pH与酸碱性之间的关系;
溶液中、与酸碱性的关系;
①碱性pH>
7(250C)
②中性pH=7(250C)
③酸性pH<
当溶液中或大于1mol/L时,一般不用pH值表示溶液酸碱性。
4、常见酸碱指示剂;
(1)酚酞、石蕊、甲基橙;
酚酞;
8(无色)~10(红色)
5(红色)~8(蓝色)
甲基橙;
3.1(红色)~4.4(黄色)
5、离子方程式;
(1)置换反应和复分解反应的离子方程式;
书写规律;
①写先写化学方程式。
②拆把反应物、生成物中可溶性强电解质的物质写成离子。
必须写化学式;
单质、氧化物、非电解质、弱电解质、沉淀、气体。
弱酸根离子不能拆、(除外)
③删把反应先后都有的离子删去。
④查检查原子守恒、电荷守恒。
置换反应;
复分解反应条件;
①生成难溶物。
②生成难电离物质(弱电解质)。
③生成易挥发物质。
定量离子方程式;
关键字;
定量,少量、过量、等物质的量、任意量。
①与反应用量有关;
(a)过量反应物与生成物继续反应;
[例如]少量时,生成
过量时,生成
(b)酸式盐与量有关的反应;
②与反应条件有关
[例如]铵盐与强碱反应;
常温下;
加热;
③两种试剂的滴加顺序不同,导致反应的现象和产物可能不同。
向溶液中滴加少量的溶液;
④易被忽视的隐含条件;
(a)和过量容颜反应(不可忽略比难溶)
(b)明矾[]与足量的溶液反应(不可忽视的两性)
(c)少量通入漂白粉溶液中。
6、盐类水解、水解的应用;
(1)常见强酸弱碱盐和强碱弱酸盐的酸碱性
盐的离子与溶液中水电离出的产生弱电解质的反应。
结论;
有弱才水解,无弱不水解,都弱双水解,越弱越水解,谁强显谁性。
水解离子;
阳离子;
、、、、
阴离子;
、、、、、、、
不是能发生水解的盐相遇一定发生双水解反应。
(a)与相遇,由于生成溶解度小于其水解产物,所以,发生复分解反应;
(b)与相遇,发生氧化还原反应而不能大量存在;
盐类水解离子方程式;
特殊;
影响水解的因素;
①温度
②稀释促进电离。
③溶液酸碱性会影响水解平衡;
注意;
电离>
水解酸性
电离<
水解碱性
(2)水解的应用;
①利用盐类水解来制胶体或净水。
{例如}胶体的制取和胶体来净水,通常利用在沸水中滴加溶液制取胶体,用明矾净水。
②配置某些盐溶液时要注意加水解抑制剂。
{例如}(a)实验室配置溶液时要向溶液中滴加稀HCl。
(b)配置溶液时要向溶液中滴加
③制取某些无机盐的无水物时,要考虑水解作用。
{例如}(a)溶液蒸发结晶时得不到无水。
(b)只能用干法制取,不能在溶液中得到。
④由于盐类的双水解作用,要合理使用化肥。
[例如]长期使用铵态氮肥的土壤酸性会增强(板结),铵态氮肥不能与强碱弱酸盐混合使用。
⑤生活、生产中的盐类水解;
(a)泡沫灭火器中的原理;
泡沫灭火器中和发生双水解反应;
(b)热碱液洗涤油污效果好。
(c)炸油条时向面粉中加入适量明矾和小苏打
(d)溶液止血。
⑥溶液的酸碱性及其存放要注意盐类水解。
[例如]溶液是碱性,不能用玻璃塞。
⑦利用盐溶液碱性和酸性的强弱,判断盐对应的碱和酸的相对强弱。
(a)取决于组成盐的弱酸根离子或弱碱阳离子所对应的酸的酸性或碱的碱性,酸性和碱性的越弱,则滩越易水解,同浓度的盐溶液的酸性或碱性就越强。
(b)对于弱酸的酸式盐,在溶液中同时存在着水解平衡和电离平衡,溶液中的酸碱性取决于酸式弱酸根离子电离和水解程度的相对大小,若电离程度<
水解程度,则碱性;
电离程度>
水解程度,则酸性。
[例如]由于电离程度<
水解程度,所以溶液呈碱性。
⑧比较溶液中离子浓度大小,除考虑电解质的强弱,电荷的守恒,物料的守恒外,还要考虑盐类水解。
一般根据盐的电离和水解程度确定,对于发生化学反应后的溶液中,先由浓度,体积来确定反应物的物质的量,再根据化学方程式,电离方程式和电离能力(电离度)确定微粒的物质的量,注意水解,生成弱电解质反应等隐含因素对微粒的量的影响。
⑨判断溶液中离子共存问题。
离子共存问题;
酸溶液中不存在;
、、、、、、
碱溶液中不存在;
其它常见情况;
与生成络合离子
与与或者与/与
情况下;
,抑制水的电离,按照酸溶液或碱溶液讨论。
⑩物质之间的鉴别,离子的分离,判断产物的成分。
补充;
电解质溶液守恒规律;
电荷守恒;
元素守恒/物料守恒;
质子守恒;
[例如]守恒关系;
电解质溶液电离呈电中性,即溶液中阳离子所带电荷总数与阴离子所带电荷总数相等。
[例如]溶液中,阳离子;
和;
阴离子:
、、。
(考虑水的电离)
元素守恒;
电解质溶液中某些特征原子的总量不便(应等于它在溶液中各种形式的浓度之和)
[例如]溶液中,,而在溶液中由于水解和电离,不仅在中存在,还在、。
在溶液中,水电离出的与始终相等,
[例如]溶液,溶液中就是水电离的,部分和结合成和,但是要把溶液中剩下的和结合了的的两两相加,一定等于的总量。
(由结合的需要2个,所以系数为2)
五、氧化还原反应;
1、氧化剂、还原剂;
(1)根据化合价升降和电子转移来判断氧化剂和还原剂;
2、原电池;
(1)铜锌原电池;
定义:
化学能转化为电能。
正极;
还原反应不活泼金属(Cu)保护
负极;
氧化反应活泼金属(Zn)腐蚀
实质;
电流方向;
溶液中负极到正极。
电子方向;
与电流方向相反,溶液中正极到负极。
构成原电池条件;
①两个电极(活泼性不同)。
②电解质溶液。
③构成闭合回路。
④必须使反应自发进行。
3、电解;
(1)饱和氯化钠溶液和氯化铜溶液的电解;
电解饱和氯化钠;
阳极;
氧化反应
阴极;
还原反应
现象;
阳极有黄绿色气体。
阴极有气泡,阴极酚酞变红(有NaOH),
溶液中正极到负极。
与电流方向相反,溶