生物工程下游技术复习题Word文档格式.docx
《生物工程下游技术复习题Word文档格式.docx》由会员分享,可在线阅读,更多相关《生物工程下游技术复习题Word文档格式.docx(16页珍藏版)》请在冰点文库上搜索。
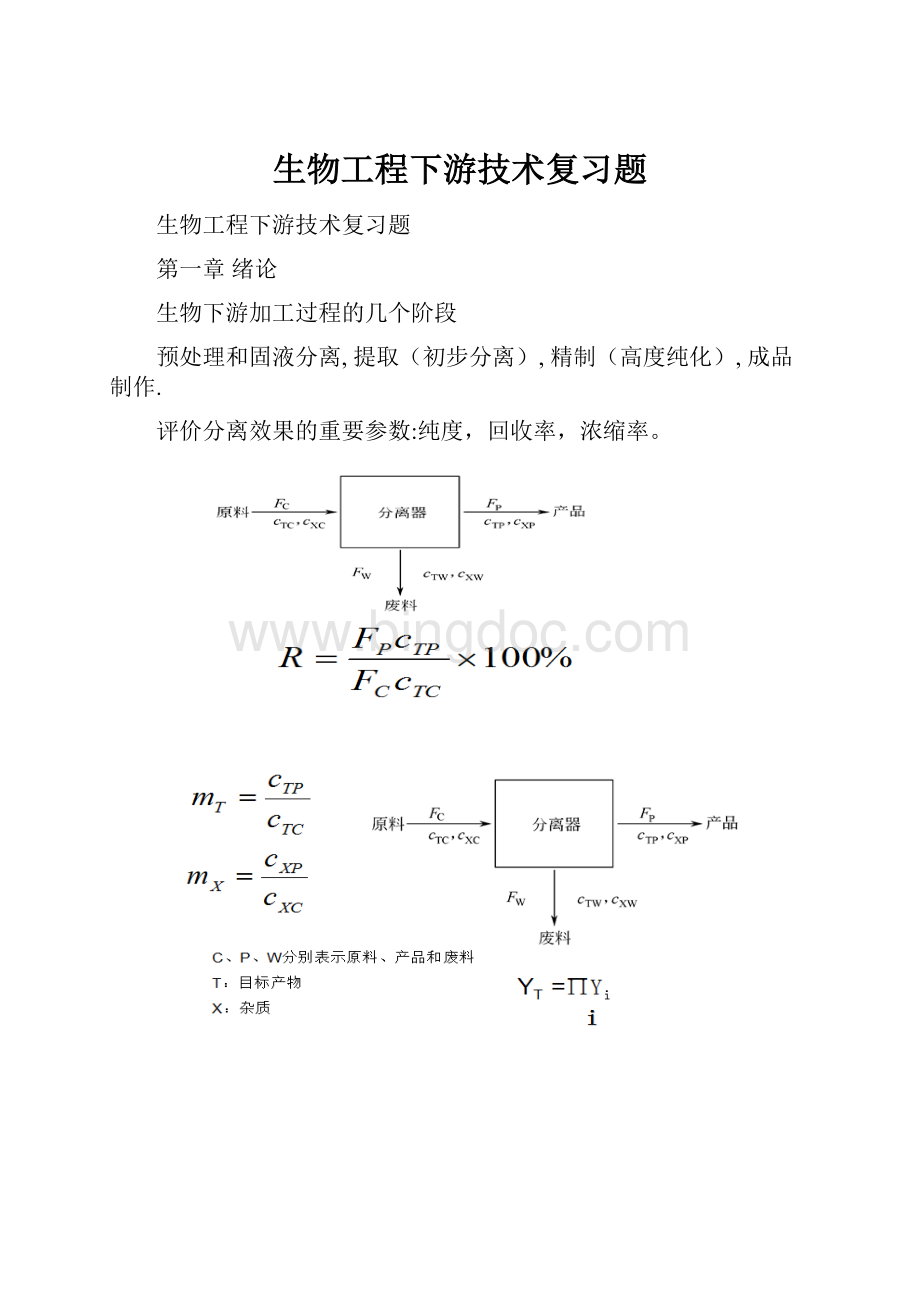
珠磨法原理:
进入珠磨机的细胞悬浮液与极细的玻璃小珠、石英砂、氧化铝等研磨剂(直径小于1mm)一起快速搅拌或研磨,研磨剂、珠子与细胞之间的互相剪切、碰撞,使细胞破碎,释放出内含物。
在珠液分离器的协助下,珠子被滞留在破碎室内,浆液流出从而实现连续操作。
高压匀浆法原理:
利用高压使细胞悬浮液通过针形阀,由于突然减压和高速冲击撞击环使细胞破碎,细胞悬浮液自高压室针形阀喷出时,每秒速度高达几百米,高速喷出的浆液又射到静止的撞击环上,被迫改变方向从出口管流出。
不适用范围:
易造成堵塞的团状或丝状真菌,
较小的革兰氏阳性菌,含有包含体的基因工程菌(因包含体坚硬,易损伤匀浆阀)
珠磨法固体剪切作用可达较高破碎率,可较大规模操作,大分子目的产物易失活,浆液分离困难
高压匀浆法液体剪切作用可达较高破碎率,可大规模操作,不适合丝状菌和革兰氏阳性菌
超声破碎法液体剪切作用对酵母菌效果较差,破碎过程升温剧烈,不适合大规模操作
X-press法固体剪切作用破碎率高,活性保留率高,对冷冻敏感目的产物不适合
酶溶法酶分解作用具有高度专一性,条件温和,浆液易分离,溶酶价格高,通用性差
化学渗透法改变细胞膜的渗透性具一定选择性,浆液易分离,但释放率较低,通用性差
渗透压法渗透压剧烈改变破碎率较低,常与其他方法结合使用
冻结融化法反复冻结-融化破碎率较低,不适合对冷冻敏感目的产物
干燥法改变细胞膜渗透性条件变化剧烈,易引起大分子物质失活
第四章沉淀法
1.蛋白质的表面特征
蛋白质组成
20种氨基酸构成的两性高分子电解质,包括疏水性氨基酸和亲水性氨基酸
蛋白质折叠趋势
疏水性氨基酸:
向内部折叠的趋势
亲水性氨基酸:
分布于蛋白质外表面的趋势
结果
在蛋白质三维结构中仍会有部分疏水性氨基酸残基暴露于表面,在蛋白质表面形成一定的疏水区
蛋白质表面由不均匀分布的荷电基团形成荷电区、亲水区和疏水区构成。
蛋白质的溶解行为是一个独特的性质,由其组成、构象以及分子周围的环境所决定。
一般而言,小分子蛋白质比起在化学上类似的大分子蛋白质更易溶解。
2.盐析法的原理和影响因素
防止蛋白质凝聚沉淀的屏障
⑴蛋白质周围的水化层可以使蛋白质形成稳定的胶体溶液。
⑵蛋白质分子间静电排斥作用。
(存在双电层)
盐析类型(Ks盐析、β盐析)
定义:
蛋白质在高离子强度的溶液中溶解度降低、发生沉淀的现象称为“盐析”。
盐溶:
低盐情况,盐离子强度的增高,蛋白质溶解度增大。
盐析:
高盐,盐离子强度增加,蛋白质溶解度减小。
盐析法原理:
形成离子对,部分中和了蛋白质的电性,排斥作用减弱而能相互靠拢,聚集起来。
中性盐的亲水性比蛋白质大,使蛋白质脱去了水化膜,使其沉淀
㏒S=β-KsI
式中S——蛋白质的溶解度,g/L;
I-一离子强度等于I=1/2∑mizi2;
mi——离子i的摩尔浓度;
Zi——所带电荷;
β——常数,与盐的种类无关,但与温度、pH和蛋白质种类有关;
Ks——盐析常数,与温度和PH无关,但与蛋白质和盐的种类有关。
⑴在一定的pH值及温度条件下,改变盐的浓度(即离子强度)达到沉淀的目的,称为“Ks”分级盐析法。
(Ks盐析:
固定pH,温度,改变盐浓度)
⑵在一定的离子强度下,改变溶液的pH值及温度,达到沉淀的目的,称为“β”分级盐析法。
(β盐析:
固定离子强度,改变pH及温度。
)
3.有机溶剂沉淀的基本原理和影响因素
定义向水溶液中加入一定量亲水性的有机溶剂,降低溶质的溶解度,使其沉淀析出的分离纯化方法。
原理1)加入有机溶剂后,会使水溶液的介电常数降低,导致蛋白质分子之间的静电引力增加,从而使蛋白质发生聚集沉淀。
2)由于使用的有机溶剂与水互溶,它们在溶解于水的同时从蛋白质分子周围的水化层中夺走了水分子,破坏了蛋白质分子的水膜,因而发生沉淀作用。
影响因素:
温度,pH值,样品浓度,中性盐浓度,某些金属离子。
盐溶、盐析、有机溶剂沉淀、等电点沉淀、聚合物沉淀
4.了解其他几种沉淀法
第五章萃取
萃取、浸取、有机溶剂萃取、双水相萃取、反胶团和反胶团萃取、超临界流体和超临界流体萃取
1.萃取相关的几个参数
萃取因素E
VF——料液体积;
Vs——萃取剂的体积;
C1——溶质在萃取液的浓度;
C2——溶质在萃余相的浓度;
K——表观分配系数
萃余率:
理论收率:
洁霉素在20℃和pH10.0时分配系数(丁醇/水)为18。
用等量的丁醇萃取料液中的洁霉素,计算可得理论收率
E=18*1/1=18
理论收率:
94.7%
若改用1/3体积丁醇萃取,
2.工业萃取方式
单级萃取
多级萃取过程、计算
经一级萃取后,未被萃取的分率φ1为
经二级萃取后
经n级萃取后,未被萃取的分率为
产物收率为:
红霉素在pH9.8时的分配系数(醋酸丁酯/水)为44.5,若用1/2体积的醋酸丁酯进行单级萃取,则:
理论收率
若用1/2体积的醋酸丁酯进行二级错流萃取,则
n级萃取后,萃余率为:
理论收率为
青霉素在0℃和pH2.5时的分配系数(醋酸丁酯/水)为35,若用1/4体积的醋酸丁酯进行二级逆流萃取,
则:
n=2,理论收率
改为二级错流萃取,第一级用1/4体积的醋酸丁酯,第二级用1/10体积的醋酸丁酯,则
2.双水相萃取
(1)常用双水相体系(无毒)
聚乙二醇-葡聚糖
聚乙二醇-无机盐系统
(2)影响因素:
与相体积无关,只取决于被分离物质本身的表面性质、温度和特定的双水相体系的性质。
3.反胶团萃取
构成与机理、应用
反胶团:
是两性表面活性剂在非极性有机溶剂中亲水性基团自发的向内聚集而成的,内含微小水滴的,空间尺度仅为纳米级的集合型胶体。
萃取机理:
三步传质过程:
①通过表面液膜扩散,从水相到达相界面;
②在相界面处溶质进入反胶团;
③含溶质的反胶团扩散进入有机相。
反萃操作中溶质亦经历相似的过程,只是方向相反,在界面处溶质从反胶团释放出来。
主要影响因素:
水相的pH值;
盐离子的种类和浓度;
温度;
蛋白质的分子量和浓度
表面活性剂
应用:
分离蛋白质或酶;
分离氨基酸;
分离抗生素;
分离核酸;
用于蛋白质复性
4.超临界流体萃取
萃取技术,又称压力流体萃取、超临界气体萃取、临界溶剂萃取等,是利用处于临界压力和临界温度以上的一些溶剂流体所具有特异增加物质溶解能力来进行分离纯化的技术。
(2)萃取原理:
在超临界状态下,超临界流体具有很好的流动性和渗透性,将超临界流体与待分离的物质接触,使其有选择性地把极性大小、沸点高低和分子量大小的成分依次萃取出来。
然后借助减压、升温的方法使超临界流体变成普通气体,被萃取物质则完全或基本析出,从而达到分离提纯的目的。
(3)SC-CO2萃取的优点:
(1)临界条件温和(Tc=31.06℃Pc=7.2MPa),可以在35~40℃的条件下进行提取,防止热敏性物质的变质和挥发性物质的逸散。
(2)在CO2气体笼罩下进行萃取,萃取过程中不发生化学反应;
又由于完全隔绝了空气中的氧,因此,萃取物不会因氧化或化学变化而变质。
(3)由于CO2无味、无臭、无毒、不可燃、价格便宜、纯度高、容易获得,使用相对安全。
(4)CO2容易提纯与分离的,因此萃取物几乎无溶剂残留,也避免了溶剂对人体的毒害和对环境的污染。
(5)CO2扩散系数大而粘度小,大大节省了萃取时间,萃取效率高。
缺点:
设备投资大。
第六章膜分离
反渗透、水通量、截留率、截断分子量、浓差极化
1.膜的分类:
按孔径大小:
微滤膜、超滤膜、反渗透膜、纳滤膜
按膜结构:
对称性膜、不对称膜、复合膜
按材料分:
合成有机聚合物膜、无机材料膜
多孔膜与致密膜:
前者微滤膜、超滤膜、纳滤膜,后者反渗透膜、渗透蒸发
2.膜的分离机理
孔模型:
以压力为推动力的膜分离技术,按不同孔径来选择分离溶液中所含的微粒或大分子,比膜孔径小的物质和溶剂(水)一起透过膜而较大的物质则被截留
溶解-扩散模型:
在推动力作用下,渗透物质先溶解进入膜的上游侧,然后扩散至膜的下游侧,扩散是控制步骤。
例如气体的渗透分离过程中,推动力是膜两侧渗透物质的分压差
优先吸附-毛细管流动模型:
由于膜表面对渗透物的优先吸附作用,在膜的上游侧表面形成一层该物质富集的吸附液体层。
然后,在压力作用下通过膜的毛细管,连续进入产品溶液中。
3.膜的性能参数(了解)
影响截留率的因素分子形状:
线状分子易透过,s线<
s球;
吸附作用:
溶质吸附于膜孔壁上,降低膜孔有效直径
浓差极化:
在膜分离操作中,所有溶质均被透过液传送到膜表面上,不能完全透过膜的溶质受到膜的截留作用,在膜表面附近浓度升高。
这种在膜表面附近浓度高于主体浓度的现象称为浓度极化或浓差极化s
4.膜污染及处理方法:
类型:
沉淀污染吸附污染生物污染
处理:
物理方法:
等压冲洗;
反冲洗;
脉冲流动;
超声波
化学方法:
化学清洗剂(稀碱、稀酸、酶、表面活性剂、络合物和氧化剂等)
5.主要的几种膜分离过程和应用
微孔过滤(MF)、超滤(UF)、反渗透(RO)、纳滤(NF)、渗析(D)、电渗析(ED)、液膜(LM)及渗透蒸发(PV)等
6.工业中常用的膜组件类型
工业上应用的膜组件主要有中空纤维式、管式、螺旋卷式、板框式等四种型式。
管式和中空纤维式组件也可以分为内压式和外压式两种。
7.液膜的组成和机理
组成:
外相、膜相、内相
(1)无载体液膜的分离机理①选择性渗透:
分离物在液膜中的溶解度差异
②化学反应:
为提高富集的效果,可使待富集成分在内水相发生化学反应以降低其浓度,促使迁移不断进行。
③萃取和吸附
(2)有载体液膜的分离机理——“载体输送”
第七章色谱分离
1.色谱分类
两相分子的聚集状态分:
液相,气相,超临界流体色谱
固定相的形状分:
柱色谱纸色谱薄层色谱
按分离机制分:
分配色谱:
利用分配系数的不同
吸附色谱:
利用物理吸附性能的差异
离子交换色谱:
利用离子交换原理
空间排阻色谱:
利用排阻作用力的不同
2.凝胶色谱:
分离机理、分配系数的讨论、应用(主要:
脱盐、分离、测分子量)
以多孔性凝胶填料为固定相,按分子大小顺序分离样品中各个组分的液相色谱方法
分离机理:
小分子量的化合物可以进入孔中,滞留时间长;
大分子量的化合物不能进入孔中,直接随流动相流出。
分子大小介于二者之间的分子在流动中部分渗透,渗透的程度取决于它们分子的大小,流出的时间介于二者之间.
分配系数:
Ve=Vo+KdVi
Kd=(Ve-Vo)/Vi
当分子的Kd=0时,Ve=Vo即该分子被完全排阻于凝胶颗粒之外,全部分布于流动相里,固定相里分布为零(A);
当分子的Kd=1时,Ve=Vo+Vi即该分子完全不被排阻,均匀的分布在流动相和固定相里,两相比值为1(C);
当0<
Kd<
1时,Ve=Vo+Kd*Vi即表明分子受到部分排阻(B)。
3.分配色谱机理(正相色谱和反相色谱)
是基于样品分子在包覆于惰性载体(基质)上的固定相液体和流动相液体之间的分配平衡的色谱方法
正相HPLC
极性:
固定相>
流动相
固定相-极性强
流动相(己烷,庚烷)-极性弱
极性物质后出峰
反相HPLC
固定相<
固定相-极性弱
流动相(甲醇,乙腈等)-极性强
极性小物质后出峰
4.离子交换色谱:
离子交换树脂的组成;
应用
机理:
树脂上可电离离子与流动相中具有相同电荷的离子及被测组分的离子进行可逆交换而分离。
骨架功能基团活性离子(或可交换离子)
软水制备:
利用钠型阳离子交换树脂去除水中的钙、镁离子。
2RSO3Na+Ca2+X2RSO3Ca2++Na2X
分离纯化——氨基酸制备
无盐水制备无盐水制备是利用氢型阳离子交换树脂和羟型阴离子交换树脂的组合以除去水中所有的离子,其反应式如下
6.亲和色谱:
影响亲和作用的因素;
洗脱方式;
了解常用的亲和配基
离子强度PH抑制氢键形成的物质温度液体离子螯合剂
亲和作用主要源于静电引力,提高离子强度会减弱或完全破坏亲和作用;
亲和作用主要源于氢键作用,提高离子强度也会降低或消除氢键作用;
当亲和结合作用主要源于疏水性相互作用,增大离子强度则可提高亲和结合作用;
洗脱方式:
特异性洗脱:
利用洗脱液中的物质与待分离物质或与配体的亲和特性而将待分离物质从亲和吸附剂上洗脱下来。
非特异性洗脱:
通过改变洗脱缓冲液pH、离子强度、温度等条件,降低待分离物质与配体的亲和力而将待分离物质洗脱下来。
第八章电泳
1.电泳的分类
分离原理:
移动界面电泳区带电泳稳态电泳
支持介质:
纸电泳醋酸纤维薄膜电泳琼脂凝胶电泳聚丙烯酰胺凝胶电泳
SDS-聚丙烯酰胺凝胶电泳
支持介质形状:
薄层电泳、板电泳、柱电泳等
用途:
分析电泳、制备电泳、定量免疫电泳、连续制备电泳等
2.SDS-PAGE的基本原理及测定分子量的方法
基本原理:
聚丙烯酰胺凝胶系统中加入SDS,SDS与蛋白质结合后使蛋白质-SDS复合物上带有大量的负电荷,使各种蛋白质分子本身的电荷完全被SDS掩盖。
这样就消除了各种蛋白质本身电荷上的差异。
蛋白质电泳迁移率取决于其分子量,而与形状及所带电荷无关
测定分子量的方法:
样品处理:
在沸水浴中煮3~5min,使SDS与蛋白质充分结合,以使蛋白质完全变性和解聚,并形成棒状结构。
短轴一定,长轴长度正比于P分子量。
加样。
电泳过程中分子迁移的规律,小分子走在前头,大分子滞后。
染色脱色。
在一定的凝胶浓度下,多肽链分子量的对数与多肽链的相对迁移率成线性关系,所以可以通过标准曲线求未知多肽链分子量。
3.双向电泳的构成
原理:
第一向进行等电聚焦,蛋白质沿pH梯度分离,至各自的等电点;
随后,再沿垂直的方向进行分子量的分离。
第一向:
等电聚焦电泳第二向:
SDS-PAGE
双向电泳后的凝胶经染色后蛋白呈现二维分布图:
水平方向反映出蛋白在pI上的差异,垂直方向反映出它们在分子量上的差别。