高考化学 铁及其化合物推断题 培优练习含答案Word文档下载推荐.docx
《高考化学 铁及其化合物推断题 培优练习含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高考化学 铁及其化合物推断题 培优练习含答案Word文档下载推荐.docx(19页珍藏版)》请在冰点文库上搜索。
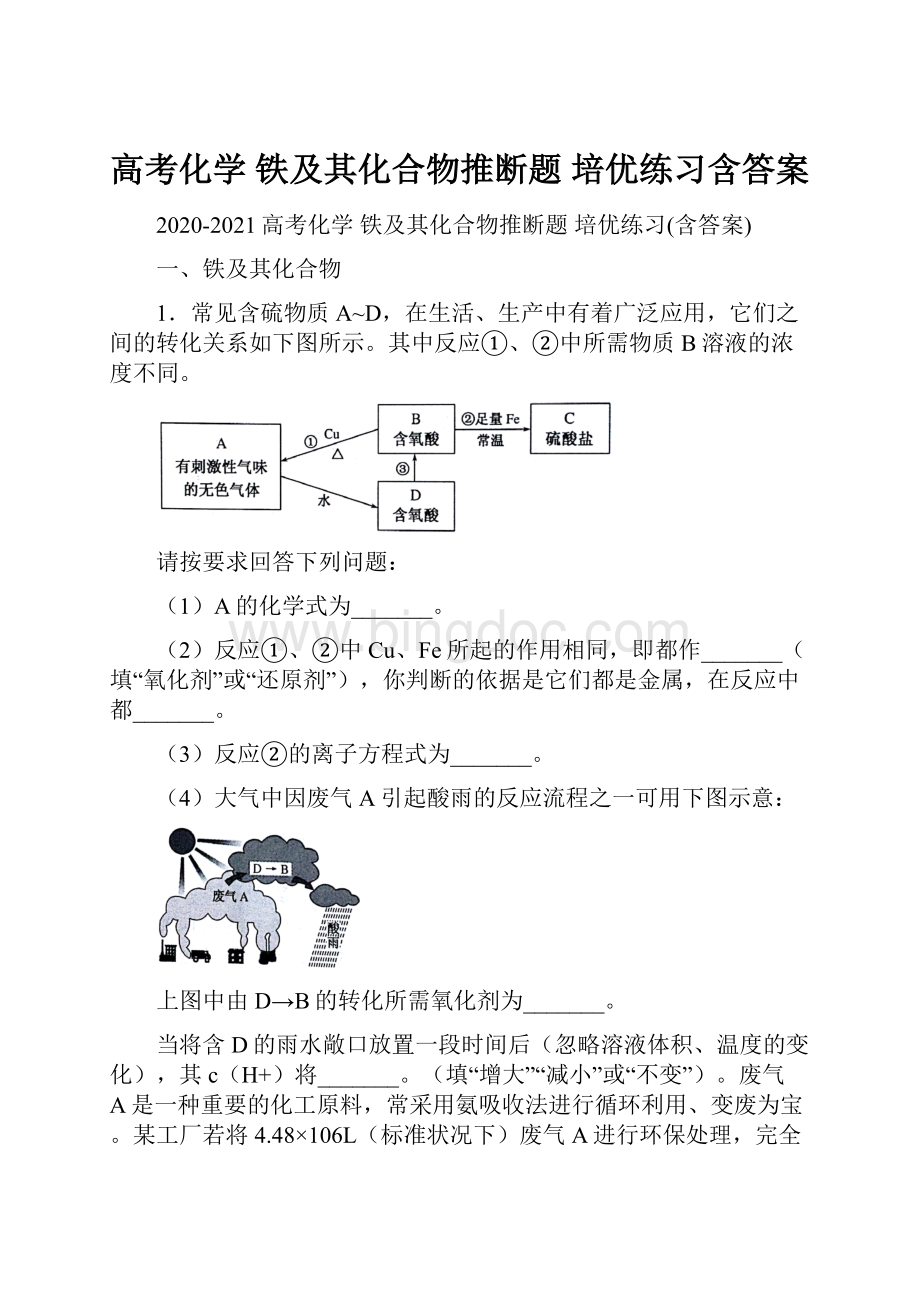
H2SO3,D是H2SO3。
【详解】
(1)由解析可知,A的化学式为SO2;
(2)反应①、②中,反应前后Cu、Fe元素的化合价都升高,故反应①、②中Cu、Fe所起的作用相同,即都作还原剂;
(3)铁与稀硫酸常温下反应,离子方程式为Fe+2H+=Fe2++H2↑;
(4)H2SO3→H2SO4过程中,S元素化合价升高,即H2SO3被空气中的O2氧化为H2SO4;
2H2SO3+O2=H2SO4,H2SO3是弱酸,H2SO4是强酸,故当将含H2SO3的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将增大;
SO2+NH3•H2O=NH4HSO3,n(SO2)=
=2.0×
105mol,故n(NH3•H2O)=2.0×
105mol,需消耗10mol/L氨水溶液(溶质全部以NH3•H2O计)的体积为
=20000L。
【点睛】
本题是结合图考查S元素的化合物知识,有关化学方程式书写等,难度不大。
2.以下是与氧气性质有关的实验,回答相关问题。
(1)写出铜和氧气反应的化学方程式__。
(2)写出铁丝在氧气中燃烧的化学方程式__,该反应的实验现象为__。
(3)硫燃烧时瓶底盛少量水的作用是__,硫在氧气中燃烧比在空气中燃烧更剧烈的原因是因为___不同。
【答案】2Cu+O2
2CuO3Fe+2O2
Fe3O4剧烈燃烧,火星四射,放出热量,生成黑色固体吸收生成的二氧化硫气体,防止污染空气氧气浓度
(1)该实验的原理是:
铜粉与氧气反应生成氧化铜;
发生反应的化学方程式为2Cu+O2
2CuO;
(2)该铁丝在氧气中燃烧生成了四氧化三铁,该反应的化学方程式是:
3Fe+2O2
Fe3O4;
反应的实验现象是:
剧烈燃烧,火星四射,生成黑色固体;
(3)由于二氧化硫是对大气有污染的气体,做硫在氧气燃烧的实验时瓶底盛放少量水的作用是:
吸收二氧化硫防止污染空气;
硫在空气中燃烧产生淡蓝色火焰、在氧气中燃烧蓝紫色火焰,氧气中氧气的浓度比空气中氧气的浓度要大。
3.钠、铝、铁是三种重要的金属。
请回答:
(1)钠元素的金属性比铝___(填“强”或“弱”)。
三种金属对应的氢氧化物中,具有两性的物质是__(填化学式)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为__;
可观察到的实验现象是__(填序号)。
A.钠沉到水底B.钠熔成小球
C.小球四处游动D.钠无变化
(3)Fe与Cl2在一定条件下反应,所得产物的化学式是__。
将该产物溶于水配成溶液,分装在两支试管中。
①若向其中一支试管中滴加KSCN溶液,则溶液变成___色。
②向另一支试管中滴加NaOH溶液,反应的离子方程式是___。
(4)Na2O2可作为呼吸面具中的供氧剂,其供氧时主要反应的化学方程式为:
__。
(5)在AlCl3溶液中逐滴加入NaOH溶液至过量,观察到的现象是___。
【答案】强Al(OH)32Na+2H2O=2Na++2OH-+H2↑BCFeCl3红Fe3++3OH-=Fe(OH)3↓2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑先生成白色沉淀,然后白色沉淀消失
(1)金属钠与铝处于同周期,金属性逐渐减弱,最高价氧化物对应的水化物碱性逐渐减弱;
(2)金属钠与水反应,生成氢氧化钠和氢气;
由于钠的密度小于水的密度,因此钠浮在水面上;
反应放热,因此钠熔化成光亮的小球;
反应放出气体,因此钠四处游动;
最终金属钠完全溶解;
(3)Fe在Cl2燃烧,生成FeCl3,将FeCl3溶于水后,溶液中存在大量的Fe3+,滴加KSCN溶液后,溶液变为血红色;
滴加氢氧化钠溶液后生成红褐色沉淀;
(4)Na2O2可作为呼吸面具中的供氧剂,可与CO2和H2O反应;
(5)在AlCl3溶液中逐滴加入NaOH溶液,生成白色沉淀Al(OH)3,当NaOH溶液过量时,沉淀逐渐溶解,最终完全消失。
(1)钠元素的金属性比铝强;
钠、铝、铁三种金属对应的氢氧化物中具有两性的物质是Al(OH)3;
(2)钠和冷水反应,生成氢氧化钠和氢气,离子方程式为:
2Na+2H2O=2Na++2OH-+H2↑;
最终金属钠完全溶解,因此金属钠与水反应的实验中,可观察到的实验现象是钠熔成小球、小球四处游动,答案选BC;
滴加氢氧化钠溶液后生成红褐色沉淀,离子方程式为:
Fe3++3OH-=Fe(OH)3↓;
(4)Na2O2可作为呼吸面具中的供氧剂,可与CO2和H2O反应,反应方程式为:
2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑;
4.明矾在日常生活中用途非常广泛。
用废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO等)为原料制取明矾的工艺流程如下图。
回答下列问题:
已知:
Fe3+开始沉淀到沉淀完全时溶液的pH为1.9~3.7。
(1)明矾净水的原理是_______________________(用离子方程式表示)。
(2)“酸溶”时,Al2O3溶解的化学方程式为______________________。
(3)“氧化”时,发生反应的离子方程式为_______________。
(4)“步骤①”的目的是______;
“滤渣2”经碱洗、水洗、干燥和煅烧,得到的产品的名称是_____(填俗称)。
(5)“步骤②”包含的操作有_________、__________、过滤及干燥。
【答案】Al3++3H2O⇌Al(OH)3(胶体)+3H+Al2O3+3H2SO4=Al2(SO4)3+3H2O2Fe2++H2O2+2H+=2Fe3++2H2O调节溶液pH,使沉淀完全铁红蒸发浓缩冷却结晶
废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO等)加入足量稀硫酸进行酸浸溶解并过滤,得到含有Al3+、Fe2+、Fe3+、SO42-的酸性滤液,滤渣1为不与硫酸反应的杂质,向滤液中加入双氧水将滤液中的Fe2+氧化为Fe3+,由于Fe(OH)3比Al(OH)3更难溶,向氧化后的滤液中加入Al(OH)3,Fe3+转化为更难溶的Fe(OH)3沉淀,过滤后得到含有Al3+、SO42-的滤液,滤渣2为Fe(OH)3,向滤液中加入K2SO4制得产品溶液,对溶液进行蒸发浓缩、冷却结晶、过滤、干燥最终得到产品硫酸铝钾的晶体,据此分析解答。
(1)明矾是强酸弱碱盐,弱酸根离子Al3+水解产生氢氧化铝胶体,能够吸附水中悬浮的物质形成沉淀而除去,从而达到达到净水的目的。
其反应原理用方程式表示为:
Al3++3H2O⇌Al(OH)3(胶体)+3H+;
(2)“酸溶”时,Al2O3和硫酸反应生成硫酸铝和水,化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(3)“氧化”时,加入氧化剂过氧化氢,将滤液中的Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)“步骤①”加入滤液中加入Al(OH)3,作用是调节溶液的pH值,由于Fe(OH)3比Al(OH)3更难溶,使Fe3+完全转化为Fe(OH)3沉淀而除去;
“滤渣2”的成分是Fe(OH)3,煅烧时分解生成氧化铁,它是一种红棕色粉末,常用作颜料,俗名是铁红;
(5)“步骤②”是从溶液中获得产品明矾,包含的操作有蒸发浓缩、冷却结晶、过滤及干燥。
5.二氧化铈(CeO2)是一种重要的稀土氧化物,主要用于多相催化,例如乘用车的废气催化转化器,太阳能电池中的光催化,水分解或污染物的分解等。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。
某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_________。
(2)滤液1中加入H2O2溶液的目的是____,滤渣1中加入H2O2溶液的目的是_____。
(3)设计实验证明滤液1中含有Fe2+_______________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,该反应的离子方程式为_______。
(5)由滤液2生成Ce(OH)4的离子方程式为__________________。
(6)已知Fe(OH)3的Ksp近似值为10-38。
常温下,在含有Fe3+杂质的溶液中,为使其除尽应调节溶液pH至少为_____。
(通常认为当离子浓度小于1.0×
10-5mol·
L-1时即视为沉淀完全)
【答案】H2SO4使Fe2+氧化为Fe3+使CeO2还原为Ce3+取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+Fe2++2FeO(OH)=Fe3O4+2H+4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓3
制备纯净的CeO2和硫酸铁铵晶体,由流程可知,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中加入A为稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;
滤液1中加入稀硫酸和铁粉,被Fe2(SO4)3还原为FeSO4,溶液1为FeSO4溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸亚铁铵晶体;
滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣2为SiO2;
滤液2加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为4Ce3++O2+12OH﹣+2H2O═4Ce(OH)4↓,加入分解Ce(OH)4得到产品CeO,以此来解答。
(1)CeO2不溶于稀硫酸,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中SiO2也不溶于酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离;
(2)滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+,滤渣1中加入H2O2溶液的目的是还原CeO2为Ce3+;
(3)设计实验证明滤液1中含有Fe2+的方法为:
取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+;
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,该反应的离子方程式为Fe2++2FeO(OH)═Fe3O4+2H+;
(5)滤液2为含有Ce3+的溶液,加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,离子方程式为:
4Ce3++O2+12OH﹣+2H2O═4Ce(OH)4↓;
(6)Fe(OH)3的Ksp近似值为10﹣38,Fe3+完全沉淀时c(OH﹣)=
=10﹣11mol/L,常温下c(H+)=
=10﹣3mol/L,为使其除尽应调节溶液pH至少为3。
6.2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。
高度评价他们“创造了一个可充电的世界”。
锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。
工业上常以锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3的溶解度随温度变化如图所示:
试回答下列问题:
(1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过_______来提高浸取率。
(2)反应I中应调节pH范围为_______,沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有___________。
(3)反应Ⅱ的离子方程式为_________________。
(4)“操作I"的名称为______;
洗涤Li2CO3沉淀要使用_______(选填“热水”或“冷水”),理由是___________________________________________________。
【答案】延长浸取时间(或:
增大酸的浓度)4.7~9.6(或4.7≤pH<
9.6)Fe(OH)3、CaSO4Mg2++Ca(OH)2=Ca2++Mg(OH)2↓(或:
Mg2++2OH-=Mg(OH)2↓)CO32-+Ca(OH)2=CaCO3↓+2OH-(或:
Ca2++CO32-=CaCO3↓)过滤热水碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失
锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量硫酸溶解锂辉矿,再加入碳酸钙调节溶液的pH,加入双氧水将溶液里的亚铁离子氧化为铁离子,使铁离子和铝离子沉淀完全,过滤除去沉淀,然后加入氢氧化钙和碳酸钠除去溶液中的钙离子和镁离子,过滤得到的溶液中主要是锂离子的水溶液,蒸发浓缩,加入饱和的碳酸钠溶液沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到氯化锂溶液,加热蒸干得到氯化锂,电解氯化锂得到金属锂。
根据以上分析解答此题。
(1)增大酸的浓度、升高温度、增大固体表面积、搅拌或延长浸取时间可以提高浸取率,所以为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过延长浸取时间或增大酸的浓度来提高浸取率;
答案为:
延长浸取时间(或:
增大酸的浓度)。
(2)反应Ⅰ中调节pH的目的是除去Fe3+、Al3+,由表中数据可知调节pH范围为4.7~9.6(或4.7≤pH<
9.6),硫酸钙微溶于水,所以沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有Fe(OH)3、CaSO4;
4.7~9.6(或4.7≤pH<
9.6);
Fe(OH)3、CaSO4。
(3)反应Ⅱ调节pH=11,目的是除去Mg2+和Ca2+,根据加入的试剂,主要离子方程式为:
Mg2++Ca(OH)2=Ca2++Mg(OH)2↓(或:
Mg2++2OH-=Mg(OH)2↓)、CO32-+Ca(OH)2=CaCO3↓+2OH-(或:
CO32-+Ca2+=CaCO3↓);
CO32-+Ca2+=CaCO3↓)。
(4)“操作Ⅰ”目的是分离出固体碳酸锂,所以“操作Ⅰ”是过滤;
由图可知碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失,所以洗涤碳酸锂沉淀要用热水;
过滤;
热水;
碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失。
7.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·
7H2O),流程如下:
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为____________。
能提高烧渣浸取速率的措施有_________(填字母)。
A.将烧渣粉碎B.降低硫酸的浓度C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是___________(填字母)。
A.Fe粉B.SO2C.NaI
还原结束时,溶液中的主要阴离子有___________。
(3)滤渣Ⅱ主要成分的化学式为_____________;
由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是__________、__________过滤、洗涤、干燥。
【答案】4Fe2++O2+4H+=4Fe3++2H2OACBSO42-Al(OH)3蒸发浓缩冷却结晶
烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入试剂X,随着X的加入,溶液pH逐渐减小,X应为SO2,得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O。
(1)溶液中的Fe2+易被空气中的O2氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,提高烧渣浸取速率,可增大固体的表面积,提高反应温度,或增大离子的浓度的方法,所以选项AC正确;
(2)由以上分析可知,随着X的加入,溶液酸性增强,应通入二氧化硫,被氧化生成硫酸,反应后溶液中含有SO42-;
(3)由以上分析可知滤渣Ⅱ为氢氧化铝,即Al(OH)3,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O。
8.碱性锌锰电池的工作原理:
Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。
某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
(1)滤液A中溶质的电子式为____________。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
_____________________________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"
工序中发生反应的离子方程式:
_________________,___________________。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"
工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;
生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________。
(6)用氨水“调pH"
后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________。
【答案】
+3MnO(OH)+Fe2++3H+=Mn2++Fe3++2H2OFe+2Fe3+=3Fe2+Fe+2H+=Fe2++H2↑112a-56b生成的Fe3+催化了双氧水的分解(OH-)<c(H+)<c(SO42-)<c(NH4+)
废旧无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,废旧电池加入水浸取过滤得到滤液A和滤渣,滤渣加入过量稀硫酸熔渣后加入铁,稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,过滤得到滤渣B和滤液,测定滤液成分,“调铁”工序的目的是调整溶液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-x)Fe2O4相符合,加入过氧化氢氧化亚铁离子生成铁离子,用氨水“调pH”后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥为硫酸铵,据此解答。
(1)滤液A中溶质是KOH,含有离子键和共价键,电子式为
。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时的还原产物中的锰的化合价相同,可知Mn为+2价,锌+2价、氧元素-2价,则根据化合价代数和为0可知铁元素的化合价为+3;
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,该反应的离子方程式为MnO(OH)+Fe2++3H+=Mn2++Fe3++2H2O。
(4)①“调铁"
工序中发生反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。
②n(Mn2+)+n(Zn2+)=amol•L-1×
1000L=1000amol,已有铁元素bmol/L×
1000L=1000bmol,由电荷守恒可知MnxZn(1-x)Fe204中含Fe2O42-为1000amol,其中铁元素的物质的量为1000amol×
2=2000amol,还需加入铁的物质的量为2000amol-1000bmol,质量为(2000amol-1000bmol)mol×
56g/mol=(112a-56b)kg。
工序中,加入双氧水的目的是把Fe2+氧化为Fe3+,生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是生成的Fe3+催化了双氧水的分解。
(6)用氨水“调pH”后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥为硫酸铵,铵根离子水解溶液显酸性,离子浓度为c(OH-)<c(H+)<c(SO42-)<c(NH4+)。
9.我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。
已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
(1)焙烧前,