国家选定的非国际单位制单位Word文件下载.docx
《国家选定的非国际单位制单位Word文件下载.docx》由会员分享,可在线阅读,更多相关《国家选定的非国际单位制单位Word文件下载.docx(11页珍藏版)》请在冰点文库上搜索。
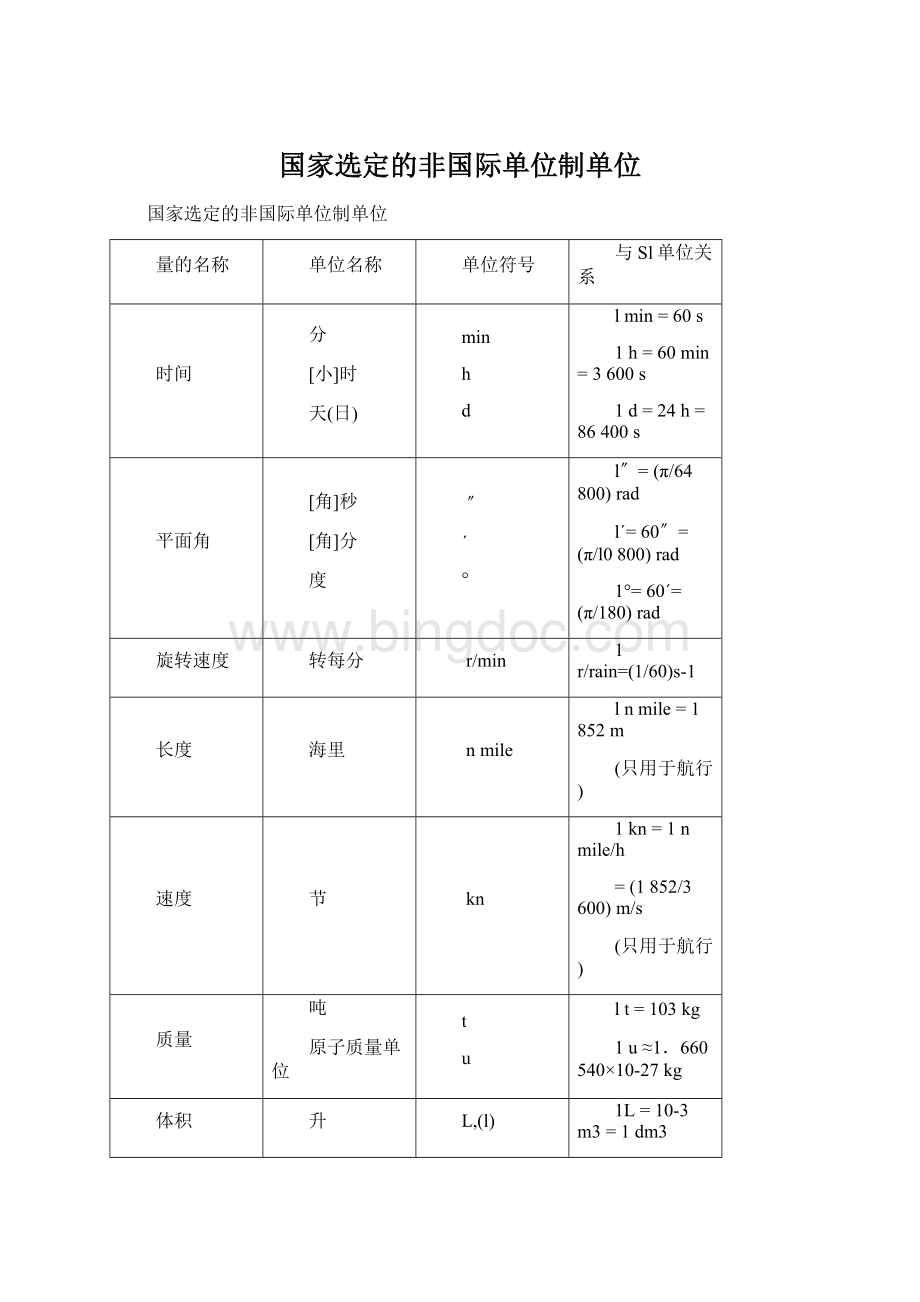
kn
1kn=1nmile/h
=(1852/3600)m/s
质量
吨
原子质量单位
t
u
lt=103kg
1u≈1.660540×
10-27kg
体积
升
L,(l)
1L=10-3m3=1dm3
能
电子伏
eV
1eV≈1.602177×
10-19J
级差
分贝
dB
线密度
特[克斯]
tex
1tex=1g/km
面积
公顷
hm2
1hm2=104m2
注:
①周、月、年(年的符号为a)为一般常用时间单位。
②[]内的字,是在不致混淆的情况下,可以省略的字。
③()内的字为前者的同义语。
④角度单位度分秒的符号不处于数字后时,用括弧。
⑤升的符号中,小写字母l为备用符号。
⑥r为转的符号。
⑦人民生活和贸易中,质量习惯称为重量。
⑧公里为千米的俗称,符号为km。
⑨104称为万,108称为亿,1012称为万亿,这类词的使用不受词头名称的影响,但不应与词头混淆。
⑩1990年,经国务院批准,国家技术监督局、国家土地管理局和农业部联合发布了我国土地面积的计量单位为:
平方公里(km2,100万平方米);
公顷(hm2,l万平方米);
平方米(m2,1平方米)。
并决定从1992年1月1日起正式应用。
1993年原国家技术监督局、卫生部和国家医药管理局联合发文,对血压计量单位的使用作了相应的补充规定,考虑到我国国情并借鉴国际上其他主要国家血压计量单位的使用情况,规定可以使用千帕斯卡kPa和毫米汞柱mmHg两种血压计量单位。
即在临床病历、体检报告、诊断证明、医疗证明、医疗记录等非出版物中可使用毫米汞柱mmHg或千帕斯卡kPa。
在出版物及血压计使用说明中可使用千帕斯卡kPa或毫米汞柱mmHg,但如果使用毫米汞柱mmHg应注明与kPa的换算关系。
根据国际交流和国外期刊的需要,可任意选用mmHg或kPa。
消毒与灭菌的基本概念
消毒与灭菌的方法可分为物理方法和化学方法两大类。
常用以下术语表示物理或化学方法对微生物的杀灭程度:
灭菌:
指杀灭或去除物体上所有微生物的方法,包括抵抗力极强的细菌芽胞。
消毒:
指杀死物体上病原微生物的方法,芽胞或非病原微生物可能仍存活。
用以消毒的药品称为消毒剂。
防腐:
防止或抑制体外细菌生长繁殖的方法。
无菌:
指没有活菌的意思。
防止细菌进入人体或其他物品的操作技术,称为无菌操作。
一、热力灭菌法的种类及其应用
物理消毒灭菌的方法主要有热力法、射线法和过滤法三种。
超声波、干燥、冷冻也能杀菌抑菌。
热力灭菌法是利用热能去变性蛋白质或核酸、破坏细胞膜或胞膜来实现杀死微生物。
分干热灭菌和湿热灭菌两大类。
干热灭菌的方法有:
①焚烧:
适用于废弃物品或动物尸体等;
②烧灼:
适用于实验室的金属器械(镊、剪、接种环等)、玻璃试管口和瓶口等的灭菌;
③干烤:
在干烤箱内加热至160~170℃维持2小时,可杀灭包括芽胞在内的所有微生物。
适用于耐高温的玻璃器皿、瓷器、玻璃注射器等;
④红外线:
常用于碗、筷等食具的灭菌;
⑤微波:
波长为1~1000mm的电磁波可穿透玻璃、塑料薄膜与陶瓷等物质,灭菌效果不可靠,用于非金属器械及食具消毒。
湿热灭菌法可在较低的温度下达到与干热法相同的灭菌效果,因为:
①湿热中蛋白吸收水分,更易凝固变性;
②水分子的穿透力比空气大,更易均匀传递热能;
③蒸汽有潜热存在,每1克水由气态变成液态可释放出529卡热能,可迅速提高物体的温度。
常用的湿热灭菌法有:
(一)巴氏消毒法
加热61.1~62.8℃30分钟,或者72℃15秒,可杀死乳制品的链球菌、沙门菌、布鲁菌等病原菌,但仍保持其中不耐热成分不被破坏,用于乳制品消毒。
(二)煮沸法
繁殖体需100%5分钟以上,芽胞需2小时以上,常用于食具、刀剪、注射器的消毒。
(三)流通蒸汽消毒法
在一个大气压下利用100℃的水蒸气进行消毒,15~30分钟可杀灭细菌繁殖体,但不保证杀灭芽胞。
(四)间歇灭菌法
利用反复多次的流通蒸汽加热,杀灭所有微生物,包括芽胞。
适用于不耐高热的含糖或牛奶的培养基。
(五)高压蒸汽灭菌法
可杀灭包括芽胞在内的所有微生物,是灭菌效果最好、应用最广的灭菌方法。
方法是将需灭菌的物品放在高压锅内,加热至103.4kPa(1.05kg/cm2)蒸汽压下,温度达到121.3℃,维持15~20分钟。
适用于普通培养基、生理盐水、手术器械、玻璃容器及注射器、敷料等物品的灭菌。
二、紫外线消毒的原理和应用
常用的射线是紫外线和电离辐射:
①紫外线:
波长200~300nm的紫外线(包括日光中的紫外线)具有杀菌作用,以250~260nm最强。
原理是紫外线可使DNA链上相邻的两个胸腺嘧啶共价结合而形成二聚体,阻碍DNA正常转录,导致微生物的变异或死亡。
紫外线穿透力较弱,一般用于手术室、病房、实验室的空气消毒。
紫外线可损伤皮肤和角膜,应注意防护。
电离辐射包括γ射线、x射线和加速电子等,对各种微生物均有致死作用,细菌繁殖体对射线比芽胞要敏感,用于一次性医用塑料制品批量灭菌。
计算杀灭对数值的时候,取小数点后两位值,可以进行数字修约。
如果消毒试验组消毒处理后平均生产菌落数小于等于1时,其杀灭对数值,即大于等于试验前对照组平均活菌浓度的对数值。
(6)有机干扰物质:
按30g牛血清白蛋白中加入1000ml蒸馏水的比例配制约100ml,溶解后用0.45um的无菌滤膜进行过滤除菌后使用,未用完的可于2-8℃冰箱中保存。
(1)菌试验组:
取无菌大试管加入0.5ml菌悬液,再加入0.5ml的有机干扰物质,分别用无菌吸管吸取0.2%的新洁尔灭消毒液4.0ml,加入试管中,迅速混匀并立即计时。
待试验菌与0.2%的新洁尔灭消毒液相互作用2.5min时,吸取0.5ml试验菌与消毒剂的混合液,加于4.5ml经灭菌的0.1M硫代硫酸钠-生理盐水溶液中,混匀。
试验菌与消毒剂混合液经硫代硫酸钠-生理盐水溶液作用10min后,吸取1.0ml样液,按活菌培养计数测定方法测定存活菌数,每管样液接种2个平皿即可。
如果菌液浓度较高时,可进行10倍系列稀释后,在进行活菌培养计数,作为试验组,其计数结果为CX。
(2)阳性对照组:
用4.0ml磷酸盐缓冲液代替4.0ml0.2%的新洁尔灭消毒液与0.5ml菌悬液、0.5ml有机干扰物质混合2.5min后,取0.5ml混合液与4.5ml
0.1M硫代硫酸钠-生理盐水溶液反应,作用10min后。
计数方法同试验组,计数结果为C0。
(3)阴性对照组:
吸取此次试验用的纯化水0.5ml、0.5ml有机干扰物质、4.0ml磷酸盐缓冲液混匀,混匀后取0.5ml混合液与4.5ml0.1M硫代硫酸钠-生理盐水溶液作用10min后,吸取1.0ml混合液,按活菌培养计数测定方法测定存活菌数,作为阴性对照。
(4)培养:
所有用细菌试验的样品均放入30-35℃培养箱中培养,培养48小时观察结果;
用真菌试验的样品放入23-28℃培养箱中培养,培养72小时观察结果。
4、讨论
4.1
由结果可以看出通过中和剂中和效果试验可以确定,每升PBS缓冲液中加入10g组氨酸、50ml吐温-80、5g卵磷脂可以中和新洁尔灭消毒液的消毒效果,因此,在日常消毒中应该避免以上物质的混入。
4.2
由消毒剂定量悬浮试验结果可以得出新洁尔灭消毒液能够在10分钟内使所有试验菌的数量至少下降99.99%,说明该消毒剂的消毒效果能达到要求,能够用于使用环境日常的清洁消毒。
5.6
消毒剂对物体表面消毒效果验证5.6.1消毒剂对物体表面模拟现场鉴定试验
车间用于该消毒剂消毒的物体表面主要有不锈钢设备表面、地面、墙面以及呼吸袋,经过小试,将高浓度菌液(>
104cfu/ml)涂抹于不锈钢设备表面、地面、墙面及呼吸袋,选择回收率较高的载体作为物体表面消毒效果试验室部分的试验载体。
判断标准:
回收菌液浓度:
>
103cfu/ml。
(1)试验所需要用的试剂
中和剂:
活菌计数用培养基:
TSA培养基
消毒剂配制用水:
纯化水
(2)试验所需要用的仪器
刻度吸管、移液器、电动混匀器、计时器、培养箱、规格板(用不锈钢材料制备,中央留一
5.0cm×
5.0cm的空格作为采样部位)、无菌棉签、无菌接种环
(3)试验所需要用的菌种
本次试验主要是验证该消毒剂对物体表面微生物的消毒效果,故选择金黄色葡萄球菌、大肠埃希菌作为试验菌
(4)试验所需要用的消毒液的浓度及作用时间
0.2%的新洁尔灭消毒液作用30s
(5)试验所需要用到的场所
微生物实验室阳性间
(6)试验的操作步骤(以浓度为0.2%的消毒剂对金黄色葡萄球菌作用30s为例)
菌悬液:
浓度为5×
105cfu/ml-5×
106cfu/ml
试验组:
取大小合适的无菌呼吸袋作为试验样本,将无菌规格板按压在样本上,用无菌棉签沾以菌悬液均匀涂抹被试验表面的6区块(各区块25cm2)。
用0.2%的消毒剂对三个区块表面进行喷雾消毒,喷雾的距离约为10cm,以尽量使喷到样本上的雾粒大小和数量一致,消毒后,将无菌棉签在5ml的中和剂试管中沾湿,分别对3个消毒区块进行涂抹采样,每区块横竖往返各8次。
采样后以无菌操作方式将棉签剪入原中和剂试管中,电动混匀器上混匀20s,吸取1.0ml上述洗液,按活菌培养计数方法测定存活菌数,每管接种2个平皿,作为试验组,必要时进行稀释。
阳性对照组:
从6个区块中选取其他3个区块,用磷酸盐缓冲液代替消毒剂对三个区块表面同法操作,之后将无菌棉签在5ml的中和剂试管中沾湿,分别对3个区块进行涂抹采样,每区块横竖往返各8次。
采样后以无菌操作方式将棉签剪入原中和剂中,电动混匀器上混匀20s,吸取1.0ml上述洗液,按活菌培养计数法测定存活菌数,每管接种2个平皿,作为阳性对照组,必要时进行稀释。
阴性对照组:
用一只棉签,分别蘸取同批纯化水,以无菌方式将棉签采样端剪入0.1M硫代硫酸钠-生理盐水溶液中,在混匀器上震荡20s,做适当稀释后,按活菌培养计数方法测定存活菌数,每管接种2个平皿,作为阴性对照。
培养:
所有试验样本均在30-35℃培养箱中培养,培养48h观察最终结果。
(7)试验要求及计算
试验须重复三次,计算各组的活菌数(cfu/片),并换算为对数值(N),然后按计算公式杀灭对数值KL=对照组平均浓度的对数值(N0)-试验组活菌浓度对数值(NX)
(8)试验的判断标准
阴性对照组应无菌生长,阳性对照组菌数符合要求,所有样本的杀灭对数值均≥3.00,即判定结果合格。
在每升PBS缓冲液中加入10g组氨酸,50ml吐温80,5g卵磷脂,分装,121℃、15min压力蒸汽灭菌后备用。
误差率(%)=【(�三组均数-第三组回收菌落数�+�三组均数-第四组回收菌落数�+�三组均数-第五组回收菌落数�)÷
3】/三组均数*100%
6、再验证周期
6.1质量保证部根据验证结果确定再验证周期。
6.2当环境监控的结果出现偏差时,应重新评估目前使用的消毒剂,必要时更换消毒
剂的品种以及调整消毒剂的使用周期。
新消毒剂使用前均需经效果验证后方可使用。
4.验证结论
4.1验证完成之后,汇总所有检测数据,进行统计分析。
由验证部门起草验证报告,总结验证结论,并交由相关部门审核,批准。
4.2当检测数据满足下列规定时,方可认为验证合格:
4.3统计数据表明所有的检测数据均在规定的范围内;
4.4如果检测数据不符合规定标准,经偏差调查发现是由与验证人员无关的因素造成的,并经审核批准。
5.验证结果评价及建议
质量保证部负责收集各项验证、试验结果记录,根据验证、试验结果起草验证报告,报验证领导小组核对。
验证领导小组对验证结果进行综合评审,做出验证结论,发放验证证书,确认该再验证周期。
对验证结果的评审应包括:
(1)验证试验是否有遗漏。
(2)验证实施过程中对验证方案有无修改,修改原因、依据以及是否经过批准。
(3)验证记录是否完整。
(4)验证试验结果是否符合标准要求,偏差及对偏差的说明是否合理,是否需要进一步补充试验。
(1)75%乙醇:
适用于一般物体消毒以及手和皮肤的消毒。
它无法杀灭细菌芽胞和病毒。
本次验证方案主要对新洁尔灭、75%乙醇等消毒剂的杀灭效果和残留进行确认验证。
1.1.2消毒剂的使用要求
对于不同的消毒对象,应使用不同的消毒剂,并制定消毒程序,消毒程序中应明确规定:
(1)消毒剂的浓度及配制方法
(2)消毒剂的使用条件
(3)消毒使用的设备和设施
(4)消毒操作的详细步骤
(5)消毒周期
(6)消毒效果的检测方法
但是不能杀灭细菌芽胞,属于低效消毒剂。
制备消毒剂杀菌试验用细菌悬液与菌片,以供消毒剂杀菌试验时使用。
2.1.1.2.2试验器材
(1)菌种:
金黄色葡萄球菌ATCC6538、铜绿假单胞菌ATCC15442、大肠杆菌8099、枯草杆菌黑色变种ATCC9372、龟分枝杆菌脓肿亚种ATCC93326、白色葡萄球菌8032、白色念珠菌ATCC10231、黑曲霉菌ATCC16404。
在上述规定的菌株基础上,根据消毒剂特定用途或试验特殊需要,还可增选其他菌株。
(2)有机干扰物:
见附录A。
(3)磷酸盐缓冲液:
(4)无菌蒸馏水。
(5)稀释液:
(6)细菌培养基:
胰蛋白胨大豆琼脂培养基(TSA),胰蛋白胨大豆肉汤培养基(TSB)等,见附录A。
(7)革兰染色液:
(8)芽孢染色液:
(9)恒温水浴箱。
(10)玻璃漏斗。
(11)刻度吸管(1.0ml、5.0ml、10.0ml),毛细吸管。
(12)数字可调移液器(10μl,20μl,100μl,200μl,1000μl)及配套用一次性塑料吸头。
(13)离心机。
(14)电动混合器(15)浊度计。
2.1.1.2.3细菌悬液制备程序
(1)细菌繁殖体悬液的制备1)取冻干菌种管,在无菌操作下打开,以毛细吸管加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散。
取含5.0ml~10.0ml营养肉汤培养基试管,滴入少许菌种悬液,置37培养18h~24h。
用接种环取第1代培养的菌悬液,划线接种于营养琼脂培养基平板上,于37培养18h~24h。
挑取上述第2代培养物中典型菌落,接种于营养琼脂斜面,于37培养18h~24h,即为第3代培养物。
2)取菌种第3代~14代的营养琼脂培养基斜面新鲜培养物(18h~24h),用5.0ml吸管吸取3.0ml~5.0ml稀释液加入斜面试管内,反复吹吸,洗下菌苔。
随后,用5.0ml吸管将洗液移至另一无菌试管中,用电动混合器混合(振荡)20s,或在手掌上振敲80次,以使细菌悬浮均匀。
3)初步制成的菌悬液,先用细菌浓度比浊测定法粗测其含菌浓度,然后以稀释液稀释至所需使用的浓度。
4)细菌繁殖体悬液应保存在4冰箱内备用。
应当天使用不得过夜。
5)怀疑有污染时,应以菌落形态、革兰染色与生化试验等法进行鉴定。
(2)细菌芽孢悬液的制备1)取冻干菌种管,在无菌操作下打开,以毛细吸管吸加适量营养肉汤培养基,轻柔吹吸数次,使菌种融化分散。
取含5ml~10ml营养肉汤培养基试管,滴入少许菌种悬液,置37培养18h~24h。
用接种环取第1代培养的菌悬液,划线接种于营养琼脂培养基平板上,于37培养18h~24h。
挑取上述第代培养物中典型菌落,接种于营养肉汤培养基,于37培养18h~24h,即为第代培养物。
2)用10.0ml吸管吸取5.0ml~10.0ml养肉汤培养物,接种于罗氏瓶中营养琼脂培养基表面,将其摇动使菌液布满营养琼脂培养基的表面,再将多余肉汤培养物吸出,将罗氏瓶置于37温箱内,培养5d~7d。
3)用接种环取菌样少许涂于玻片上,固定后以改良芽孢染色法染色,并在显微镜(油镜)下进行镜检。
当芽孢形成率达95%以上时,即可进行以下处理。
否则,应继续在室温下放置一定时间,直至达到上述芽孢形成率后再进行以下处理。
改良芽孢染色法:
用接种环取菌样涂布于玻片上,待自然干燥。
而后通过火焰加热将菌固定于玻片上。
将涂片放入平皿内,片上放两层滤纸,滴加足量的0%孔雀绿水溶液。
将平皿盖好,放54~56条件下,加热30min。
取出,去滤纸,用自来水冲洗残留孔雀绿溶液。
加0.5%沙黄水溶液,染1min。
水洗,待干后镜检。
芽孢呈绿色,菌体呈红色。
4)罗氏瓶培养物,用10.0ml吸管加10.0ml无菌蒸馏水于每一罗氏瓶中,棒轻轻推刮下菌苔。
吸出第一批洗下的菌悬液,再向瓶内吸加5.0ml无菌蒸馏水,重复洗菌一遍。
将第一和第二批洗下的菌悬液集中于一含玻璃珠的无菌三角烧瓶中,振摇5min,打碎菌块,使成均匀的芽孢悬液。
5)必要时,将盛装菌悬液的三角烧瓶置45水浴中24h,使菌自溶断链,分散成单个芽孢。
6)用无菌棉花或纱布过滤芽孢悬液,清除其中的琼脂凝块。
7)将过滤后的芽孢悬液,置无菌离心管内,以3000r/min速度离心30min。
弃上清液,加蒸馏水吹吸使芽孢重新悬浮。
再离心和重新悬浮清洗,先后共38)将洗净的芽孢悬浮于三角烧瓶内蒸馏水中,并加入适量小玻璃珠。
9)将芽孢液放于80水浴中10min(或60,30min),以杀灭残余的细菌繁殖体。
待冷至室温后,保存于4冰箱中备用。
有效使用期为半年。
10)芽孢悬液在使用时,应先进行活菌培养计数。
11)怀疑有杂菌污染时,应以菌落形态、革兰染色与生化试验等法进行鉴定。
2.1.1.2.4菌片的制备程序
(1)消毒试验中使用的菌片是以菌液滴加于载体上制成。
载体应根据消毒对象选择,常用的有金属、玻璃、滤纸、线、棉布等。
根据其特点选择适宜材料载体作为代表。
载体可以为方形,大小为10mm10mm。
当以金属片为载体时,因方形金属载体在振敲时可将玻璃试管撞碎,故改用12mm直径圆形金属片(厚5mm)。
(2)所用载体(除滤纸片外)于染菌前,应进行脱脂处理。
脱脂方法如下:
将载体放在含洗涤剂的水中煮沸30min;
以自来水洗净;
用蒸馏水煮沸0min;
用蒸馏水漂洗至pH呈中性;
晾干、熨平备用。
(3)布片用白平纹棉布制作。
在剪开前,先将脱脂的布块按载体规定的大小,抽去边缘一周的经纬纱各一根,再按抽纱痕剪开。
此法制成的载体大小一致,且无毛边。
金属片以不锈钢制作,纸片以新华滤纸制作。
(4)载体经压力蒸汽灭菌后,使用滴染法染菌。
染菌用菌悬液:
使用TSB营养肉汤配制。
细菌繁殖体,可直接使用经18h~24h培养的斜面培养物,细菌芽孢可使用4冰箱贮存液。
含菌量约为1108cfu/ml~5108cfu/ml,可使用浊度计调整菌液浓度。
滴染法染菌时,将经灭菌的载体片平铺于无菌平皿内,逐片滴加菌液。
菌液滴加量每片为10μl。
用10μl移液器接灭菌塑料吸头滴染菌液,并用接种环涂匀整个载体表面。
滴染菌液后,染菌载体可置37温箱内干燥(约20min~30min),或置室温下自然阴干后再使用。
(5)每个菌片的回收菌数,按活菌培养计数所得结果,应为5105cfu/片~5106cfu/片。
2.1.1.2.5注意事项
(1)用浊度计测定的菌悬液浓度,只用于在滴染菌片时对菌悬液稀释度的估计。
作为菌悬液含菌浓度或菌片染菌量的正式报告(如杀菌试验中阳性对照组菌悬液或菌片所含菌量),必须以活菌培养计数的实测结果为准,不得使用根据比浊法判定的估计值。
(2)滴染时,菌液滴加量不宜过多,避免流散影响染菌的准确性。
(3)细菌繁殖体在烤干过程中,可引起部分死亡,如铜绿假单胞菌在37干燥过程中,滴度最高可下降1个对数值。
此时,应提高初始菌浓度,以便达到所需(4)配制菌悬液和制备菌片时,严格按无菌要求操作,以防污染杂菌,影响随后杀菌试验的结果。
(5)用带橡皮塞的容器保存菌液时,应将其预先煮沸10min进行脱硫处理。
(6)制得的菌悬液和菌片,用毕应随时放入冰箱内,尽量减少在室温下放置时间,以减少细菌的自然死亡。
高压蒸汽灭菌锅的使用方法与注意事项
一、高压蒸汽灭菌锅的使用方法
(1)在外层锅内加适量的水,使水面与三角搁架相平为宜,将需要灭菌的物品放入内层锅,盖好锅盖并对称地扭紧螺旋。
(2)加热使锅内产生蒸气,当压力表指针达到
0.5个大气帕时,打开排气阀,将冷空气排出,此时压力表指针下降,当指针下降至零时,即将排气阀关好。
(3)继续加热,锅内蒸气增加,压力表指针又上升,当锅内压力增加到所需压力(121℃)时,将火力减小,按所灭菌物品的特点,使蒸气压力维持所需压力一定时间(15-20min),然后将灭菌器断电,让其自然冷后再慢慢打开排气阀以排除余气,然后才能开盖取物。
二、高压蒸汽灭菌锅使用注意事项
(1)待灭菌的物品放置不宜过紧。
(2)必须将冷空气充分排除,否则锅内温度达不到规定温度,影响灭菌效果。
(3)灭菌完毕后,不可放气减压,否则瓶内液体会剧烈沸腾,冲掉瓶塞而外溢甚至导致容器爆裂。
须待灭菌器内压力降至与大气压相等后才可开盖。
压力蒸汽灭菌效果的监测
一、通用要求:
1.
对灭菌质量采用物理监测法、化学监测法和生物监测法进行。
2.
物理监测不合格的灭菌物品不得发放;
并应分析原因进行改进,直至监测结果符合要求。
3.
包外化学监测不合格的灭菌物品不得发放,包内化学监测不合格的灭菌物品不得使用。
4.
生物监测不合格时,应尽快召回上次生物监测合格以来所有尚未使用的灭菌物品,重新处理;
并应分析不合格的原因,改进后,生物监测连续三次合格后方可使用。
5.
灭菌植入性器械应每批次进行生物监测。
生物监测合格后,方可发放。
6.
按照灭菌装载物品的种类,可选择具有代表性的PCD进行灭菌效果的监测。
二、监测方法:
(一)压力蒸汽灭菌效果的监测
物理监测法:
每次灭菌应连续监测并记录灭菌时的温度、压力和时间等灭菌参数。
温度波动范围在+3°
C以内,时间满足最低灭菌时间的要求,同时应记录所有临界点的时间、温度与压力值,结果应符合灭菌的要求。
化学监测法:
(1)应进行包外、包内化学指示物监测。
具体要求为灭菌包包外应有化学指示物,高度危险性物品包内应放置包内化学指示物,置于最难灭菌的部位。
如果透过包装材料可直接观察包内化学指示物的颜色变化,则不必放臵包外化学指示物。
通过观察化学指示物颜色的变化,判定是否达到灭菌合格要求。
(2)采用快速压力蒸汽灭菌程序灭菌时,应直接将一片包内化学指示物臵于待灭菌物品旁边进行化学