无机物的分类及相互关系.doc
《无机物的分类及相互关系.doc》由会员分享,可在线阅读,更多相关《无机物的分类及相互关系.doc(7页珍藏版)》请在冰点文库上搜索。
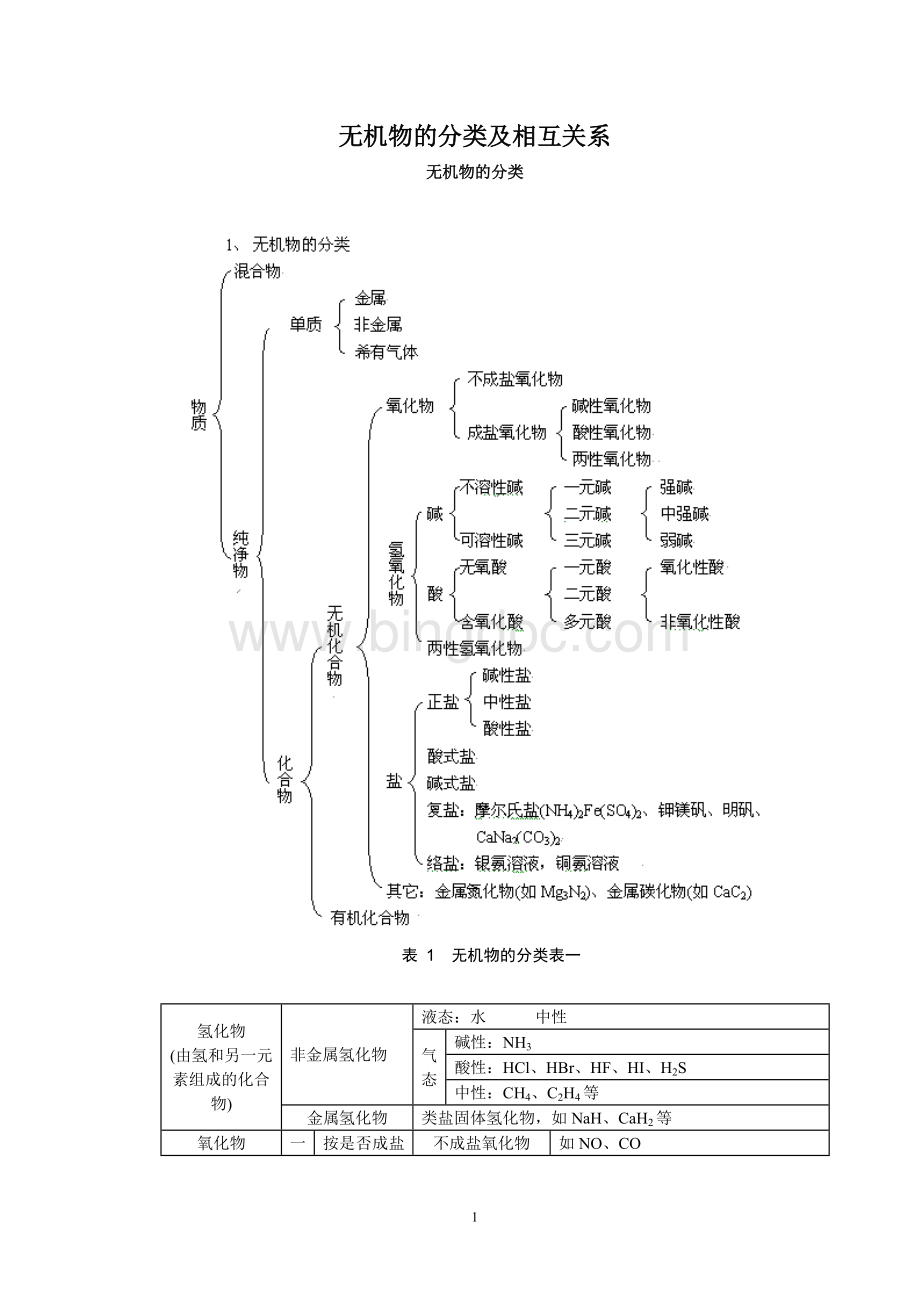
无机物的分类及相互关系
无机物的分类
表1无机物的分类表一
氢化物
(由氢和另一元素组成的化合物)
非金属氢化物
液态:
水中性
气态
碱性:
NH3
酸性:
HCl、HBr、HF、HI、H2S
中性:
CH4、C2H4等
金属氢化物
类盐固体氢化物,如NaH、CaH2等
氧化物
(由氧元素和另一元素组成的化合物,氧为-2价)
一般氧化物
按是否成盐分
不成盐氧化物
如NO、CO
成盐氧化物
酸性氧化物:
如SO2、P2O5
CrO3、Mn2O7等
两性氧化物:
如Al2O3、ZnO
碱性氧化物:
如Na2O、CaO等
按另一元素分
金属氧化物:
如K2O、Al2O3、Mn2O7等。
非金属氧化物:
如NO2、CO2等。
(注:
酸性氧化物不一定是非金属氧化物,两性氧化物和碱性氧化物一定是金属氧化物。
)
注:
过氧化物含有过氧链(O—O),氧为-2价,如H2O2、Na2O2等。
酸
(电离时所生成的阳离子全部都是氢离子的化合物)
含氧与否
无氧酸:
如盐酸、氢硫酸等。
含氧酸:
如硝酸、硫酸等。
电离程度
强酸:
如盐酸、硫酸等。
弱酸:
如碳酸、次氯酸等。
成酸元素有无氧化性
氧化性酸:
如硝酸、浓硫酸等。
非氧化性酸:
如磷酸、醋酸等。
可电离氢的多少
一元酸:
如盐酸、醋酸等。
二元酸:
如硫酸、碳酸等。
三元酸:
如磷酸。
有否挥发性
挥发性酸:
如硝酸、盐酸等。
难挥发性酸:
如硫酸、磷酸等。
碱
(电离时所生成的阴离子全部都是氢氧根离子的化合物)
溶解性
可溶性碱:
如氢氧化钠、氢氧化钾等。
难溶性碱:
如氢氧化铜、氢氧化铁等。
电离程度
强碱:
如氢氧化钡、氢氧化钠等。
弱碱:
如氨水、氢氧化亚铁等。
可电离的OH-数
一元碱:
如氨水、氢氧化钠等。
二元碱:
如氢氧化钡、氢氧化镁等。
三元碱:
如氢氧化铁。
盐
(由金属阳离子或铵根离子与酸根阴离子组成的化合物)
组成
一般盐
正盐:
如Na2SO4、Mg(NO3)2等。
酸式盐:
如NaHCO3、KH2PO4等。
碱式盐:
如Cu2(OH)2CO3。
复盐
KCl·MgCl2·6H2O(光卤石);(明矾)
K2SO4·Al2(SO4)3·24H2O或KAl(SO4)2·12H2O
络盐
Ag(NH3)2Cl、Cu(NH3)4SO4(铜氨溶液)
酸碱性
酸性盐
如NaHSO4、FeCl3、Cu(NO3)2等。
中性盐
如NaCl、KNO3、NH4Ac等。
碱性盐
如Na2CO3、KHCO3、(NH4)2CO3等。
水解与否
非水解盐
强酸强碱盐:
如NaCl、KNO3等。
水解盐
强酸弱碱盐:
如FeCl3、Cu(NO3)2等。
强碱弱酸盐:
如Na2CO3、KHCO3等。
弱酸弱碱盐:
如NH4Ac等。
表2无机物的分类表二
2、纯净物和混合物——分子
区别在于:
分子是否相同,组成是否固定,性质是否一定。
混合物分子不同,组成不一,各成分保持原有化学性质。
混合时无能量变化,一般可用机械法分离,是不纯物。
如铁粉和硫粉的混合物。
纯净物是相对纯的物质。
物质(根据物质的成分)
纯净物
[两同(由相同的分子构成,由同种物质组成)、两定(具有固定的组成,具有一定的性质,如熔点、沸点)]
化合物(由不同种元素形成)
根据是否含碳元素
无机化合物
有机化合物
根据化学键类型
离子化合物
共价化合物
根据其水溶液能否电离
非电解质(不电离)
电解质(能电离)
单质
(由同种元素形成)
金属单质
非金属单质
稀有气体单质
混合物
(无两同两定)
气态的:
空气、天然气、爆呜气、水煤气、煤气、焦炉煤气、裂解气、高炉煤气、NO2等。
液态的:
溶液、石油及其产物中的燃料油和润滑油、煤焦油、天然植物油、自来水、氯水、氨水、双氧水、王水、盐酸、氢硫酸、福尔马林、二甲苯、水玻璃、玻尔多液,等等。
固态的:
漂白粉、过磷酸钙、碱石灰、玻璃、水泥、钢铁、合金、煤、天然脂肪、黑火药、铝热剂、高分子,等等。
表3纯净物和混合物
焦炉煤气(H2、CH4及少量的CO、CO2、C2H4、N2等)、裂解气(C2H4、C3H6、C4H6及CH4、C2H6、H2、H2S等)、高炉煤气(CO、N2、CO2)。
注意:
(1)不能认为混合物必定含有多种分子式。
其实,一种分子式(即相同组成)也能形成混合物,如同分异构体。
(2)不能认为混合物必定是含有多种元素。
其实,一种元素也能形成混合物,如同素异形体。
如O2+O3,金刚石粉和石墨的混合物。
(3)结晶水合物是纯净物。
(4)空气是混合物,但组成基本一定。
(5)溶液的组成不固定,性质一样,组成均匀,但两种液体混合时常伴有体积、能量、颜色等的变化(物理化学变化),因而溶液是特殊的混合物。
(6)高分子化合物是链节相同、聚合度不同,即组成相同,而具有不同相对分子质量的物质的混合物。
(7)由于NO2与N2O4的平衡存在,故常说NO2的实际上是二者的混合物。
因此,要看题意来决定是否将它看成是纯净物还是混合物。
(8)二甲苯有三种:
对二甲苯、邻二甲苯、间二甲苯,其中对二甲苯是固体,其它二者是液体,由于很难将其分开,因此,平时所说的二甲苯实际上是三者的混合物。
题型:
具体物质的判断;抽象问题;溶解问题,计算问题。
例1:
下列化学式只表示一种纯净物的是(AD)
A.CH2Cl2B.CC.C2H4O2D.CsCl
解析:
B是同素异形体,C是同分异构体。
例2:
一瓶气体经分析,只含有一种元素,那么这瓶气体(CD)
A.一定是纯净物B.一定是混合物
C.不可能是化合物D.可能是纯净物,也可能是混合物
E.一定是单质
例3:
将3g某种白色粉末溶于沸水中,冷却到t℃,析出溶质(不含结晶水)2g;再将析出的2g粉末溶于同样多的沸水中,冷却到t℃时又析出溶质(不含结晶水)1.5g。
据此,可确定原白色粉末是(纯净物还是混合物),其理由是
。
答:
混合物。
若是纯净物,则在温度、溶剂相同条件下,前后两次所得饱和溶液所溶解溶质的质量应相等。
例4:
下列氮肥中属于混合物的是(C)
A.46.7%尿素B.35%硝铵C.21.2%氯化铵
D.17.7%碳铵E.21.2%(NH4)2SO4
3、单质和化合物:
元素的存在形态。
单质
化合物
形态
元素处于游离态
元素处于化合态,各组成元素失去游离态时的性质
组成
由同种元素组成(分子由同种元素的原子构成)
由不同种元素组成(分子由不同种元素的原子构成)
性质
一般不发生分解反应
一定条件下能分解(故化合物有热稳定性)
表4单质和化合物
4、盐、复盐和络盐
(1)盐的分类与盐的酸碱性不一致
酸式盐(组成分类)与酸性盐(溶液的酸碱性)
正盐的酸碱性由水解所致,酸式盐的酸碱性由电离与水解的相对强弱来确定。
一般来说,大多数酸式盐的水溶液显碱性。
(2)金属氮化物、金属碳化物是离子化合物,但不是盐。
Mg3N2+6H2O=3Mg(OH)2+2NH3
CaC2+2H2O=Ca(OH)2+C2H2
5、七类物质的相互关系
对于书写化学方程式来说,将物质分为七类为好:
金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
物质的相互关系即是物质的性质,即反应规律,要牢固掌握!
!
表5物质反应的相互关系表
注:
相互关系表有以下五个用途。
(1)表示物质间的纵横衍变关系,如从金属如何衍变成盐;
(2)表示16个基本反应规律;
(3)表示物质的性质;
(4)表示基本反应类型:
①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;
(5)表示物质(特别是盐)的制法。
其它反应规律
①碳酸(氢)盐的分解
②碳酸(氢)盐+酸
③铜与浓、稀硝酸、浓硫酸的反应
④硝酸盐的分解
⑤铵盐与碱反应
⑥不溶性碱的热分解
⑦酸式盐与正盐的互变规律
⑧盐类水解规律
⑨非金属与强碱溶液生成两种盐与水
6、基本反应类型:
分解、化合、置换、复分解反应。
注意:
分解一定是复杂的变成简单的物质吗?
化合一定是几种简单的物质生成一种复杂的物质吗?
4CuO2Cu2O+O2CO2+C2CO3HClO=2HCl+HClO3
另外,要注意下列两个反应都是化合反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,2FeCl3+Fe=3FeCl2
单质与氧化物间的置换反应:
(1)金属+金属氧化物
2Al+Fe2O3Al2O3+2Fe8Al+3Fe3O44Al2O3+9Fe
10Al+3V2O55Al2O3+6VMn+FeOMnO+Fe
(2)金属+非金属氧化物
2Mg+CO22MgO+C3Fe+4H2OFe3O4+4H2
(3)非金属+金属氧化物
C+2CuOCO2+CuH2+2CuOH2O+Cu
3H2+WO33H2O+CuC+FeOCO+Fe
Si+2FeOSiO2+2Fe
(4)非金属+非金属氧化物
C+H2OCO+H22F2+2H2O=4HF+O2
7、反应规律的条件限制
(1)强强易,弱弱难,不强不弱居中间。
①酸+碱
②氧化剂+还原剂
③酸+碱性氧化物
④碱+酸性氧化物
⑤酸性氧化物+碱性氧化物
⑥金属+非金属
(2)溶易,不溶难。
①碱性氧化物+水
②酸性氧化物+水
(3)弱弱易、强强难。
①盐类水解
②非金属+非金属
(4)复分解反应
酸、碱强度不太弱,中和成水能发生。
两个界线:
Al(OH)3+H2CO3≠,H3AlO3+NH3·H2O≠。
酸盐反应酸要溶,强代弱来稳代分;难挥发代易挥发,盐若沉淀也发生。
例外:
CuSO4+H2S=CuS+H2SO4
AgCl+HNO3≠,BaSO4+HNO3≠,BaSO4+HCl≠,
盐盐、盐碱皆要溶,生成沉淀才发生。
盐(溶)+碱(溶)=盐¯+碱,或:
盐(溶)+碱(溶)=盐¯+碱¯
盐(溶)+盐(溶)=盐¯+盐
(5)置换反应溶或熔,活动顺序强代弱。
例:
为了确认CH3COOH、H2CO3和H4SiO4的酸性强弱,有人设计用下图所示装置,一次达到目的(不能再选用其它酸性溶液)。
(1)锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂是____________;
(2)装置B中所盛试剂的名称是___________,装置B中所盛试剂的作用是__________;
(3)装置C中出现的现象是______________________
_______________________________。
解:
(1)CH3COOH或乙酸或醋酸
(2)饱和碳酸氢钠溶液;除去A中生成的CO2中混有的杂质CH3COOH(3)产生白色胶状沉淀
7