钒化合物性质Word下载.docx
《钒化合物性质Word下载.docx》由会员分享,可在线阅读,更多相关《钒化合物性质Word下载.docx(20页珍藏版)》请在冰点文库上搜索。
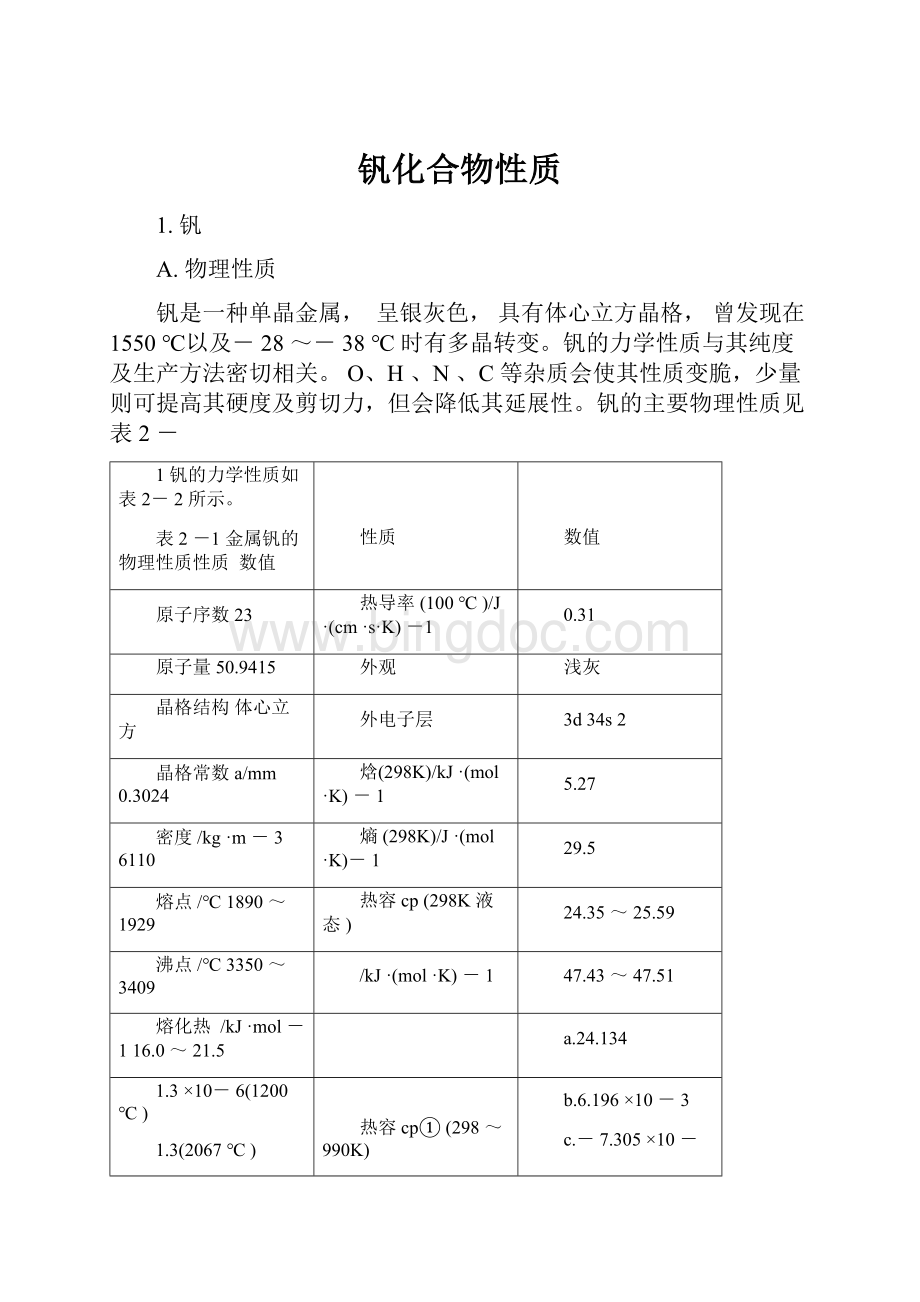
c.-7.305×
10-
线膨胀系数
(20~200℃)/K-1
(7.88~9.7)×
10-6
K)-1b.-1.25×
10-4
c.4.08×
比电阻(20℃)
/μΩc·
m
24.8温度系数(100℃)/cm·
K-10.0034
钒同位素46V47V48V49V50V51V52V53V54V
半衰期
0.426
s
33min
16.0
d
330d6×
1015a稳定3.75min2.0min55s
丰度/%0.2599.75
①cp=a+bT+cT2+dT-2;
②cp=a+bT+cT2,式中,T为温度,K。
表2-2金属钒的力学性质
工业纯品
高纯品
抗拉强度σb/MPa245~450
210~250
180
延展性/%10~15
40~60
40
维氏硬度HV/MPa80~150
60
60~70
弹性模量/GPa137~147
120~130
泊松比0.35
0.36
屈服强度/MPa125~180
B.钒的化学性质
由图2-1可见,钒在周期表中位于第4周期、VB族,属于过渡金属元素中的高熔点
元素,包括Ti、Zr、Hf、V、Nb、Ta、Cr、Mo、W、Re等10个元素。
它们的特点是:
具有很高的熔点,例如钨的熔点是3180℃,钼的熔点是2610℃,它们主要是用作合金的添加剂,有些也可以单独使用,其中某些金属在高温下具有抗氧化性、高硬度、高耐磨性。
但这
些金属的力学性质与其纯度和制备方法密切相关,少量的晶间杂质,会使其硬度和强度明显提高,但却使其延展性下降。
在原子结构方面,这些元素的外电子层具有相同的电子数,一
般有两个电子(少数是一个电子),而在次外电子层的电子数目则依次递增,其化学性质介
于典型金属与弱典型金属之间,处于过渡状态,具有彼此相互接近的性质,其共同的特点是:
图2-1高熔点元素在周期表中的位置
(1)这些元素外电子层的电子比较稳定,但较易失去次外电子层的电子,而形成不同
价态的离子,例如钒可以形成-1、+2、+3、+4、+5的价态,而Ti则可以形成+2、+3、+4的价态。
图2-2所示为钒原子核的结构图;
图2-2钒原子核的结构图(质子数P=23,中子数N=28)
(2)这些元素按其顺序,次外电子层的电子数目依次增加,由于电子的静电引力作用,遂使原子的半径也渐趋缩小;
(3)这些元素的水溶液,由于电子的转移作用形成的光谱,都会使其离子呈现颜色,只有少数例外;
(4)这些元素会形成硼化物、碳化物、氮化物、氢化物,它们多数都具有金属性质,只有少数例外。
钒在空气中250℃以下是稳定的,呈浅银灰色,有良好的可塑性和可锻性。
长期保存表面会呈现蓝灰、黑橙色,超过300℃会有明显的氧化。
超过500℃,钒吸附氢于晶格间隙,使其变得易脆,易成粉末。
真空下600~700℃加热,氢可逸出。
低温下存在氢化物VH。
钒在400℃开始吸收氮气,800℃以上钒与氮反应生成氮化钒,在高真空、1700~2000℃下,发生氮化钒的分解,但是氮不可能完全从金属中释出。
钒对碳有较高亲和力,800~1000℃下可形成碳化物。
钒对稀硫酸、稀盐酸、稀磷酸保持相对稳定。
但在硝酸、氟氢酸中溶解。
金属钒对自来
水抗蚀性良好,对海水抗蚀性中等,但未出现点腐蚀。
钒能抗10%NaOH溶液腐蚀,但不能抗热KOH溶液的腐蚀。
钒及其合金对低熔点金属或合金的熔融体有良好的抗蚀性,特别
是碱金属(它们在核反应堆中用作冷却剂或热交换介质)。
表2-3为钒的抗腐蚀性能。
表2-3钒对某些介质的抗腐蚀性能
10%H2SO4(沸)
0.055
20.5(70℃)
钒板
30%H2SO4(沸)
0.251
10%HCl(沸)
0.318
25.4(70℃)
17%HCl(沸)
溶液
腐蚀速度
1.974
(35℃)/μm·
a-1
腐蚀速度(60℃)/μm·
a-1
材料
4.8%H2SO4
15.2
53.3
3.6%HCl
48.3
20.2%HCl
132
899
3.1%HNO3
25.4
1100
11.8%HNO3
68.6
88390
10%H3PO4
10.2
45.7
85%H3PO4
160
钒的化合物从广义上来说,可以包括化学化合物、晶间化合物、金属间物、取代基合金等。
这种区分主要是基于化学键的性质和晶体结构。
通常,化学化合物指的是一类化合价态比较明确的化台物,对钒而言,就是价态在+2~+5之间的化合物。
钒的价态或氧化态决定该化合物的性质,即使其物理性质也与它的价态密切相差。
例如+5价钒是抗磁性的,形成的化合物常为无色或淡黄色;
而低价钒则为顺磁性的,有颜色,存钒原子的第三能级(M
电子层)中,有一个或多个电子处于游离状态,这些未配合的电子,在游离过程中产生的光谱,即呈现为不同的颜色。
许多具有实际应用的钒化合物,是一类晶隙间化台物,如钒的碳化物、氮化物、硅化物等,这类含钒的化合物,作为添加剂在合金中可以起到细化晶粒的作用,以获取优异的性质。
但它们并无确切的价态,而不是真正意义上的化合物。
这一章里我们侧重介绍的是有确切价态的化台物。
C.钒氧化物,氢氧化物的性质
常见的钒氧化物为+2、+3、+4、+5价的氧化物:
VO、V2O3、VO2、V2O5,钒的氧化物从低价(二价)到高价(五价),系强还原荆到强氧化剂,其水溶液由强碱性逐渐变
成弱酸性。
其间的关系如图2-3所示。
图2-3不同价态钒氧化物间的关系
低价氧化钒不溶于水,但遇强酸会形成强酸盐如VCl2、VSO4;
如遇强碱则形成V(OH)2,
V(OH)2水解会放出H2。
低价氧化钒在空气中易被氧化成高价氧化钒,反之,五价氧化钒则可借还原性气体还原成四、三、二价的氧化钒。
它们的物理与化学性质以及热力学性质等,
见表2-4、表2-5和表2-6。
钒氧的系统相图,见图2-4。
从这个相图中可以看出,除
VO外,其他的氧化物都有一个明确的相变点,其中还包括多个氧化物构成的配合物;
而
VO则系没有明确的化学计量的配合物,故有多个假稳态点,系统相当复杂。
表2-4钒氧化物的性质
性质VO
V2O3
VO2
V2O4
V2O5
晶系面心立方
菱形
单斜
α
斜方
颜色浅灰
黑
深蓝
橙黄
5550~576
4870~499
4330~433
3352~336
m-3
9
1970~207
1545~196
熔点/℃1790
650~690
7
1690~175
分解温度/℃
生成热ΔH298/kJ·
mol-1-432
-1219.6
-718
-1428
-1551
绝对熵S298/J·
K)-138.91
98.8
62.62
102.6
131
自由能ΔG298/kJ·
mol-1-404.4
-1140.0
-659.4
-1319
-1420
水溶性无
无
微
酸溶性溶
HF、HNO3
溶
碱溶性无
氧化还原性还原
还原
两性
氧化
酸碱性碱
碱
表2-5
钒氧化物的热容
化合物
V2O5
cp/kJ·
128.2
适用温度T/K
298
表2-6钒氧化物的标准生成自由能,
ΔG=A+BT
反应式
A/kJ·
mol-1
V(s)+1/2O2(g)=VO(s)
-412.8
0.0817
298~2000
2V(s)+3/2O2(g)=V2O3(s)
-1220
0.2364
600~2000
2V(s)+2O2(g)=V2O4(β)
-1402
0.3066
600~1818
6V(s)+13/2O2(g)=V6O13(s)
-4368.4
1.0042
600~1000
2V(s)+5/2O2(g)=V2O5(s)
-1554.6
0.4224
298~943
图2-4钒氧系相图
2.五氧化二钒
V2O5,是钒氧化物中最重要的,也是最常用钒化工制品。
工业上首先是制取NH4VO3,然后加热至500℃,即可制得V2O5。
其反应如下:
2NH4VO3→2NH3+H2O+V2O5
另一个方法是用VOCl3水解,反应如下:
2VOCl3+3H2O=V2O5+6HCl
V2O5是原子缺失型半导体,其中的缺失型是V4+离子,在700~1125℃,V2O5存在下列可逆反应:
V2O5=V2O5-x+(x/2)O2
式中,x随温度的升高而增大,此一性质使其呈现为催化性质。
V2O5微溶于水,溶解度在
0.01~0.08g/L,大小取决于其前期生成的历史。
如果是自水溶液中沉淀生成的,则其溶解
度会大些。
V2O5是两性化合物,但其碱性弱,酸性强,易溶于碱性构成钒酸盐,强酸也能溶解V2O5。
在酸、碱溶液中,生成物的形态取决于溶液的钒浓度和pH值,当溶液处于强碱性,pH值大于13,则会以单倍体VO43-存在;
若处于强酸性溶液中(pH值小于3),而且钒浓度较低时(小于10-4mol/L),则主要以VO2+存在,如果钒的浓度较高(大于50×
10-3mol/L),则析出固相V2O5;
如果处在中间pH值的状态,则会以下列配合物存在:
VO3-、HVO42-、V3O93-、V4O124-、V10O286-、V2O74-;
当pH=1.8时,V2O5的溶解度最小,约为2.2mmol/L。
为此,在酸性条件下沉钒时,多选择在pH值为1.8左右,如图2—5所示。
图2-5水溶液中五价钒离子的形态与钒浓度及pH值的关系
3.二氧化钒与四氧化二钒
VO2或V2O4的制备方法如下:
V2O5在600℃于回转窑中,在硫、碳或含碳物如糖、草
酸等气氛下,缓慢还原可得。
四价钒在空气中被缓慢氧化,加热则快速被氧化;
四价钒的氧
化物也是两性物质,在热酸中溶解形成稳定的VO2+,例如与硫酸形成VOSO4;
在碱性溶液中则形成次钒酸盐HV2O5-,而次钒酸H2V4O9或H2O·
4VO2,是一种异聚酸,它是M(II)V4O9·
7H2O的配合物。
4.三氧化二钒
V2O3的制备:
可用H2、C等还原剂,还原V2O5制得。
例如,将H2气加入少许水蒸气
(每1LH2加水蒸气48~130mg),在600~650℃下通过V2O5,其反应如下:
V2O5+2H2=V2O3+2H2O
通常V2O5含有VN杂质,加入水蒸气是为了脱出杂质中的N2,其反应如下:
2VN+3H2O=V2O3+3H2+N2
V2O3的熔点高,在空气中不易氧化,但Cl2可使其迅速氧化,形成VOCl3,其反应如
下:
3V2O3+6Cl2=V2O5+4VOCl3
三价钒化合物不溶于水,能缓慢溶解于酸,形成V3+;
三价钒化合物是良好的催化剂,用于加氢反应,而且它不会受有机硫化物的毒害。
5.一氧化钒
VO可在1700℃下用H2气还原V2O5制得,也可以在真空下用V2O3加金属V制得。
在钒的氧化物中,随氧含量的降低,其中的金属-金属键增加,从图2-4的钒氧系相图中可以看出,一氧化钒是非化学剂量化合物,而具有广泛的非均一性范围,它具有NaCl缺陷性结构。
精品资料
6.钒的过氧化物
偏钒酸盐的非酸性水溶液,加入双氧水会生成过氧化钒酸盐,例如偏钒酸铵会生成过氧化钒酸铵,可认为系过氧化钒酸(H4V2O10)与铵离子NH4+形成的盐,但是过氧化钒酸不会在水中游离存在。
在酸性水溶液中,双氧水会与钒离子形成砖红色配合物,这是个敏感反应,可用在钒浓度极低时的定性试验。
7.氢氧化钒
三价的钒可以在碱性或氨性溶液中形成绿色V(OH)3沉淀,它在空气中易氧化;
二价的钒盐,加碱也会形成V(OH)2沉淀,但不稳定,迅即氧化。
8.钒酸
钒的含氧酸在水溶液中形成钒酸根阴离子或钒氧基离子,它能以多种聚集态存在,使之形成各种组成的钒氧化合物,其性质对钒的生产极为重要。
钒酸的存在形式基本上与两个因素有关。
一个是溶液的酸度,另一个是钒酸盐的浓度。
在高碱度下,主要以正钒酸根VO43-存在,当水溶液逐渐酸化时,其钒酸根会发生一系列水解作用。
当钒的浓度很低时,例如小于1mmol/L,在各种pH值条件下均以单核存在。
但钒酸根有很强的聚合性能,当质子化的钒酸根浓度升高时,会发生一系列聚合作用。
此种性质亦随pH值降低而加强。
以上性质大致如图2-7所示。
从图中可以看出,从碱性或弱碱性溶液析出的钒酸盐是
正钒酸盐或焦钒酸盐。
当溶液接近中性时,析出的是四聚V4O124-或三聚体V3O93-;
当溶
液呈弱酸性或酸性时,析出的是多聚钒酸盐,如V10O286-。
图3-7钒酸水溶液酌状态与钒浓度及pH值的关系(25qC):
’51
40℃,pH值为2~8,钒酸存在的主要形式是V3O3-、V4O124-、HV6O173-、HV10O285
-。
当pH值降低到2以下时,十钒酸盐会变成十二钒酸盐,其反应如下:
6H6V10O28=5H2V12O31+13H2O
研究证明,水合V2O5就是H2V12O31的多聚体,其中的质子可被其他金属正离子取代,取代的顺序如下:
K+>NH4+>Na+>H+>Li+
当含钒溶液的酸度增加到pH<3,特别是pH<1时,多聚体会受到质子的破坏,而呈
VO2+形式存在,其反应如下:
H2V12O31+12H+=12VO2++7H2O
钒酸根离子也能与其他酸根离子,如钨、磷、砷、硅等的酸根生成复盐,这也就构成钒酸盐杂质的来源之一。
9.五价钒酸盐
钒酸盐中含有五价钒的有偏钒酸盐、正钒酸盐、焦钒酸盐以及多钒酸盐。
偏钒酸盐是最稳定的,其次是焦钒酸盐,而正钒酸盐是比较少的,即使在温度较低的情况下,也会迅速水
解,转化为焦钒酸盐,以钒酸钠为例,其反应如下:
2Na3VO4+H2O=Na4V2O7+2NaOH
而在沸腾的溶液中,焦钒酸盐又会转化为偏钒酸盐,其反应如下:
Na4V2O7+H2O=2NaVO3+2NaOH
但是焦钒酸铵是不存在的,当把氯化铵加入到焦钒酸钠溶液中时,得到的则是偏钒酸铵
沉淀,其反应如下:
4NH4Cl+Na4V2O7=2NH4VO3+4NaCl+2NH3+H2O
偏钒酸盐:
碱金属的氢氧化物与V2O5作用,则可得到碱金属的偏钒酸盐;
其他金属的可溶
性盐与碱金属钒酸盐的中性溶液作用,即可按复分解反应而制得该金属的钒酸盐。
偏钒酸盐溶液加入氯化铵,即可制得偏钒酸铵,其反应如下:
NH4Cl+NaVO3=NH4VO3+NaCl
偏钒酸铵是最普通的钒酸盐,为白色结晶,若不纯则略呈黄色,微溶于水和乙醇,在空气中灼烧,最终分解产物为V2O5,其反应如下:
2NH4V03=V205+2NH3+HzO
此外还有V3O3-和V4O124-,是偏钒酸根的三、四聚体,再有就是十钒酸根V10O284-,
实为正钒酸根的十聚体。
大多数金属离子都能与这些钒酸根结合,包括碱土金属、重金属、
贱金属、贵金属等,如:
Bi、Ca、Cd、Cr、Co、Cu、Fe、Mg、Mn、Mo、Ni、Ag、Sn、Zn,此类盐在水中的溶解度都比较低,均可用水溶液沉淀法制取(也可用金属氧化物与钒
氧化物在高温下熔融制取)。
某些金属的五价钒酸盐的性质,见表表3-7五价钒酸盐的物理及化学性质
化合物分子式状态
3-7。
熔点/℃
水溶性
①
②
③
偏钒酸HVO3黄色垢状/固
溶于酸碱
200(分
-
140.
偏钒酸铵NH4VO3淡黄色/固④
解)
微溶于水
1051
-886
113.
偏钒酸钠NaVO3无色/固/单斜晶体
630
溶于水
1145
8
1064
水溶液⑤
108.
1129
1046
偏钒酸钾
KVO3
固
溶于热水
850~
190.
无色/固/六方晶系
856
1756
1
1637
Na3VO4
正钒酸钠
1685
180.
NaH2VO4
1407
1284
632~
318.
焦钒酸钠
Na4V2O7
654
2917
6
2720
179.
偏钒酸钙
CaV2O6
778
2330
2
2170
220.
焦钒酸钙
Ca2V2O7
1015
3083
2893
275.
正钒酸钙
Ca3V2O8
1380
3778
3561
偏钒酸铁
FeV2O6
1899
1750
焦钒酸铅
Pb2V2O7
722
2133
1946
正钒酸铅
Pb3V2O8
960
23752161
偏钒酸镁MgV2O6固
2201
160.
2039
焦钒酸镁Mg2V2O7固710
2836
200.
5
2645
偏钒酸锰MnV2O6
2000
1849
①:
ΔH298/kJ·
mol-1②:
ΔS298/J·
(mol·
K)-1③:
ΔG298/kJ·
mol-1
④:
密度为2326kg/m3⑤:
浓度小于1mol/LNa2O-V2O5-H2O系