化学反应器设计.ppt
《化学反应器设计.ppt》由会员分享,可在线阅读,更多相关《化学反应器设计.ppt(71页珍藏版)》请在冰点文库上搜索。
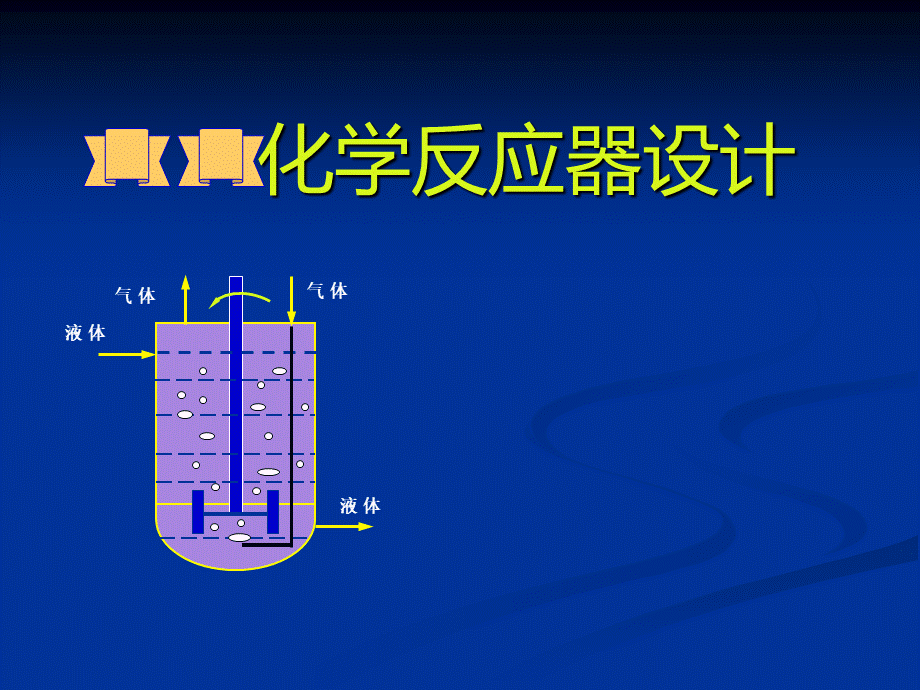
化学反应器设计,气体,气体,液体,液体,一、课程性质、目的与任务化学反应器是化工工艺过程的核心,是工程设计和工业生产操作的关键。
通过本课程的学习,使学生了解几种典型反应器的基本特点,掌握反应器的基本设计原则和计算方法,并能结合具体反应过程进行反应器的工程分析和设计计算,为从事反应过程的工程设计和实际工业反应器的优化操作奠定基础。
二、教学基本内容与基本要求本课程详细地阐述了釜式、管式、流化床等反应器的基本特点、基本设计原则和计算方法;反应器的结构及强度设计、刚度设计、外压容器的稳定性及设计等内容。
学生能够根据具体反应过程进行反应器的工程分析和设计计,算,为以后的实际工作和科研工作打下坚实的基础。
第一章绪论本章要求:
一、了解化学反应器的三种操作方式和特点。
二、了解化学反应器的主要类型、结构和工作原理。
化工产品、医药产品(化学合成)、石油炼制、能源加工等工业过程,均采用化学方法将原料加工成为有用的产品。
生产过程包括如下三个组成部分:
第一、三两部分属于单元操作的研究范围;第二部分是化学反应工程的研究对象,是生产过程的核心。
原料预处理过程(物理、化学处理),化学加工过程(物质转化),反应产物分离、提纯(物理处理),目的产物,副产物,原料,未反应原料,图1.1典型的化学加工过程,1.1化学反应工程1、化学反应工程的研究对象化学反应工程是化学工程学科的一个重要分支,主要包括两个方面的内容,即反应动力学和反应器设计分析。
反应动力学-研究化学反应进行的机理和速率,以获得工业反应器设计与操作所需的动力学知识和信息,如反应模式、速率方程及反应活化能等,其中速率方程可表示为:
对于一定的反应物系而言,r随时间、空间变化。
其中,r为反应系统中某一组分的反应速率,代表浓度的矢量,P为系统的总压。
反应器设计-研究反应器内上述因素的变化规律,找出最优工况和适宜的反应器型式和尺寸。
注意:
化学反应是研究反应本身的规律,与反应器内各局部的状况有关。
所以可以说反应动力学从点上着眼,反应器的设计与分析则从面上(体上)着手。
2、化学反应的分类(反应工程学科)无论是自然界还是实际生产过程中,存在各种各样的化学反应,通常为了便于研究和应用,将化学反应进行分类。
下表中给出了常见的化学反应分类、方法和种类,一些可能同时属于两个或者更多的反应种类。
例如:
为气一固催化反应3、反应过程的举例一般来说反应过程包括:
物理现象-传递现象(热量、动量和能量传递过程)化学现象-化学反应概括为“三传一反”。
例如:
对于反应过程,实际的反应过程可能包括:
反应物、产物的扩散过程(内外)+表面反应过程无论对于放热过程,还是吸热过程,催化剂与反应物气体存在温差。
对整个反应器而言,如反应器内的浓度和温度随位置变化,需将化学反应与传递现象综合起来考虑。
4、化学反应工程的作用对于化学产品和加工过程的开发、反应器的设计、放大起着重要的作用。
运用化学反应工程知识可以:
提高反应器的放大倍数,减少试验次数和开发周期。
对现有反应装置操作工况进行优化,提高生产效率、开发环境优良的绿色生产路线和工艺。
5、反应器的操作方式间歇操作反应器、半间歇半连续操作反应器、连续操作反应器。
1.2化学反应器的类型反应器的类型很多,按工作原理来分,反应器可分为以下几种类型。
液体,气体,液体,气体,气体,气体,气体,液体,液体,
(1)管式反应器特点:
反应器的长度远大于内径、且内部无零部件。
应用范围:
多用于均相反应过程。
(2)釜式反应器特点:
高度与直径比约为2-3内设搅拌装置和档板。
应用范围:
均相、多相反应过程均可。
(3)塔式反应器特点:
高度远大于直径,内部设有填料、塔板等以提高相互接触面积。
管式反应器,釜式反应器,液体,气体,气体,应用范围:
用于多相反应过程。
气体,气体,气体,气体,气体,液体,液体,液体,液体,液体,液体,填料塔反应器,喷雾塔反应器,板式塔反应器,液体,气体,(4)固定床反应器特点:
底层内部装有不动的固体颗粒,固体颗粒可以是催化剂或是反应物。
应用范围:
用于多相反应系统。
(5)流化床反应器特点:
反应过程中反应器内部有固体颗粒的悬浮和循环运动,提高反应器内液体的混合性能。
应用范围:
多相反应体系,可以提高传热速率。
气体,固定床鼓泡反应器,流化床反应器,液体,固体,(6)移动床反应器特点:
固体颗粒自上而下作定向移动与反应流体逆向接触。
应用范围:
用于多相体系,催化剂可以连续再生。
(7)滴流床反应器特点:
是固定反应器的一种,但反应物还包括气液两种。
应用范围:
属于固定床的一种,用于使用固体催化剂的气液反应过程。
液体,气体,液体,气体,移动床反应器,固体,滴流床反应器,气体,气体,(8)交流磁场流化床反应器特点:
床内的固体颗粒在交流磁场作用下做旋转运动,进入床内液体中的离子在交流磁场中做不规则的螺旋运动,可以极大地提高反应速率。
应用范围:
用于多相体系。
液体,液体,线圈,床体,磁性颗粒,筛板,磁场流化床反应器,第二章釜式反应器本章要求:
一、熟练掌握等温间歇釜式反应器反应时间和体积的计算(单一反应、平行与连串反应);二、熟练掌握连续釜式反应器反应时间和体积的计算;三、掌握连续釜式反应器的串联和并联;四、掌握釜式反应器中平行与连串反应选择性的分析,连接和加料方式的选择;五、了解串联釜式反应器最佳体积的求取方法;反应器设计的任务是确定进行化学反应的最佳操作条件和完成规定的生产任务所需的反应器体积和主要尺寸。
2.1釜式反应器的物料衡算方程反应器设计的基本内容:
选择合适的反应器类型、确定最佳操作条件、计算完成规定的生产任务所需的反应器体积(尺寸)基本方程:
物料衡算-描述浓度的变化规律能量衡算-描述温度的变化规律,动量衡算-描述压力的变化情况注意:
首先要选择控制体如果反应器内各处浓度均一,衡算的控制体选择整个反应器。
如果反应区内存在两个或两个以上相态,反应体积内各点的反应物料组成未必相同,这时只能选择微元体积作为控制体。
对于复杂反应,方程数将大大增多。
2.2等温间歇釜式反应器的计算(单一反应),特点:
分批装、卸;适用于不同品种和规格的产品的生产,广泛用于精细化工产品、医药、助剂等生产。
整个操作时间=反应时间+辅助时间(装+卸+清洗)一、反应时间和体积的计算A关键组分(单一反应)或(复杂反应),若整个反应器中浓度均一,将整个反应器作为控制体,那么根据物料衡算方程,有:
初值条件为:
该式可用于均相、多相,等温或非等温过程。
对于间歇反应器,由于,若为均相则(否则不行),设反应速率方程为(不可逆反应),则,在等温下有:
当温度T时,反应速率常数k,导致达到规定转化率所用的反应时间t。
对于可逆放热反应,是上面的结论仍然正确吗?
注意:
(单位时间内处理的反应物料的体积)有关,两者关系为:
实际的反应器体积为:
对于沸腾或易发泡液体物料:
对于一般流体:
二、最优反应时间对于间歇釜式反应器,总反应时间可以表示为:
当反应时间时,但。
而且比值不总是增加的,存在最优值。
如果将目标函数定义为:
那么通过求解,2.3等温间歇釜式反应的计算(复合反应)一、平行反应在等温间歇反应器中,设进行的反应为一级平行反应:
P为目的产物根据物料衡算可以得到:
其中只有两个独立反应。
对于均相,恒容过程方程进一步变为:
设初值条件为:
,则方程的解为:
将代入恒容过程方程有:
反应物系的组成随时间的变化关系如图2-1所示,由图可见,由于两个反应均是一级由于产物P是目的产物,图2-1组成随时间的变化关系希望k1k2。
二、连串反应设在等温间歇反应器中进行如下的连串反应:
假设反应均为一级,根据物料衡算得到:
设初值条件为:
首先可以解出:
将该式带入方程,有:
解方程得:
反应物系组成随时间的变化关系如图2-2所示,如果P,是目的产物,其值有最优解。
通过对时间求导,可以得到:
如果,则:
图2-2连串反应组成随时间的变化关系2.4连续釜式反应器的反应体积,间歇釜:
各参数随时间变化,一次装、卸料;连续釜式反应器:
基本在定态下操作,有进有出。
一、连续釜式反应器的特点:
反应器的参数不随时间变化,不存在时间自变量,也没有空间自变量,多用于液相反应,恒容操作出口处的C、T反应器内的C、T相同。
根据物料衡算方程得:
最后得到连续釜式反应器的计算方程为:
图2-3连续釜式反应器,对于恒容过程,有,即,由此得到:
注意:
反应器内C、T恒定,不随时间变化,也不随位置变化。
所以其内的在各点处相同,不随时间变化等速反应器。
当同时进行多个反应时,只要进、出口组成和QO已知,就可以针对一个组分求出反应体积Vr二、两个重要的物理量空时、空速
(1)空时衡量生产能力(只针对连续反应器而言)其定义为:
,生产能力(比较时QO应在相同的T,P下求得,即在同一基准下进行比较),生产能力。
dV=0的过程,=,即物料在反应器内的停留时间等于空时。
(2)空速单位反应体积、单位时间内所处理的物料量可表示为空时的倒数,即:
s时,生产能力。
为了便于比较,通常采用“标准情况下的体积流量”。
对于有固体催化剂参与的反应,用催化剂空速(往往以催化剂质量或体积衡量)。
2.5连续釜式反应器的串联与并联,实际生产中,常常遇到使用多个釜式反应器的问题。
那如何将这些反应器联接起来使用呢?
计算方程为:
图2-4连续釜式反应器体积的几何图示,A,B,D,F,E,H,K,XA1,XA2,XA,O,-1/RA,-1/RA,O,XA1,XA2,G,M,N,F,XA,L,正常动力学,反常动力学,从图中看出,对于正常动力学,多釜串联有利;对于反常动力学,则使用单釜有利,如使用多釜,采用并联的方式。
对于釜式反应器的并联,如图所示。
操作中有分配加入每个反应器中物料量的分配按下列方法进行。
通常可以采取,这时整个反应系统最优。
即要:
这时有,图2-5并联的釜式反应器,一、串联釜式反应器的计算假设N个串联的釜式反应器如下图所示。
可以通过对每个釜进行物料衡算,得到系统的计算方程。
现在针对一级不可逆反应进行计算(针对其它级数反应的计算方法相同),动力学方程为:
假定每个釜的体积相同,即,那么每一个釜的空时相同,如果反应器中的温,图2-6串联的釜式反应器,1,2,p,N,Vr1,Vr2,度T相同(保证k一样),针对第p个釜进行物料衡算,有整理后得到其中,将每一个釜的衡算方程相乘,得到,整个系统的空时为:
,总的反应体积为:
对于非一级反应,没有解析解,需要进行逐釜计算。
根据已知条件,可以将逐釜计算过程分成如下两种。
(1)已知每一个单釜的体积此时每个釜的空时已知,逐一计算出或,直至求出到达所需的釜数N。
(2)已知釜数N需要先假设空时,按的方法逐釜计算出第N个釜出口的转化率,并与要求的转化率对比,如果不一致需要重新假设空时,重复进行计算,直到两者吻合。
二、串联釜式反应器各釜的最佳反应体积优化的目标函数为:
对于级反应,得到的结论为:
2.5釜式反应器中复合反应的收率和选择性对于复杂反应,目的产物的收率和选择性是非常重要的,反映了原料的有效利用程度。
收率和选择性与反应器的型式,操作方式和操作条件密切相关。
瞬时收率的定义:
其中,的物理意义是生成1mol的目的产物P要消耗A的mol数。
应该注意:
瞬时收率可能随时间变化,间歇反应器就是一例。
对于连续反应器(在定态下操作),瞬时选择性不随时间变化,但可能随位置变化,这时要用到总收率,其定义,为:
是总收率,针对整个反应器而言的。
如果用S0表示总选择性(对整个反应而言),那么讨论:
(1)XA时,S的情形对于间歇釜式反应器:
=整个曲边梯形的积分面积,图2-7釜式反应器的最终收率,对于连续釜式反应器:
=矩形的面积从图中可以看出,多釜串联系统介于间歇釜式反应器和连续釜式反应器之间,即:
(2)对于XA时,S的情况结果恰恰与上面的相反一、平行反应的选择性设在釜式反应器中进行平行反应:
图2-8釜式反应器的最终收率,假设P为目的产物,则瞬时选择性为:
反应组分A和B的浓度CA、CB,以及温度T均对选择性S有影响。
可以根据和的相对大小,选择适当的反应组分浓度和温度,来提高反应的选择性S。
反应器中各组分的浓度与反应器型式、操作方式、加料浓度、原料配比,以及加料方式等因素密切相关。
二、串联反应的选择性(均为一级反应),假设P为目的产物,则瞬时选择性为:
三、釜式反应器的加料方式,
(1)要求选择间歇釜或多釜串联(如果体积不等,从小到大排列)
(2)要求选择单釜连续操作,如果串联最好从大小排列,活塞流,A,B,CA高、CB高,A,B,CA低、CB低,CA高、CB高,A,B,(3)要求另外,要得到较高的生产强度,反应过程需要在较高的温度下进行。
当或时,温度高对过程有利;但当时,虽然温度低有利于选择性的提高,但应尽能使反应在较高的温度下进行,实际上存在一个最佳温度值。
二、连串反应,CA、CB,活塞流,A,CA高、CB低,B,CA高、CB低,B,B,B,A,假设如下的连串反应均为一级,P为目的产物在等温间歇反应器中,可以得到最佳反应时间为:
目的产物P的最佳收率为:
在连续釜式反应器进行上述连串反应,最佳空时(不是反应时间)和最佳收率的确定。
根据物料衡算式,有:
产物P的收率为:
由导数得:
最佳收率为:
目的产物收率与组成的关系可以表示为:
当k1=k2时,对于间歇釜式反应器,则有:
间歇釜式反应器和连续釜式反应器性能的差别。
在相同条件下,应该特别关注最大收率的轨迹线。
应该注意:
可以通过改变操作温度的办法来改变k2/k1的相对大小,但无论E2和E1相对大小如何,一般采用较高的反应温度,以提高反应器的生产程度。
图2-9反应率和收率的比较,2.6变温间歇釜式反应器间歇釜式反应器做到等温操作很困难,当热效应小时,近似等温可以办到,如果热效应大时,很难做到。
温度会影响到和反应器的生产强度等,很多情况变温的效果更好。
热量恒算:
+=对于恒容过程有:
将其代入热量衡算式得:
上式通常称为操作方程,若物料的定容比热随温度的变化较明显,则采用其平均值。
联立和热量衡算式可求解出反应时间。
2.7绝热间歇釜式反应器在反应过程中无热量交换,故有:
对于恒容过程有:
根据初始条件:
将上式积分得:
注意:
式中的是指反应物料的起始转化率,若原始反应物料中不含产物,则:
若=常数,则温度与转化率成线性关系,即:
2.8连续釜式反应器(CSTR)的定态操作一、CSTR的物料衡算连续釜式反应器内物料的温度和浓度均一。
若达到定态操作,T,C不再随时间变化,此时CSTR内的T和C不随位置变化,也不随时间变化,T和C为定值。
CSTR的定态点,由操作的T和C由物料平衡和热量平衡确定。
CSTR的物料平衡式为:
二、CSTR的热量衡算式若忽略流体的密度和定压比热随温度的变化,CSTR在定常状态下工作时,热量衡算式为:
+-=0,当CSTR无换热面的绝热条件下,则:
联立下列三式:
可确定CSTR的容积、传热面积或反应温度、流体入口温度。
三、CSTR的热稳定分析反应器内的传热与物理换热过程明显不同,反应器内移出的热量是反应的放热量,反应的放热速率与反应温度的,关系基本上由阿累尼乌斯公式()控制。
而反应器内的移热速率与反应温度的关系则呈线性关系。
因此,在反应器内放热速率线与移热速率线可能相交时可能不只是一个交点,即出现多个定常操作态。
有些定常操作态具有抗外界干扰的能力,即在外界干扰下使其偏离原来的定常态,而系统本身具有抑制这种使其发生偏离的干扰的能力,外界干扰消失可以自动恢复原来的定常态。
此类定常态称之为稳定的定常态。
反之,称之为不稳定的定常态。
将热量衡算式:
改写成下列形式:
令:
,,反应器内放热速率;反应器内移热速率对于n级不可逆放热反应有:
式中是反应温度的函数,由釜式反应器设计方程求得。
为简单起见,仅讨论n=1的场合。
一级不可逆反应的设计方程为:
应用上式将对温度T作图可得下图(图中绿色曲线)。
图2-10和的关系当温度T很大时,上式中的可以忽略,其渐近线如图中红线。
应用将对温度T作图可得一直线,其斜率为,截距为。
T,1,2,3,4,5,线的讨论:
提高反应物料的初始温度To和冷却液温度Tm,截距增大,线将向T增大的方向移动。
增大反应器内的换热面积A或传热系数U,斜率增大,线将向T减小的方向移动。
在定常操作态时应满足:
,但并非是线性关系,因此,满足条件的定常态不只一个。
如图2-10中与有三个交点(2,3,4),即反应器在此状态下操作可能有三种定常操作点。
但只有2,4两点具有抗外界干扰的能力。
因为外界干扰导致反应温度产生的温度波动有两种情况:
0时,有,因此它有能力使系统温度下降而恢复原来的状态。
0时,有,因此它有能力使系统温度回升到原来的温度。
3点不具有抗外界干扰的能力。
因为当0时,有,将使系统温度上升,使操作点向4点移动,直至达到4点的操作态。
反之,当0时,操作点向2点移动,直至达到2点的操作态。
因此,可以通过改变操作变量实现CSTR在稳定的定常态下操作。
四、CSTR热稳定性的判据所有处于稳定的定常态点均具有一共同特征,在这些点处有:
对于n级不可逆反应有:
近似地将视为不随温度T改变,则有:
由此可得n级不可逆反应的稳定条件为:
对于无换热面得绝热操作(A=0),则有:
1,第三章管式反应器管式反应器也是一类理想反应器模型(活塞流模型)。
与间歇釜式反应器不同,全混流和活塞流模型用于流动过程。
本章将涉及到如下的具体内容:
一、活塞流模型的基本假定二、等温管式反应器设计与分析三、管式反应器与釜式反应器的性能比较四、循环管式反应器的分析计算五、管式反应器的变温操作流体流动是非常复杂的物理现象,影响到系统的反应速率和转化程度。
3.1流动状况对反应过程的影响流体在空管中流动的状态见图3-1。
内部各部分流体的停留时间不同,因此反应时间也不一样,反应速率和最终转化率也不一样。
层流,图3.1空管中流体状况,湍流,活塞流,3.2等温管式反应器的设计一、管式反应器的物料衡算式在管式反应器中进行的单一反应,取如图3-2所示的微元体(高为dZ)。
在定态条件下:
图3-2管式反应器示意图,dZ,假设=常数(=下的值),则:
对于恒容过程,将上式进一步变形为:
管式反应器的设计方程注意:
管式反应器与釜式反应器的设计方程尽管形式上相同,但一个是反应时间t,一个空时(与所选择的进口状态有关)。
另外,间歇釜式反应器总是恒容的。
如果管式反应器也在恒容下进行,则有=t;否则,t。
对于物料衡算式,设反应器的截面积为A,则有,那么:
对于恒容过程,则:
二、管式与釜式反应器反应体积的比较在处理量、组成、T、XAf相同的条件下进行对比。
对于不可逆等温反应,使用不同形式的理想反应器时所需要的反应体积如图3-3所示。
对于正常动力学反应:
管式反应器与间歇釜式反应器的体积最小;连续釜式反应器的体积最大;多釜串联釜式反应器的体积居中。
对于反常动力学反应:
管式反应器与间歇釜式反应器的体积最大;连续釜式反应器的体积最小;多釜串联釜式,图3-3理想反应器体积示意图,反应器的体积居中。
三、管式反应器的热量衡算式管式反应器的热量衡算见图3-4,由于温度沿轴线方向是变化的,因此在管内取一段容积为dV的微元为研究对象。
在定态条件下有:
(单位时间内dV微元与外界的换热量)=(单位时间内通过dV微元的反应混合物的焓变),图3-4热量衡算示意图,数学表达式(操作方程)为:
在上式中:
为dV微元与外界的换热量;为进入dV微元的反应物从To加热到T的焓变;为出dV微元的反应物从To至T+dT的焓变;为反应物在To下由入口此微元的物料组成到出口此微元的物料组成所发生的焓变。
当时,热量衡算式可简化为:
若在dT区间随温度的变化可忽略,则直接应用温度为的T定压比热值,上式又可简化为:
上述热量衡算的三种表达式,即为变温操作的操作方程。
将其与设计方程联立求解可得物料组成与温度沿管内轴线上的分布。
其计算方法如下,首先将设计方程和操作方程写成差分的形式,对于可写成:
操作方程可写成:
根据上述操作方程逐段进行计算,过程如下:
从第n段的出口组成和温度的值来计算;用的值,取步长由计算出增量,将其代入操作方程计算出。
传热推动力近似用;然后分别用下式求出(n+1)段出口的组成和温度的近似值;由近似算出的值计算出,然后取算术平均值,来重新计算,在计算时应采用来代替计算温差,而;重复的步骤直至得到满意的收敛的为止;用最后得到的值重复的步骤进行n+1段的计算,如此逐段计算直至满足所要求的出口转化率为止,,反应器的长度为。
若采用等步长,则反应器的长度为。
3.3循环管式反应器对于很多反应过程,如合成氨、合成甲醇等过程,由于化学平衡的限制,单程转化率并不高,为了提高原料的利用率,将出口(含有大量的反应物)的物料进行循环。
根据物料衡算式有:
是反应器进口处无产物的关键组分A的摩尔流率。
它与的关系如下:
在定常状态下有:
若以为循环比:
将、代入物料衡算式有:
上式为活塞流的设计方程。
对于一级不可逆反应代入上式得,积分后得:
当时,(活塞流)当时,应用洛必塔法则得上式极限值为:
(全混合流),3.4变温管式反应器(自学)3.5绝热管式反应器(自学),