水的电离知识详细讲解.docx
《水的电离知识详细讲解.docx》由会员分享,可在线阅读,更多相关《水的电离知识详细讲解.docx(23页珍藏版)》请在冰点文库上搜索。
水的电离知识详细讲解
水的电离
(一)水的电离
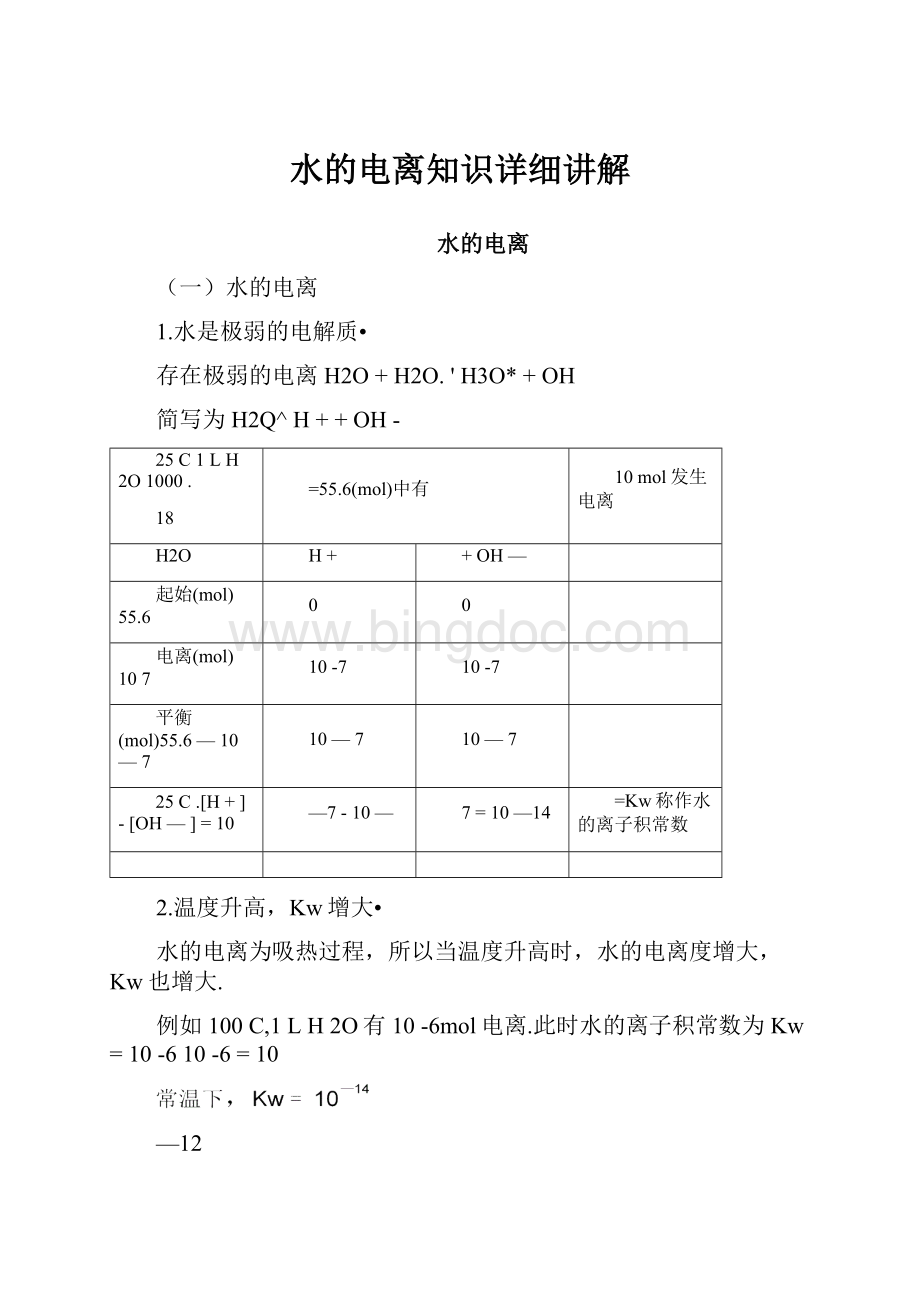
1.水是极弱的电解质•
存在极弱的电离H2O+H2O.'H3O*+OH
简写为H2Q^H++OH-
25C1LH2O1000.
18
=55.6(mol)中有
10mol发生电离
H2O
H+
+OH—
起始(mol)55.6
0
0
电离(mol)107
10-7
10-7
平衡(mol)55.6—10—7
10—7
10—7
25C.[H+]-[OH—]=10
—7-10—
7=10—14
=Kw称作水的离子积常数
2.温度升高,Kw增大•
水的电离为吸热过程,所以当温度升高时,水的电离度增大,Kw也增大.
例如100C,1LH2O有10-6mol电离.此时水的离子积常数为Kw=10-610-6=10
—12
3.在中性、酸性、碱性稀溶液中Kw的讨论•
凡是在水溶液中,都存在着水的电离平衡.H2O二H++OH—,H+和OH—总是同时存在的.
(1)中性溶液中,Kw=[H+]-[OH—]=10—7-10—7=10
(2)酸性溶液中,
[OH—]=10—14.
(3)碱性溶液中,[OH]=1014.
由于[H+]增大,水的电离平衡逆向移动,[OH]减小,但Kw=[H+]-
由于[OH]增大,水的电离平衡逆向移动.[H+]减小,但Kw=[H+]-
结论:
常温下,[H+]-[OH—]=10—14=Kw,适于纯水冲性、酸性、碱性稀溶液
4.根据Kw计算溶液中的[HJ或[OH—]
由于水电离出来的H+或OH—很少,所以在酸(或碱)溶液中,一般就以酸(或碱)的浓度计
算出[H「或([OH—]),然后根据Kw再计算溶液中的[OH—](或[H+])
(1)酸溶液:
强酸完全电离,[H+]Kwf—
弱酸部分电离丄[H+]=C一[H]—[H]
(2)碱溶液
+
=[H]
强碱完全电离亠[OH—]IKw
弱碱部分电离a[OH—]=cj[OH]
(二)溶液的酸碱性和pH值
1.溶液的pH值-ig[H+]=pH.[H+]=10-pH
2.溶液的酸碱性与pH值关系
(1)纯水和中性溶液
[H+]=10-7mol/l.
pH=—lg10-7=—(-7)=7
⑵酸性溶液例如0.01mol/l盐酸
[H+]=10-2mol/l
pH=-lg102=-(-2)=2
(3)碱性溶液例如0.01mol/l烧碱溶液
[OH-]=10-2mol/l
+1014-12
[H+]=2=1012mol/l
10
pH=-lg1012=12
3.pH值取值围与[H+]对照关系
[H+]:
10010-110-210-310-410-510-610-710-810-910-1010-1110-1210-1310
-14
pH
14
012
34
5
67
8
91011
1213
溶液酸碱性
酸性增强
中性
碱性增强
(1)pHV7溶液酸性,pH=7溶液中性,pH>7溶液碱性.
(2)pH增大1,[H+]减小10倍,[OH-]增大10倍;pH减小1,[H+]增大10倍,[OH-]减小10倍•
(3)当[H+]>1,pHV0或[H+]V10-14,pH>14直接用物质的量浓度而不用PH值表示.
4.溶液的酸、碱性、PH值与离子积常数小结
溶液酸碱性
[H+](mol/l)
[OH-](mol/l)
[H+]与[OH-]比较
PH值
25°C[H+]-[OH-]
酸性
>10T
V10-7
[H+]>[OH-]
V7
10-14
中性
=10-7
=10-7
[H+]=[OH-]
=7
碱性
V10-7
>10-7
[H+]V[OH-]
>7
(三)pH值的计算
1.基本计算公式
C:
一元酸(碱)的物质的量浓度
[H+卜[OH-]:
溶液中的H+浓度、OH-的浓度:
弱酸或弱碱的电离度
强酸:
C亠+]务屮
pH
弱酸
弱碱
全部电离
部分电离C
C[H+]..-pH
[H]
Kw
c
部分电离-E肓
C[OH「[H+]..-■pH
[OH]
(四)酸碱指示剂
1.酸碱指示剂及变色围
指示剂
pH值围及显示颜色
^石丿蕊
V5
5〜8
>8
红
紫
蓝
酚酞
V8
8〜10
>10
无
浅红
红
甲基橙
V3.1
3.1〜4.4
>4.4
红
橙
黄
2.pH试纸的使用
把待测试液滴在pH试纸上,试纸所显示的颜色与标准比色板(pH值1〜14)相比,确定溶
液的pH值.
3.pH计可精确测定溶液的pH值
三、重点、难点剖析
有关pH值及其计算是本节难点
(一)有关pH值的问与答
1.为什么要引进pH值概念?
答:
当[H+]很小时,用物质的量浓度表示溶液的酸碱性很不方便
2.什么是溶液的pH值?
答:
采用[H+]的负对数表示溶液酸碱性的强弱,叫做溶液的pH值.pH=-lg[H+]
3.溶液的酸碱性与PH值有什么关系?
答:
常温下纯水和中性溶液中[H+]=10-7mol/l,因此,当pH=7为中性;pHV7为酸
性,pH值越小,溶液酸性越强;pH>7为碱性,pH值越大,溶液碱性越强.
4.是否对任意浓度的[H+]或[OH-]用pH值表示溶液的酸碱性均方便?
答:
pH值一般是用来表示稀的酸性、碱性和中性溶液的酸碱性的.当pH值小于0时,一般直接用H+物质的量浓度表示酸性强弱较为方便;当pH值大于14时,一般直接用0H-物质的量浓度表示其碱性强弱较为方便.
5.pH值小于7,溶液一定为酸性吗?
答:
由于水的电离受到温度的影响,故不能简单地认为pHV7时,溶液一定是酸性.例如
100C时,Kw=10-12,pH=6为中性.则pHV6才是酸性.
若不注明温度,一般认为是常温(25C)就以pHV6溶液为酸性•
6.用试纸检验气体的酸碱性必须先将试纸湿润,那么检验溶液的pH值是否也须将PH
试纸湿润呢?
答:
用pH试纸来测定溶液的pH值是定量测定其酸碱度•可用洁净的干玻璃棒直接蘸取少许待测液,滴在pH试纸上,将试纸显示的颜色随即与标准比色板对照•
注意不能将试纸先用水湿润或用湿玻璃棒,这样相当于将溶液稀释了,导致测定的pH值
不准确•
(二)有关pH值的计算
1.强碱、强碱溶液的pH值:
⑴酸:
先求出[H+],pH=-lg[H+]
碱:
必先求出[OH-],再利用Kw求出[H+],即[H+]=上也,再求其PH值•
[OH]
(2)对于碱性溶液求pH值,可先求出POH,即POH=-lg[OH-],
•/常温下[H+]•[OH-]=10-14,A—|g[H+]—lg[OH-]=14.
•••pH=14—POH,这样计算pH值较为简便•
例10CCa(OH)2溶解度为0.185g,假设饱和溶液=1g/cm3,水的离子积Kw=10
-14,求此溶液pH值•
0.185
解CCa(OH)2=
1000
[OH-]=0.025X2=0.05mol/L
POH=-lg0.05=2—lg5=2—0.7=1.3
pH=14—1.3=12.7.
2.弱酸、弱碱溶液的PH值:
利用电离度求出弱酸的[H+]即[H+]=C或弱碱的[OH-].即[OH-]=C,再求其pH值
例225C时,0.1mol/L某弱酸电离度为1%,求此溶液的PH值.
解[H+]=C=0.1X1%=10-3mol/L
pH=-lg10-3=-(-3)=3
3.强酸、强碱溶液稀释后的PH值.
(1)酸:
以稀释后[H+]变化计算
碱:
以稀释后[OH-]变化计算,再求[H+].
(2)强酸稀释10n倍,pH值增大n个单位,强碱稀释10n倍,pH值减少n个单位.
(3)高度稀释
以酸溶液为例:
溶液中H+不仅来自酸的电离,还来自水的电离平衡.一般情况下,酸电离出的[H+]要比水电离出的[H+]大得多,水的电离可忽略不计.
但是,当稀释的倍数很大,酸电离出的[H十]或碱电离出的[OH-]接近或小于水电离出的[H+]或[OH-]时,就应当考虑水的电离.由此得如下结论:
酸:
pH值接近于7但小于7.
碱:
pH值接近于7但大于7.
例3①pH=13的NaOH溶液稀释100倍后.pH=.
解POH=—lg[OH]稀释=—lg101•102=—lg103=3
pH=14—3=11
常见错误:
pH=—lg[HJ稀释=—lg10—13•10—2=15
分析越稀释,碱溶液的pH值越大,显然不合理.在强碱溶液中,[OH—]随稀释时体积的变化而变化是决定pH值的主要因素.而[H+]是水电离产生,其电离平衡在稀释时发生移
动•
②将pH=5的盐酸溶液稀释1000倍后,溶液的pH值接近但小于7.
见3③关于高度稀释问题的分析.
常见错误:
[H+]=1X10—5•10—3=10-8mol/L
pH=—lg10—8=8
照此结果,酸溶液稀释成了碱溶液,不可能.
例4100mol水PH值由7变为4,应加入0.1mol盐酸多少ml?
(精确至0.1)
解析本题实为盐酸的稀释,应有稀释前后盐酸中H+物质的量不变.(稀溶液p~
1g/cm3).
设:
应加0.1mol盐酸xml.
0.1x•1=(100+x)•1•10—4
x=0.1mL
4.两强酸稀溶液混合后及两强碱稀溶液混合后溶液的PH值
1混合后总体积可近似看作两者体积之和.
酸:
先算出混合后溶液的[H+].再求PH值.
碱:
先算出混合后溶液的[OH—]
2混和前后酸溶液的H+物质的量不变
[H+]1V1+[H+]2V2=[H+]混合•(V1+V2)混和前后碱溶液的OH—物质的量不变
[OH—]1V1+[OH—]2V2=[OH—]混和•(V1+V2)注意不可以:
pH1+pH2=pH3
例5计算下列混合溶液的PH值
1pH=2和pH=5的两盐酸等体积混合.
2pH=8和pH=13的两氢氧化钠溶液等体积混合.
解①设两溶液体积均为vL.
+i102V105V.—3,”
[H]混合==5X10mol/L.
2V
pH=—lg[H+]混合=—lg(5X10—3)=2.3
解②pH=8的碱溶液中[OH—]=10—6mol/L.pH=13的碱溶液中[OH—]=10
1mol/L.
10V10V—2
[OH]混合==5X10mol/L.
V
POH=—lg[OH]混合=—lg(5X102)=1.3
pH=14—POH=14—1.3=12.7
常见错误:
1—8
pH=—lg(—X10—8)=8.3.
再次提醒:
两强碱溶液混合,应先计算[OH—]混合.由例5得如下小结:
(4)两强酸或两强碱溶液等体积混合,快速选择溶液PH值偏强的一边两酸等体积混和pH混合=pH小+0.3
偏强的一边,但PH值增大0.3
两碱等体积混和pH混合=pH大一0.3
偏强的一边,但pH值减小0.3
+0.3
丄酸
5.强酸和强碱混合,发生中和反应.
若恰好完全中和,则混和溶液pH=7;若酸有剩余,则计算剩余的[H+],求出pH值;若碱有剩余,应先计算剩余的[OH-],再求pH值.
例6pH=1的盐酸50ml和pH=13的NaOH溶液49mL混合后.求PH值.解pH=1[H+]=0.1mol/L,pH=13[OH一]=0.1mol/L
H++OH—=出0
50X0.149X0.1酸过量
pH=3
例7pH=3的强酸与pH=12的强碱溶液混和后,溶液pH=10,则强酸与强碱溶液的
体积比为
解设酸、碱溶液体积各为x、y,已知pH=10,碱过量.
23
410x10y
[OH]余=104=
xy
10—2y—10—4y=10—3x+10—4x.
10
10
1.110
四、典型例题
例8⑴有A、B两种溶液,PH值各为1.8与4.8,则A的[H+]是B的[H+]的
倍•
(2)某温度下,纯水中的[H+]=2X10-7mo|/|,则此时[OH一]=2X10_7mol/L.若温度不变,滴入稀硫酸使[H+]=5X10-6mol/L,则[OH一]=8X10-9mol/L,由水电离出[H+]为8X10—9mol/L.该纯水的PH值V7.(填〉、v、=)
解析
纯水中H2O=H++OH一
mol/L2X10一72X10一7
Kw
加酸后,水的电离平衡逆向移动,使[OH—]减小,可由Kw、[HJ求出[OH—],此温度下
[OH—]=4106=8X10—9mol/L.
5106
由水电离出的[H+]=[OH—]=8X10—9mol/L该温度下,pH=—lg2X10—7=7—lg2V7.
例925C时,等体积H2SO4溶液和NaOH溶液混合后,溶液呈碱性.则混合前H2SO4溶液的pH值和NaOH溶液的pH值之间应满足的关系是
A.pH酸+pH碱〉14B.pH酸+pH碱V13
C.pH酸+pH碱=14D.pH酸+pH碱=13
解析本题选项A.
假定H2SO4与NaOH恰好中和,溶液呈中性,设H2SO4溶液PH=x,NaOH溶液PH=y.体积均为V,则酸溶液的[H+]=10—xmol/L,碱溶液的[OH—]=10—(14—y).
[H+]酸•V=[OH—]碱•V
10—x=10—(14—y)
—x=—14+y
x+y=14.
但溶液呈碱性,即pH碱〉y
二pH酸+pH碱〉14.
例10某地酸雨经检测除H+和OH—外,还有[Na+]=7X10—6、[Cl—]=3.5X10—5
[NH4+]=2.3X10—5、[SO42—]=2.5X10—6(单位均mol/L).则该酸雨的PH值是
A.3B.4C.5D.6
解析本题选项C.
在电解质溶液中,阳离子所带正电荷总和一定等于阴离子所带负电荷总和.即电荷平衡
原理,则有
阳离子物质的量X阴离子的电荷数=阴离子物质的量X阴离子的电荷数
由题意,得[Na+]+[NH4+]+[H+]=[Cl—]+2[SO42—]+[OH—]将题中数据代入得
7X106+2.3X105+[H+]=3.5X105+2X2.5X106+[OH]
[H+]=1X10—5+[OH—]
•/酸雨中,[0H_]v10_7mol/L,[OH一]忽略不计.
•••[H+]=10-5mol/l.pH=5
例11氢氧化钠溶液和氨水的PH值均为12,且体积相同.下列叙述正确的是
A.温度升高10C,两者的PH值仍相等.
B.温度不变,分别加水稀释100倍,PH值都变为10
C.各加入同浓度的盐酸,使酸碱恰好中和,两者消耗的盐酸体积相同•
D.分别加入足量的FeCl3溶液,前者产生的沉淀比后者少•解析本题选项D.
A.NaOH是强电解质、NH3・出0是弱电解质,温度升高.NH3-H20电离度增大,其[0H-]=C也增大,故氨水PH值较大•
B.均加水稀释100倍,使[0H-]减小,但随着溶液变稀,NH3-H2O电离度增大•故氨水PH值虽减小,但大于10.
C.
•因为Cnh3h20
Na0H和NH3•H20与HCI的中和能力是比较它们物质的量的大小
=,v1.可知同PH值、同体积的两种碱溶液中,NH3-H20物质的量大于Na0H物
质的量,故氨水消耗的盐酸体积大•
D.同C项,由于Na0H物质的量小于NH3•出0物质的量.所以Na0H与FeCl3生成
的Fe(0H)3沉淀少.
例12某溶液中若滴入甲基橙变为黄色,若滴入石蕊显红色.若滴入酚酞不变色,求该溶
液PH值围.
解析PH值为4.4〜5的围
甲基橙变黄:
PH>4.4,石蕊变红;PHV5,酚酞不变色:
PHV8.作图如下,可知图中共公区
域为溶液PH值围4.4〜5.
酚酞.仍无色
4.4
pH®
、选择题(每小题有1至2个正确选项)
1.将pH=10和pH=13的两强碱溶液等体积混合,混合溶液的
A.10.3B.11.5
2.把99.5ml0.2mol/LNaOH液pH
C.12.7D.13.3
溶液加到100.5mL0.1mol/LH
3.
4.
+]最
值是()
A.3B.3.3
将pH=3的某未知酸溶液稀释
A.等于5B.大于5
将pH值为8的NaOH溶液与
C.4D.2.7
100倍,所得溶液的pH值(
C.小于5
pH值为10的
5.
6.
接近于()
A.(10-8+10一10)/2mol/L
C.(10-8+10一10)mol/L
健康的人的血液pH值为7.35〜则此时血液中氢离子溶度为健康人的
A.1.35〜1.45倍
C.106倍
下列溶液中酸性最强的是()
A.[H+]=10-4mol/L
C.pH=10
PH值是()
2SO4溶液中,所得溶
)
5或小于5
D.等于
NaOH溶液等体积混合后,溶液中[H
x10-10mol/L
x10-14-5x10―5)mol/L
B.2
D.(1
7.45,患某种疾病的人血液的pH值可暂降至6.0,
()
B.10
D.100
1.35〜101.45倍倍
B.[0H
D.pH
-]=10-14
=1
7.将一定浓度的NaOH溶液加水稀释,其pH值与加水的体积
(V)的关系是()
8.0.01mol/L盐酸中,酸电离出的[H+]是水电离出的[H「的(
A.10倍
9.将
1升,
取
A.
B.100倍C.10―10倍
10mL0.21mol/L盐酸和10mL0.10mol/LBa(OH)
)
D.1010倍
2溶液混合,再加水稀释至
10mL滴入甲基橙试剂,溶液所呈的颜色是()
蓝色B.红色
10.重水(D2O)在某温度时的离子积常数
C.橙色
Kw=1.6
D.黄色
x10-15,下列有关POD(即一lg[D+])
述正确的是()
A.该温度下D2O的PD是7.0
B.该温度下1LD2O中溶解0.01molNaOD
C.将50ml0.2mol/l的NaOD重水溶液加到
时,PD是12
100ml0.25mol/lDCl
重水溶液中
度的
应后PD=1.0.
D.该温度下1升D2O中溶解0.01molDCl
11.中和相同体积,相同pH值的H2SO4、HCl、
NaOH
溶液的体积依次为V1、V2、V3,则V1、V2、
A.V1=V2=V3B.V1=V2vV3
12.有两瓶pH=2的酸溶液,一瓶是强酸、
A.石蕊试液和水
C.pH试纸和水
13.向稀硫酸溶液中逐渐通入氨气,当溶液中[NH4+
A.大于7B.小于7C.等于7
14.下列四种溶液中,由水电离生成的氢离子浓度之比
①pH=0的盐酸
③0.01mol/L的NaOH溶液
A.1:
10:
100:
1000
时,PD=2.0
CH3COOH三种稀溶液时,用去同种浓
V3的大小关系正确的是()
C.V1=V2>V3D.V1VV2vV3
一瓶是弱酸,可用于鉴别的一组试剂是(B.酚酞试液和水
D.石蕊试液和酚酞试液
]=2[SO42一]时,溶液的pH值(
D.无法判断
(①:
②:
③:
④)是()
的盐酸
的NaOH溶液
②0.1mol/L
④pH=11
B.0:
1:
12:
11
C.14:
13:
12:
11
15.25C时一某溶液中由水电离出的
D.14:
13:
2:
3
[H+]=1X10—12mol/L,向该溶液中滴入几滴甲基
试液后,溶液的颜色可能变为(
A.橙色B.红色
16.在一定温度下,某酸溶液中水的电离度与某碱溶液中水的电离度相等
混合后,溶液的pH值()
A.大于7B.小于7C.等于7D.无法确定
17.pH值相同的醋酸和盐酸溶液,分别用蒸馏水稀释至原体积的m倍和n倍.稀释后两
溶液的pH值仍相同.则m和n的关系是()
A.m=nB.m>n
)
C.蓝色
D.黄色
.两者等体积
18.在25C时,若10体积的某强酸溶液与
前,该强酸的pH值x与强碱的pH值y之间应满足的关系旦
A.x+y=14B.x
+y=15
C.mvnD.无法确定
1体积的某强碱溶液混合后呈中性,则混合之
是()
一14
C.x+y=