高中化学04晶体结构Word文件下载.docx
《高中化学04晶体结构Word文件下载.docx》由会员分享,可在线阅读,更多相关《高中化学04晶体结构Word文件下载.docx(26页珍藏版)》请在冰点文库上搜索。
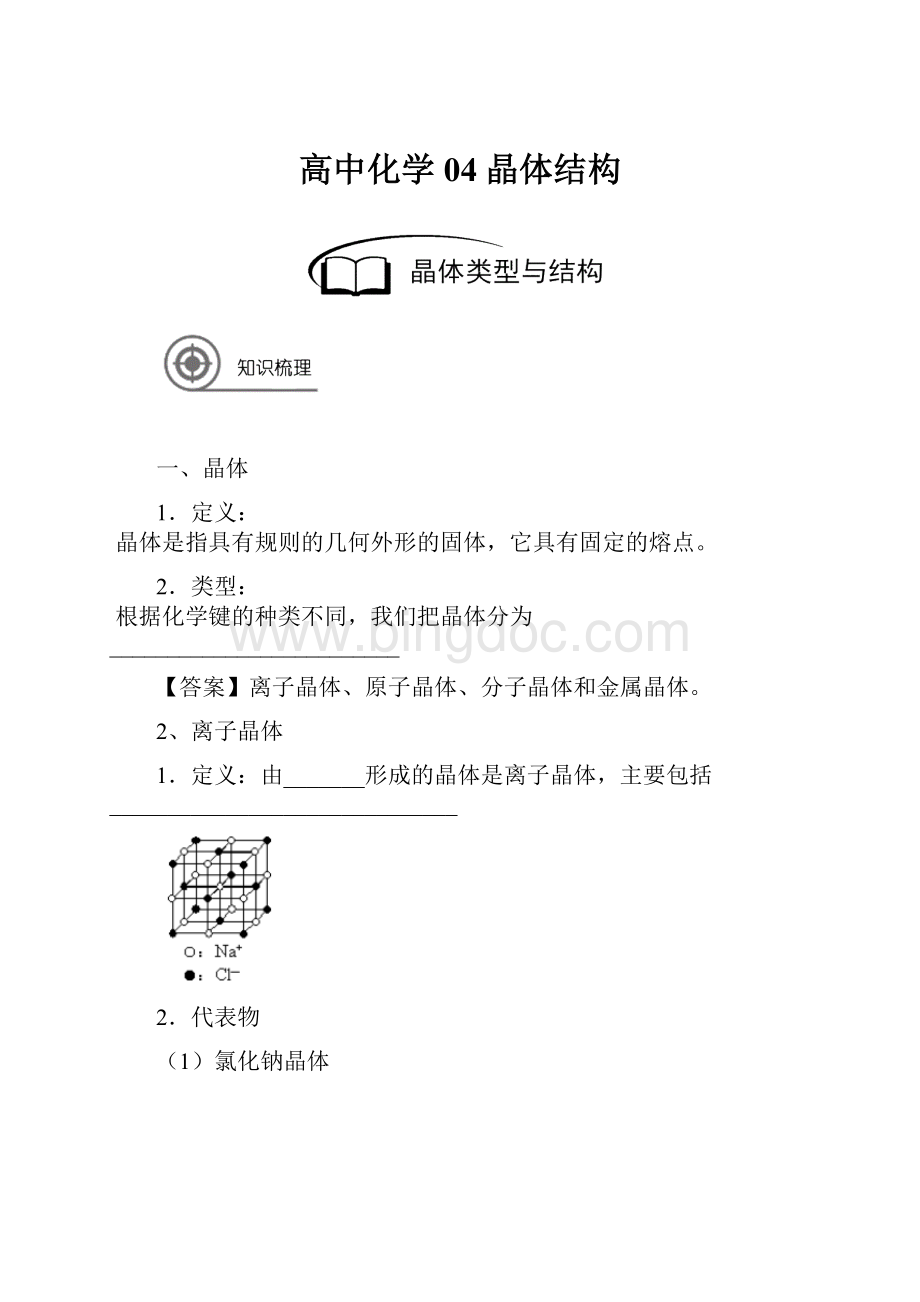
干冰晶体中,二氧化碳分子分布于立方体的每个顶点和每个面心上。
与每个二氧化碳分子最相邻的二氧化碳分子共有_____个。
【答案】12
(2)C60(富勒烯):
1985年发现,荣获1996年度诺贝尔化学奖
分子中碳原子组成12个五元环和20个六元环,被称为足球烯。
3.分子晶体的特点
(1)由于范德华力很弱,所以分子晶体的熔沸点_____,硬度______。
(2)规律:
对于__________________的分子晶体,相对分子质量越大,分子间作用力越___,熔沸点越____,硬度也越____。
【答案】较低、较小组成和结构相似、强、高、大
(3)有的分子晶体中,不仅存在分子间作用力,还存在一种氢键。
由于氢键的存在,往往使物质的熔沸点比其他组成和结构相似的物质高。
如水中存在氢键的作用,水的沸点高于硫化氢等。
注意:
构成分子晶体的微粒是分子,分子内部往往存在共价键,分子之间存在分子间作用力。
但分子内有无共价键与能否形成分子晶体无关。
如稀有气体形成的晶体是分子晶体,构成的分子晶体中不存在任何共价键。
四、原子晶体
原子晶体中,构成晶体的微粒是______,原子间通过______的作用,构成了一个坚实的、彼此连结的空间网状的结构。
如:
___________________________________________
(1)金刚石(或晶体硅)
在金刚石晶体中,每个C原子跟另外_____个C原子形成共价键。
同一个C原子形成的4个共价键中,任意2个共价键之间的夹角为______。
由某个C原子相邻的4个C原子构成一个________,而该C原子位于正四面体的中心。
金刚石中,每个C原子上连接4个共价键,但任意1个共价键由2个C原子分享,故每个C原子上相当于连接了4个共价键的1/2。
因此金刚石中C原子与共价键的个数比为_________
(2)二氧化硅
硅原子在正四面体中心,氧原子在正四面体顶点。
二氧化硅中硅原子与共价键的个数比为______,又称为石英、水晶等。
用于制造玻璃、逛到纤维,具有压电性的单晶石英可制超声波元件等。
【答案】原子、共价键、金刚石、硅、二氧化硅、碳化硅
4、109°
28′、正四面体、1:
2.1:
4
3.原子晶体的特点
(1)原子晶体中,原子之间以__________强烈的结合,其熔沸点_______,硬度_______。
(2)原子晶体的熔沸点取决于共价键的强弱,一般共价键的键长越____,键能越______,熔沸点越_______;
【答案】共价键、很高、很大短、大、高
五、金属晶体
金属晶体是由___________和___________构成的。
在金属晶体中,金属阳离子通过金属键的作用相互结合在一起,自由电子在整个晶体内部作自由移动,这决定了金属具有导电、导热和延展性。
2.金属晶体的特点
(1)不同的金属晶体中,金属键的强弱差异非常显著,因而其熔点和硬度的差异很大。
(2)影响因素:
金属阳离子半径越____,金属键越_____;
金属阳离子所带的电荷越____,金属键越_____。
【答案】金属阳离子、自由电子小、强、多、强
六、其他-石墨
层内碳原子以_______结合成六边形,层间碳原子以___________结合。
有____________________的特征。
【答案】共价键、范德华力、金属晶体、原子晶体、分子晶体
【小结】:
性质比较
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
结构
组成粒子
阴阳离子
分子
原子
金属阳离子和自由电子
粒子间作用
离子键
范德华力
共价键
金属键
物质(从物质的组成上分析)
强碱、金属氧化物及绝大部分的盐
酸、非金属氧化物、气体(包括稀有气体)、有机物及极少部分的盐(如氯化铝、醋酸铅、氯化汞及氯化亚汞等)。
金刚石、硅、二氧化硅、碳化硅
金属
物理性质
熔沸点
较高
低
很高
有高有低
七、物质熔沸点高比较规律
1.不同类型晶体
熔沸点高低规律一般为:
_________________________________________________
【答案】原子晶体>离子晶体>分子晶体。
注:
金属晶体的熔沸点要视情况而定,有的很高,有的很低,不参与比较。
【例1】已知下列晶体的熔点:
NaCl:
801℃、AlF3:
1291℃、AlCl3:
190℃、BCl3:
107℃、Al2O3:
2045℃、CO2:
-56.6℃、SiO2:
1723℃,据此判断下列说法错误的是()
A.元素和铝组成的晶体中有的是离子晶体
B.以上给出的物质中只有BCl3和CO2是分子晶体
C.同族元素的氧化物可以形成不同类型的晶体
D.不同族元素的氧化物可以形成相同类型的晶体
【答案】B
2.相同类型的晶体熔沸点比较
(1)原子晶体:
取决于共价键的键能和键长;
一般地说,原子半径越____,形成的共价键的键长越____,键能越____,其晶体的熔沸点越____。
如:
___________________________
【答案】小、短、大、高、Si>
SiC>
C(金刚石)
(2)离子晶体:
取决于离子键的强弱;
一般地说,阴阳离子的电荷数越____,离子半径越_____,则离子间的作用就越_____,其离子晶体的熔沸点就越_____。
________________________________________
【答案】多、小、强、高、KF>
KCl>
KI;
NaCl<
MgO
(3)分子晶体:
a.组成和结构相似的物质,其相对分子质量越_____,熔沸点越______(有氢键的分子反常)
如:
【答案】大、高、O2>
N2;
HI>
HBr>
HCl;
H2O>
H2S
b.组成和结构不相似的物质,分子极性越_____,其熔沸点就越_____;
________________________________
【答案】大、高、CO>N2
c.在同分异构体中,一般地说,支链数越____,熔沸点越____;
_____________________________________
【答案】多、低、正戊烷>异戊烷>新戊烷
d.同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是:
__________________________
【答案】邻>间>对位化合物
(4)金属晶体:
金属离子半径越____,离子电荷数越____,其金属键越_____,金属的熔沸点越_____。
_______________________________
【答案】小、多、强、高、Na<
Mg<
Al
(5)元素周期表中的规律
a.卤族:
熔沸点逐渐_______;
b.碱金属:
熔沸点逐渐_______。
【答案】升高、降低
3.看物质的状态
在相同条件下:
______________________________
【答案】固态﹥液态﹥气态如:
硫﹥汞﹥氧气
八、电子式的书写
1.离子化合物
①离子化合物电子式的书写(将阴阳离子的电子式组合起来)
氧化钠:
___________________氢氧化钠:
______________________
氯化钠:
___________________过氧化钠:
氯化铵:
__________________氯化镁:
氢化锂:
___________________氮化钠:
_____________________
【答案】
用电子式表示物质时,如果有相同的原子,不能将其合并。
②离子化合物形成过程电子式的书写
MgCl2________________________________________________________________________________________________________________
2.共价化合物或单质
①共价分子电子式的书写
氢气:
_____________________氮气:
_______________________
氯气:
______________________氯化氢:
甲烷:
_____________________二氧化碳:
水:
________________________过氧化氢:
次氯酸:
_________________四氯化碳:
________________________
②共价分子形成过程电子式的书写
HCl___________________________________________________
H2O_____________________________________________________
【答案】H•+
→
③结构式
共价键可用电子式和结构式两种方式表示。
结构式就是用一条短线来表示一对共用电子对,如两成键原子间有两对共用电子对,则用两条短线表示,以此类推。
Cl2:
_____________________H2O:
CO2:
_____________________HClO:
【答案】Cl—ClH-O-HO=C=OH-O-Cl
例题解析
知识点1:
晶体的判断
【例1】根据下表给出的几种物质的熔点和沸点数据,判断下列有关说法中错误的是()
NaCl
MgCl2
AlCl3
SiCl4
单质B
熔点
810℃
719℃
180℃
-68℃
2300℃
沸点
1465℃
1418℃
160℃
57℃
2500℃
A.SiCl4是分子晶体B.单质B是原子晶体
C.AlCl3加热能升华D.MgCl2的键的强度比NaCl的大
【难度】★【答案】D
变式1:
(2016虹口一模19)某晶体中同时含有非极性键和极性键,关于该晶体的说法正确的是()
A.不可能是有机物B.一定是极性分子
C.可能是离子晶体D.一定是分子晶体
【难度】★★【答案】C
变式2:
(2016普陀一模8)下列各组物质均属于分子晶体且均为化合物的是()
A.NH3、HD、C10H8B.PCl3、CO2、AlCl3
C.SO2、SiO2、P2O5D.CCl4、H2O2、Na2S
【难度】★【答案】B
【方法提炼】
晶体判断:
物质的分类如离子晶体:
强碱、金属氧化物及绝大部分的盐;
分子晶体:
酸、非金属氧化物、气体(包括稀有气体)、有机物及极少部分的盐(如氯化铝、醋酸铅、氯化汞及氯化亚汞等);
原子晶体较少,只需记下一些代表物即可3物质的熔沸点。
一般分子晶体熔沸点较低,原子晶体和离子晶体熔沸点都较高。
知识点2:
熔沸点高低的判断
【例2】下列物质的熔沸点均是由高到低排列的是()
①金刚石、晶体硅、碳化硅②MgO>MgCl2>NaCl>CsCl
③金刚石、生铁、纯铁、钠④Al>Mg>Na
⑤正庚烷、2-甲基己烷、3,3-二甲基戊烷、正丁烷
A.②③④⑤B.③④⑤C.①③④D.②④⑤
右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。
试推测ICl的沸点所处的最小范围是()
A.Cl2至BrCl
B.Br2至IBr
C.BrCl至Br2
D.IBr至I2
【难度】★★【答案】B
参考下表中物质的熔点,回答有关问题。
物质
NaF
NaBr
NaI
KCl
RbCl
CsCl
熔点/℃
995
801
755
651
776
715
646
SiF4
SiBr4
SiI4
GeCl4
SnCl4
PbCl4
-90.2
-70.4
5.2
120.5
-49.5
-36.2
-15.0
(1)钠的卤化物及碱金属的氯化物的熔点与_________________有关,随着_________________增大__________________减小,故熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________________有关,随着______________________增大___________________________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅卤化物的熔点高得多,这与____________________,因为_________________________________,故前者的熔点远远高于后者。
【难度】★★
(1)离子半径,离子半径,离子键的相互作用
(2)相对分子质量大小,相对分子质量,分子间作用力
首先判断出是哪种晶体类型,然后根据不同类型的判断标准进行判断。
若晶体类型不同,再综合判断。
知识点3:
晶体和化学键
【例3】
(14崇明二模)以下结论可靠的是()
A.核电荷数大的原子,半径更小B.金属键强的金属,化学活动性更强
C.共价键强的化合物,沸点更高D.容易升华的固体,不会是离子晶体
(14黄埔二模)元素之间通过不同的化学键可以组成不同的晶体和化合物。
有关化学键与晶体的说法正确的是()
A.两种元素组成的分子中一定只有极性键
B.熔融状态时能导电的化合物一定是离子晶体
C.非金属元素组成的化合物一定是共价化合物
D.分子晶体的熔沸点随着共价键的增强而升高
(14闵行二模)有关物质结构的叙述中,正确的是()
A.只含有共价键的物质不一定是共价化合物
B.由电子定向移动而导电的物质一定是金属晶体
C.有键能很大的共价键存在的物质熔沸点一定很高
D.原子晶体中只存在非极性共价键
【难度】★★【答案】A
【方法提炼】该部分知识涉及了很多上节课的知识,在做此类题之前可以先回顾下上节课的主要知识点,然后再进行判断。
知识点4:
根据代表物综合考察晶体
【例4】
(2016崇明一模11)北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电。
下列有关分析正确的是()
A.K3C60和C60中都含有共价键B.K3C60中,阴、阳离子数之比为
C.K3C60是离子晶体,C60是原子晶体D.C60与12C互为同素异形体
【难度】★【答案】A
(2016黄浦一模4)氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述
错的是()
A.AlON和石英的化学键类型相同B.电解熔融AlON可得到A
l
C.AlON的N元素化合价为-1D.AlON和石英晶体类型相同
(2015长宁一模12)最近有科学家成功地在高压下将CO2转化具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是()
A.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
B.CO2的原子晶体和CO2分子晶体具有相同的物理性质和化学性质
C.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子跟两个C原子相结合
D.CO2的原子晶体和分子晶体组成相同,实际上是同一种物质
认真审题,找出题设中的关键性字眼,然后再结合不同晶体的代表物进行做题。
知识点5:
综合运用题
【例5】下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与______个碳原子最近且距离相等。
金刚石属于__________晶体。
(2)其中代表石墨的是___________,其中每个正六边形占有的碳原子数平均为_________个。
(3)其中表示NaCl的是_________,每个Na+周围与它最近且距离相等的Na+有_________个。
(4)代表CsCl的是_______,它属于______晶体,每个Cs+与_______个Cl-紧邻。
(5)代表干冰的是_______,它属于_______晶体,每个CO2分子与______个CO2分子紧邻。
(6)上述五种物质的熔点由高到低的顺序为____________________________。
【难度】★★【答案】
(1)D、4、原子
(2)E、2(3)A、12
(4)C、离子、8(5)B、分子、12(6)石墨>金刚石>NaCl>CsCl>干冰
有下列八种晶体:
A.水晶B.冰醋酸C.氧化镁D.白磷E.晶体氩F.氯化铵G.铝H.金刚石
(1)属于原子晶体的是____,属于分子晶体的是____,属于离子晶体的是____,属于金属晶体的是____。
(用字母表示,下同)
(2)由极性分子构成的晶体是___,含有共价键的离子晶体是_____,属于分子晶体的单质___。
(3)在一定条件下能导电而不发生化学变化的是____,受热熔化后化学键不发生变化的是_______,需克服共价键的是________,需要克服离子键的是:
_____,既克服离子键,又克服共价键的是____。
(1)AH、BDE、CF、G
(2)B、F、DE(3)G、BD、AH、C、F
(浦东三模)现有部分短周期主族元素的有关信息,如下表:
元素编号
T
X
Y
Z
W
元素的性质或原子结构情况
短周期主族元素中原子半径最大
最外层上的电子数比次外层少1个且单质是气体
核外共有13种运动状态不同的电子
若低温蒸发液态空气,因其沸点较低可先获得它的单质
核外有5种不同能量的电子且其中有两个未成对的电子
(1)Y的最外层电子排布式是___________________,它的单质与碳生成的化合物与水反应生成甲烷和白色沉淀。
写出该反应的化学方程式_______________________________________。
(2)元素T的单质与水反应的离子方程式是_________________________________________,
在短周期主族元素中,X元素与其相邻元素的原子半径从小到大的顺序是__________________
(写元素符号)。
(3)W形成的一种单质,其式量为256,易溶于CS2,该单质的化学式为_________,它属于__________晶体(写晶体类型)。
(4)右图为Z元素所在周期气态氢化物R-H键的键能大小,则该周期元素气态氢化物键能大小与键长的关系为_________________________
___________________________________________________________
(用文字简述)。
【难度】★★【答案】
(1)3s23p1Al4C3+12H2O→4Al(OH)3+3CH4↑
(2)2Na+2H2O→2Na++2OH-+H2↑;
F、Cl、S(3)S8,分子;
(4)除CH4外,键长减小,键能增大
此类题综合度较高,做之前可就每题所涉及的主要知识点回顾下,再进行做题。
1.下列关于晶体的说法中,正确的是()
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
2.下列各组晶体中,晶体类型相同,化学键类型也相同的是()
A.SO3和SiO2B.CO2和I2C.NaCl和HClD.K和KCl
3.下列关于物质结构的说法中,正确的是()
A.物理变化中可能有化学键被破坏
B.由原子直接构成的晶体一定是原子晶体
C.含有离子的晶体一定是离子晶体
D.含有阴阳离子的物质中不一定存在离子键
【难度】★【