全国卷1卷高考化学实验大题分析Word文档格式.docx
《全国卷1卷高考化学实验大题分析Word文档格式.docx》由会员分享,可在线阅读,更多相关《全国卷1卷高考化学实验大题分析Word文档格式.docx(15页珍藏版)》请在冰点文库上搜索。
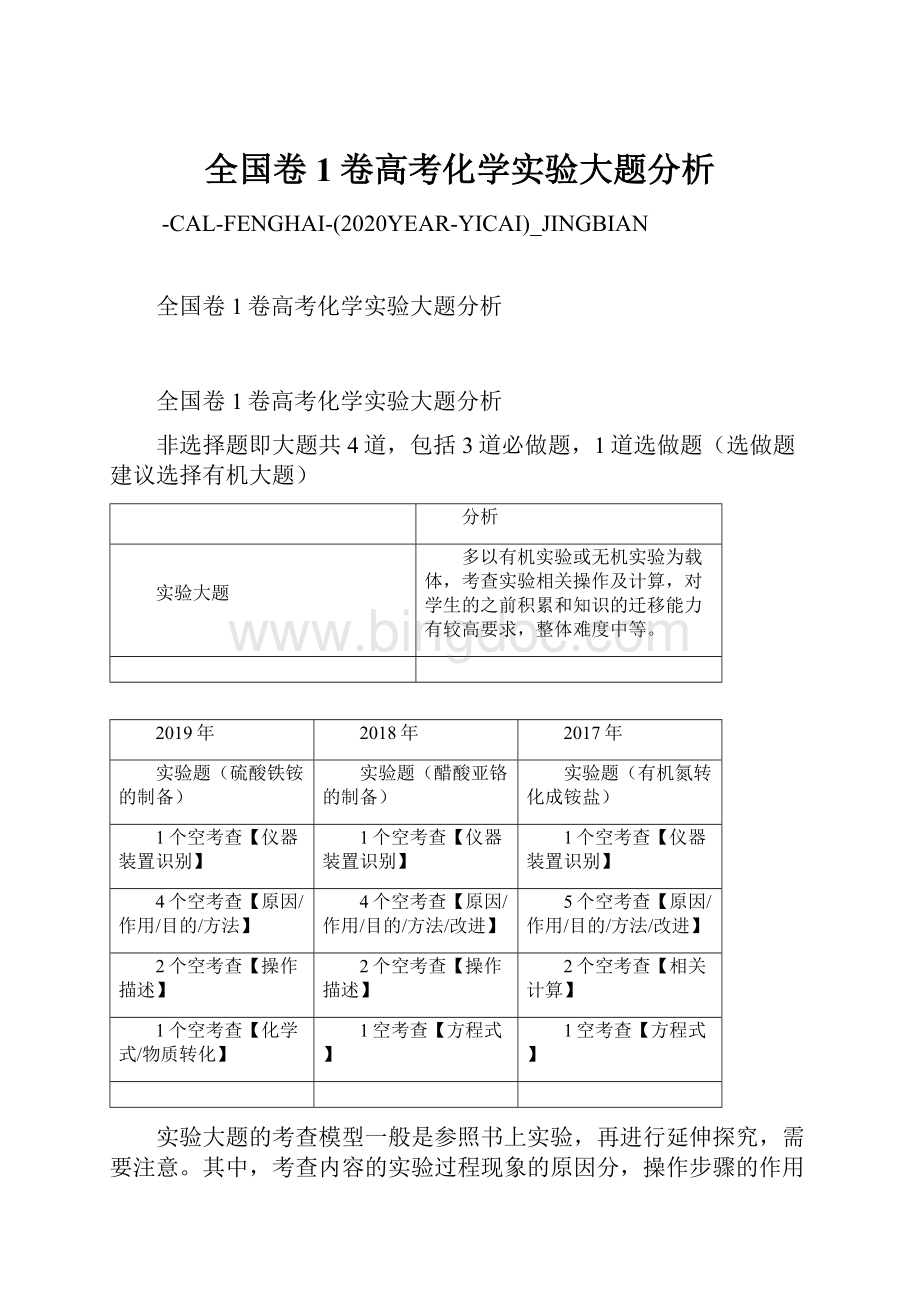
铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。
分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时,失掉1.5个结晶水,失重5.6%。
硫酸铁铵晶体的化学式为______________。
答案
【答案】
(1).碱煮水洗
(2).加快反应速率(3).水浴加热(4).C(5).将Fe2+全部氧化为Fe3+,不引入新的杂质(6).因为H2O2本身易分解,所以在加入时需分量加入,同时为了防止Fe3+水解(7).加热浓缩、冷却结晶、过滤(洗涤)(8).NH4Fe(SO4)2∙12H2O
【2018新课标1卷】醋酸亚铬[(CH3COO)2Cr·
H2O]为砖红色晶体,难溶于
冷水,易溶于酸,在气体分析中用作氧气吸收剂。
一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;
二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。
实验装置如图所示,回答下列问题:
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。
c中亮蓝色溶
液流入d,其原因是________;
d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
【答案】去除水中溶解氧分液(或滴液)漏斗Zn+2Cr3+=Zn2++2Cr2+排除c中空气c中产生H2使压强大于大气压(冰浴)冷却过滤敞开体系,可能使醋酸亚铬与空气接触
2.【2018新课标2卷】K3[Fe(C2O4)3]·
3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·
3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。
其光解反应的化学方程式为:
2K3[Fe(C2O4)3]
2FeC2O4+3K2C2O4+2CO2↑;
显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·
L-1KMnO4溶液滴定至终点。
滴定终点的现象是_________________________
__。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
加稀H2SO4酸化,用cmol·
L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。
该晶体中铁的质量分数的表达式为________________________________。
【答案】3FeC2O4+2K3[Fe(CN)6]
Fe3[Fe(CN)6]2+3K2C2O4隔绝空气、使反应产生的气体全部进入后续装置CO2CO先熄灭装置A、E的酒精灯,冷却后停止通入氮气取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3粉红色出现
3.【2018新课标3卷】硫代硫酸钠晶体(Na2S2O3·
5H2O,M=248g·
mol−1)可用作定影剂、还原剂。
(1)已知:
Ksp(BaSO4)=1.1×
10−10,Ksp(BaS2O3)=4.1×
10−5。
市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:
稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤
现象
①取少量样品,加入除氧蒸馏水
②固体完全溶解得无色澄清溶液
③___________
④___________,有刺激性气体产生
⑤静置,___________
⑥___________
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。
测定步骤如下:
①溶液配制:
称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100mL的_________中,加蒸馏水至____________。
②滴定:
取0.00950mol·
L−1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:
Cr2O72−+6I−+14H+
3I2+2Cr3++7H2O。
然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:
I2+2S2O32−
S4O62−+2I−。
加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。
平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为_________%(保留1位小数)。
【答案】③加入过量稀盐酸④出现乳黄色浑浊⑤(吸)取上层清液,滴入BaCl2溶液⑥产生白色沉淀烧杯容量瓶刻度蓝色褪去95.0
4.【2018天津卷】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。
Ⅰ.采样
采样步骤:
①检验系统气密性;
②加热器将烟道气加热至140℃;
③打开抽气泵置换系统内空气;
④采集无尘、干燥的气样;
⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是___________。
(2)C中填充的干燥剂是(填序号)___________。
a.碱石灰b.无水CuSO4c.P2O5
(3)用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
(4)采样步骤②加热烟道气的目的是___________。
Ⅱ.NOx含量的测定
将vL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3−,加水稀释至100.00mL。
量取20.00mL该溶液,加入v1mLc1mol·
L−1FeSO4标准溶液(过量),充分反应后,用c2mol·
L−1K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(5)NO被H2O2氧化为NO3−的离子方程式是___________。
(6)滴定操作使用的玻璃仪器主要有___________。
(7)滴定过程中发生下列反应:
3Fe2++NO3−+4H+
NO↑+3Fe3++2H2O
Cr2O72−+6Fe2++14H+
2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·
m−3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高”、“偏低”或“无影响”)
若缺少采样步骤③,会使测试结果___________。
若FeSO4标准溶液部分变质,会使测定结果___________。
【答案】除尘c
防止NOx溶于冷凝水2NO+3H2O2=2H++2NO3–+2H2O锥形瓶、酸式滴定管
偏低偏高
5.【2018江苏卷】3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4−亚甲二氧基苯甲醛制备,其反应方程式为
实验步骤如下:
步骤1:
向反应瓶中加入3,4−亚甲二氧基苯甲醛和水,快速搅拌,于70~80℃滴加KMnO4溶液。
反应结束后,加入KOH溶液至碱性。
步骤2:
趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:
对合并后的溶液进行处理。
步骤4:
抽滤,洗涤,干燥,得3,4−亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,
转化为_____________(填化学式);
加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为_
_________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
【答案】
(1)SO42−将反应生成的酸转化为可溶性的盐
(2)MnO2
(3)向溶液中滴加盐酸至水层不再产生沉淀
(4)布氏漏斗
6.【2017新课标1卷】凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。
已知:
NH3+H3BO3=NH3·
H3BO3;
NH3·
H3BO3+HCl=NH4Cl+H3BO3。
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。
f的名称是__________________。
(3)清洗仪器:
g中加蒸馏水;
打开k1,关闭k2、k3,加热b,蒸气充满管路;
停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;
打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。
铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。
打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m克进行测定,滴定g中吸收液时消耗浓度为cmol·
L–1的盐酸VmL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
(1)避免b中压强过大
(2)防止暴沸直形冷凝管(3)c中温度下降,管路中形成负压
(4)①液封,防止氨气逸出②
+OH−
NH3↑+H2O保温使氨完全蒸出
(5)
(4)①氨气是气体,因此d中保留少量水的目的是液封,防止氨气逸出。
②e中主要反应是铵盐与碱在加热条件下的反应,离子方程式为
NH3↑+H2O;
e采用中空双层玻璃瓶的作用是保温减少热量损失,有利于铵根转化为氨气逸出。
L–1的盐酸VmL,根据反应NH3·
H3BO3+HCl=NH4Cl+H3BO3,可以求出样品中n(N)=n(HCl)=cmol·
L–1×
V×
10–3L=0.001cVmol,则样品中氮的质量分数为
,样品中甘氨酸的质量≤0.001cV×
75g/mol,所以样品的纯度≤
。
7.【2017新课标2卷】水泥是重要的建筑材料。
水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。
加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。
沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知
钙的含量,滴定反应为:
+H++H2C2O4→Mn2++CO2+H2O。
实验中称取0.400g水泥样品,滴定时消耗了0.0500mol·
L−1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为______________。
(1)将样品中可能存在的Fe2+氧化为Fe3+H2O2
(2)SiO2(或H2SiO3)SiO2+4HF=SiF4↑+2H2O(或H2SiO3+4HF=SiF4↑+3H2O)
(3)防止胶体生成,易沉淀分离Fe(OH)3Al(OH)3(4)45.0%
8.【2017新课标2卷】水中的溶解氧是水生生物生存不可缺少的条件。
某课外小组采用碘量法测定学校周边河水中的溶解氧。
实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。
记录大气压及水体温度。
将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2
+I2=2I−+
)。
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)“氧的固定”中发生反应的化学方程式为_______________。
(3)Na2S2O3溶液不稳定,使用前需标定。
配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和
____________;
蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取100.00mL水样经固氧、酸化后,用amol·
L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_________;
若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为_________mg·
L−1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。
(填“高”或“低”)
(1)使测定值与水体中的实际值保持一致,避免产生误差
(2)O2+2Mn(OH)2=2MnO(OH)2(3)量筒氧气
(4)蓝色刚好褪去80ab(5)低
9.【2017天津卷】用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·
L−1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·
L−1AgNO3溶液(过量),使I−完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·
L−1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。
三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由________________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I−)=_________________mol·
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为________________________。
(7)判断下列操作对c(I−)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
(1)250mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能)若颠倒,Fe3+与I−反应,指示剂耗尽,无法判断滴定终点
(5)10.000.0600(6)用NH4SCN标准溶液进行润洗(7)偏高偏高
10.【2017江苏卷】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·
cm−3。
实验室制备少量1−溴丙烷的主要步骤如下:
在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;
冷却至室温,搅拌下加入24gNaBr。
如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
将馏出液转入分液漏斗,分出有机相。
将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)仪器A的名称是_____________;
加入搅拌磁子的目的是搅拌和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:
向分液漏斗中小心加入12mL5%Na2CO3溶液,振荡,____________,静置,分液。
(1)蒸馏烧瓶防止暴沸
(2)丙烯、正丙醚(3)减少1-溴丙烷的挥发
(4)减少HBr挥发(5)将分液漏斗下口向上倾斜、打开活塞排出气体