学年高三化学 二轮复习北京 综合实验性质制备探究.docx
《学年高三化学 二轮复习北京 综合实验性质制备探究.docx》由会员分享,可在线阅读,更多相关《学年高三化学 二轮复习北京 综合实验性质制备探究.docx(15页珍藏版)》请在冰点文库上搜索。
学年高三化学二轮复习北京综合实验性质制备探究
2018——2019学年高三化学二轮复习北京综合实验(性质制备探究)
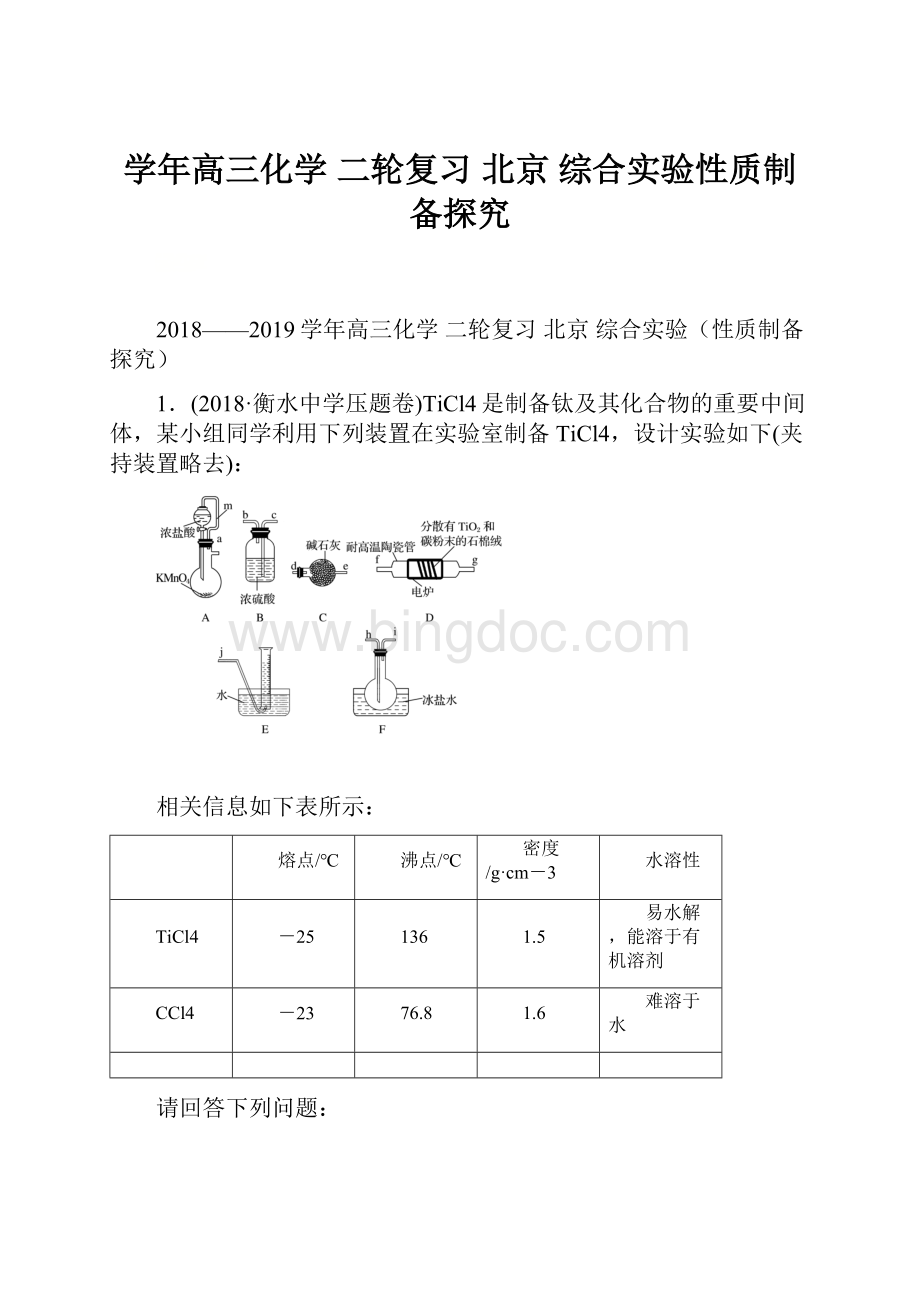
1.(2018·衡水中学压题卷)TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):
相关信息如下表所示:
熔点/℃
沸点/℃
密度/g·cm-3
水溶性
TiCl4
-25
136
1.5
易水解,能溶于有机溶剂
CCl4
-23
76.8
1.6
难溶于水
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为__________(填仪器接口字母)。
(2)根据完整的实验装置进行实验,实验步骤如下:
检查装置气密性后,装入药品;________________(按正确的顺序填入下列操作的字母)。
A.关闭分液漏斗活塞
B.停止加热,充分冷却
C.打开分液漏斗活塞
D.加热装置D中陶瓷管
实验时,当观察到________时,开始进行步骤D。
(3)装置A中导管m的作用为________________________________________________。
(4)装置C的作用为__________________________________________________________。
(5)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________________________________________________________________________。
(6)设计实验证明装置F中收集到的液体中含有TiCl4:
________________________________________________________________________。
(7)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为______________。
答案
(1)acbfg(或gf)hidej
(2)CDBA 装置F充满黄绿色气体
(3)平衡压强,使浓盐酸容易滴落
(4)防止水蒸气进入装置F,吸收未参加反应的Cl2,防止污染空气
(5)TiO2+2C+2Cl2
TiCl4+2CO
(6)取少量收集到的液体于洁净试管中,滴加适量水,产生白色沉淀,则收集到的液体中含有TiCl4
(7)蒸馏
2、(19年北京西城)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:
K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是________。
(2)Ⅰ中,生成K2MnO4的化学方程式是________。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是________。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4。
装置如下图:
b极是______极(填“阳”或“阴”),D是________。
结合电极反应式简述生成KMnO4的原理:
________。
传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:
Na2C2O4+H2SO4==H2C2O4+Na2SO4
5H2C2O4+2MnO4−+6H+==2Mn2++10CO2↑+8H2O
摩尔质量:
Na2C2O4134g·mol−1KMnO4158g·mol−1
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液VmL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为________。
焙烧
答案
(1)增大反应物接触面积,加快反应速率(1分)
(2)2MnO2+4KOH+O2=====2K2MnO4+2H2O(2分)
(3)保持溶液呈强碱性,防止K2MnO4发生歧化反应(1分)
(4)3K2MnO4+2CO2==2KMnO4+MnO2↓+2K2CO3(2分)
(5)①阴(1分)较浓的KOH溶液(1分)
②a极:
MnO42−−e−==MnO4−,部分K+通过阳离子交换膜进入阴极区,阳极区生成KMnO4(1分)
③用阳离子交换膜可防止MnO4−、MnO42−在阴极被还原(1分)
(6)(2分)
3(19年北京西城)实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
【实验Ⅰ】向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1。
溶液中持续产生气泡,最终溶液变为绿色。
资料:
ⅰ.Cr2(SO4)3溶液呈绿色。
ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。
ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如右图,CrO5可溶于水,
易溶于乙醚得到蓝色溶液。
ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。
(1)实验Ⅰ中产生的气体是O2,检验的方法是________。
(2)实验Ⅰ的紫红色溶液中含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是________。
②生成CrO5的反应不是氧化还原反应,反应的离子方程式是________。
(3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设:
a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。
b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。
为验证上述假设,用下图装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油
用于吸收挥发出的乙醚)。
实验操作及现象如下:
【实验Ⅱ】
ⅰ.将20mLCrO5的乙醚溶液加入A中的20mL
pH=1的稀硫酸中,不断搅拌,乙醚层由蓝色
变为无色,水层变为绿色,O2体积为VmL。
ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶
液,轻轻搅拌,静置,乙醚层又显出蓝色。
【实验Ⅲ】
仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。
现象与实验Ⅱ相同,且O2体积仍为VmL。
①实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2∶3,补全离子方程式:
2CrO5+________==2Cr3++3O2↑+________+________。
②甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是________。
(4)实验Ⅰ中总反应的离子方程式是________。
答案(共10分)
(1)将带火星的木条伸入试管中,木条复燃,说明生成的气体是O2(1分)
(2)①取少量紫红色溶液于试管中,加入乙醚,振荡,静置,液体分为两层,上层呈蓝色(2分)
②Cr2O72−+4H2O2+2H+==2CrO5+5H2O(2分)
(3)①2CrO5+6H+==2Cr3++3O2↑+H2O2+2H2O(2分)
②实验Ⅱ、Ⅲ中,O2来源于CrO5、H2O2中的−1价O,且−1价O过量,当CrO5的量相同时,生成O2的体积相同,因而由实验Ⅱ和Ⅲ中生成O2的体积相同无法说明假设b是否成立(1分)
(4)Cr2O72−+3H2O2+8H+==2Cr3++3O2↑+7H2O(2分)
4(19年北京海淀)为探究不同条件下甘油(丙三醇)和辛酸酯化合成甘油二酯的最佳条件,科研工作者做了甘油二酯的酶法合成工艺研究。
实验1:
研究不同投料比对产率的影响
(1)理论分析合成甘油二酯所需辛酸与甘油的投料比(物质的量之比)为2∶1。
实验证明提高投料比,甘油二酯的产率会降低,其原因可能是。
实验2:
研究吸水剂对反应的影响
(2)硅胶易与羟基结合,故有较强的亲水性,易于吸附水分子。
但是在反应体系里加入硅胶后甘油二酯含量明显降低,说明合成甘油二酯的平衡发生了逆向移动,分析可能的原因是________。
实验3:
研究不同催化剂的催化效果
曲线
催化剂
纵坐标
1
脂肪酶I号
辛酸转化率
2
脂肪酶II号
辛酸转化率
3
脂肪酶I号
甘油二酯含量
4
脂肪酶II号
甘油二酯含量
图1
(3)其他条件相同时,不同脂肪酶(I号、II号)催化合成甘油二酯的效果如图1所示,选择此实验中催化效果相对最佳的反应条件是________(填字母序号)。
A.12h,I号B.24h,I号
C.12h,II号D.24h,II号
实验4:
研究温度对反应速率和产率的影响
图2图3
(4)选定脂肪酶做催化剂,继续实验。
综合图2和图3,选择6h时比较适宜的反应温度是________。
在6h之后,辛酸的转化率总趋势缓慢上升,30℃、40℃甘油二酯的含量上升,但是50℃的却有所降低,分析可能的原因是________。
答案
(1)辛酸的量增加,会有更多的甘油三酯生成,导致产物中甘油二酯的产率降低
(2)甘油分子有3个羟基,故硅胶对甘油的吸附能力也较强,降低了体系中反应物甘油的浓度,从而使合成甘油二酯的酯化反应平衡逆向移动,降低了甘油二酯的含量
(3)A
(4)
50℃
催化合成甘油二酯反应的脂肪酶,长时间处于高温下活性(选择性)下降,导致甘油二酯含量下降,副反应产物含量增加
5、(19年北京朝阳)Fe3O4呈黑色、有磁性,应用广泛。
以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。
(1)检验Fe3O4中铁元素的价态:
用盐酸溶解Fe3O4,取少量滴加,溶液变红;另取少量滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)氧化—沉淀法制备Fe3O4
Ⅰ.向稀硫酸中加入过量铁粉,得到FeSO4溶液。
空气中存在O2,由于(用
离子方程式表示),可产生Fe3+。
过量铁粉的作用是除去Fe3+。
Ⅱ.在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。
将NaNO3溶液滴入浊液中,充分反应得到Fe3O4。
①用湿润红色石蕊试纸检验产物,(填现象),证明生成了NH3。
②
。
(将反应补充完整)
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图所示。
下列分析正确的是。
a.KH2PO4的水溶液中:
c(H+)>c(OH-)
b.K2HPO4溶液显碱性,原因是HPO42-的水解程度大于其电离程度
c.H3PO4是强电解质,在溶液中完全电离
(4)将Fe3O4加到KH2PO4溶液中,调节溶液pH。
pH对吸附剂Fe3O4表面所带电荷的影响:
pH<6.8,Fe3O4表面带正电荷;pH>6.8,Fe3O4表面带负电荷;pH=6.8,Fe3O4表面不带电荷。
Fe3O4对含磷微粒的去除率随pH的变化如下。
①pH=3时,吸附的主要微粒是。
②与pH=5时相比,pH=9时的去除率明显
下降,原因是:
。
答案
(1)KSCN溶液
(2)I.
II.①试纸变蓝
②
(3)ab
(4)①
②pH=5时,
带正电荷,含磷的主要微粒是
;pH=9时,
带负电
荷,含磷的主要微粒是
。
因此在pH=9时,吸附剂和含磷的主要微粒之间
的静电排斥作用强于pH=5时。
6、(19年北京海淀)某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略)
现象
Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:
Cu2+的浓度较大所致;
假设2:
溶解了生成的NO2。
探究如下:
取Ⅱ中绿色溶液,分为两等份。
①取一份于右图所示装置中,(填“操作”和“现象”),
证实Ⅱ中溶解了NO2。
②向另一份溶液加入(填化学试剂),溶液变为蓝色。
证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
①B中盛放的试剂是。
②C中盛放Cu(NO3)2和。
③该小组证实推测的合理性所依据的实验现象是。
答案
(1)
(2)硝酸浓度大
(3)①向上拉动活塞a,试管内液面上方出现红棕色气体
②
(或CuO等)
(4)解释1.增多
解释2.①水
②浓硝酸
③C中溶液变绿
7、某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果.
实验Ⅰ(图1)
物质
0min
1min
1h
5h
FeSO4
淡黄色
桔红色
红色
深红色
(NH4)2Fe(SO4)2
几乎无色
淡黄色
黄色
桔红色
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是 (用化学用语表示).溶液的稳定性:
FeSO4 (NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
操作
现象
取 ,加 ,观察.
与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同.
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:
分别配制0.80molL﹣1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短.资料显示:
亚铁盐溶液中存在反应4Fe2++O2+10H2O⇌4Fe(OH)3+8H+.由实验Ⅲ,乙同学可得出的结论是 ,原因是 .
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是 .
(5)综合以上实验,增强Fe2+稳定性的措施有 .
答案:
某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果.
实验Ⅰ(图1)
物质
0min
1min
1h
5h
FeSO4
淡黄色
桔红色
红色
深红色
(NH4)2Fe(SO4)2
几乎无色
淡黄色
黄色
桔红色
(1)FeSO4 < (NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
操作
现象
取 取2mLpH=4.0的0.80molL﹣1FeSO4溶液 ,加 加2滴0.01molL﹣1KSCN溶液 ,观察.
与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同.
(3) 溶液pH越小,Fe2+越稳定 ,原因是 溶液中存在平衡4Fe2++O2+10H2O⇌4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定 .
(4) 生成的Fe(OH)3对反应有催化作用 .
(5) 加一定量的酸,密封保存 .