广东高考化学实验题合集Word文档下载推荐.docx
《广东高考化学实验题合集Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《广东高考化学实验题合集Word文档下载推荐.docx(58页珍藏版)》请在冰点文库上搜索。
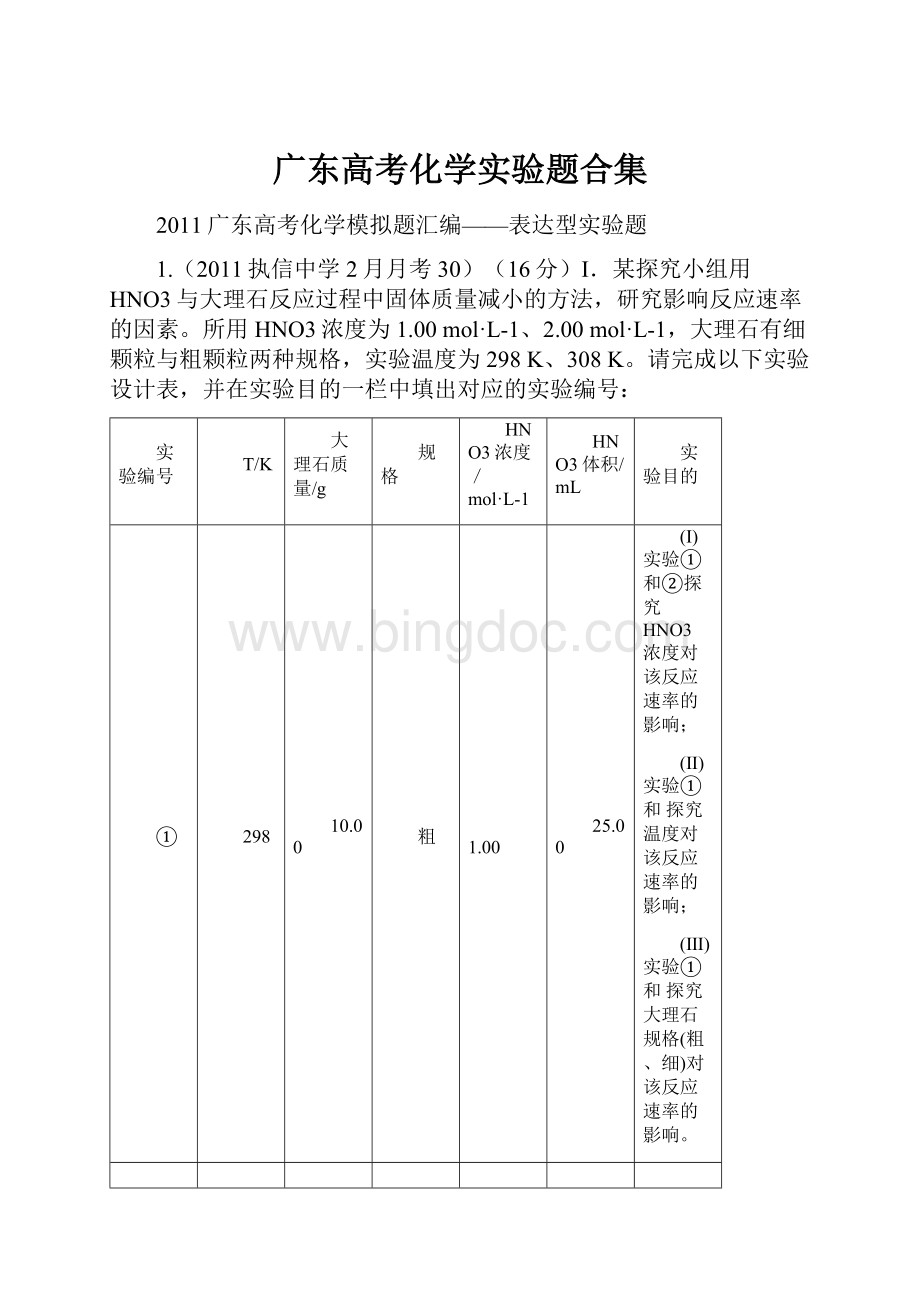
请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
实验操作
预期现象与结论
步骤1
步骤2
步骤3
……
2.(执信中学2011届下学期高三测试33)(16分)某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是;
步骤3的操作名称是。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
只含有氯化钠假设2:
只含有假设3:
氯化钠和氢氧化钠都含有
(3)设计实验方案,进行试验。
限选以下试剂:
氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。
回答下列问题:
①加入过量试剂A的名称是_______________________。
②填写下表:
实验步骤
预期现象和结论
步骤4:
步骤5:
3.(执信中学高三第二学期三模33)(16分)海水中含有多种盐类,除可获得NaCl、MgCl2外,也是自然界提取卤素的重要来源。
(1)由于溴离子在海水中浓度很低(0.067g/L),要进行溴元素的浓缩、富集。
实验室若要直接浓缩海水时,下面的仪器肯定不需要的是(填编号):
A.玻璃棒B.三脚架C.酒精灯D.蒸发皿E.坩埚
(2)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。
吸收工艺常用的方法是“空气吹出法”,其原理为:
SO2+Br2+2H2O=2HBr+H2SO4。
另一种方法是用纯碱浓溶液代替SO2吸收溴,请完成下列方程式的配平(酸性条件下该反应逆向进行):
Na2CO3+Br2=NaBr+NaBrO3+
(3)现有一份吸收了溴的无色溶液(采用上述两种方法之一,且吸收剂和溴恰好完全反应),请你通过实验探究该溶液究竟是采用那种方法吸收溴的。
①提出合理假设(以下可不填满)
采用纯碱吸收法,吸收液中含大量Na+、Br–、BrO3-。
假设2:
②设计方案、进行实验,验证假设:
请在表中写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:
10mL量筒、小烧杯、试管、胶头滴管;
无水乙醇、苯、0.10mol/LAgNO3、0.10mol/LBaCl2、2mol/LHCl
步骤1:
用量筒取样品溶液2mL于试管中,再滴加足量的2mol/L盐酸,充分振荡,观察
若,则假设1可能成立;
若,
则。
步骤2:
往步骤1的试管中加入___________,
充分振荡,观察
4.(2011届广雅中学高三下学期2月联考理科综合33)(16分)某研究性学习小组在网上收集到如下信息:
Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。
他们对蚀刻银的原因进行了如下探究:
【实验】制备银镜,并与Fe(N03)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是
a.边振荡盛有2%的AgN03溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热d银氨溶液具有较弱的氧化性e.在银氮溶液配制过程中,溶液的pH增大
写出锟氨溶液与乙醛反应生成银镜的化学方程式:
【提出假设】假设1:
Fe3+具有氧化性,能氧化Ag。
Fe(N03)3溶液显酸性,在此酸性条件下
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设l成立。
请写出Fe3+氧化Ag
的离子方程式。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:
在不同条件下的还
原产物较复杂,有时难以观察劐气体产生)。
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。
则丙同学由此得出结论;
Fe(N03)3溶液中的Fe3+和
都氧化了Ag。
你是否同意丙同学的结论,并简述理由。
5.(2011金山中学33)(16分)钠是一种很活泼的金属;
在工业上常用电解熔融NaC1的方法制得,其另一产
物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解法制取钠的化学方程式____。
(2)工业上制取漂白粉的化学反应方程式为2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H20,漂白粉
的主要成分是。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可
能存在的其它物质。
①提出合理假设。
假设1:
该漂白粉未变质,只含有,假设2:
该漂白粉全部变质,只含有;
假设3:
该漂白粉部分变质,
②设计实验方案,证明①中的假设。
③请在答题卡上写出实验步骤、预期现象与结论。
限选的仪器和药品:
试管、滴管、带导管的单孔塞、蒸馏水、自来水、lmol/L,盐酸、
品红溶液、新制澄清石灰水。
(提示:
不必检验Ca2+和C1-,表格可以不填满。
)
6.(2011深圳二模33)(16分)Ⅰ、下列实验正确的是(填序号,双选)。
A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,制取Fe(OH)3胶体
B.苯酚沾到皮肤上,先用酒精清洗,再用水冲洗
C.将l0gZnSO4·
7H2O溶解在90g水中,配制10%ZnSO4溶液
D.向稀硫酸中加几滴CuSO4溶液,可提高纯锌与稀硫酸的反应速率
Ⅱ、Na2SO3是抗氧剂。
向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出碱性中Br2氧化Na2SO3的离子方程式。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:
2mol·
L-1HCl;
1mol·
L-1H2SO4;
lmol·
L-1BaCl2;
L-1Ba(NO3)2;
0.1mol·
L-1AgNO3;
CCl4;
新制饱和氯水。
编号
步骤①
有白色沉淀生成,证明待测液中含SO42-。
步骤②
步骤③
7.(2011深圳一模33)(16分)Ⅰ.已知溶液导电性与其中离子浓度有定量关系。
某兴趣小组设计了以下装置和方法测定空气中SO2含量。
你认为可行的操作是________________(填序号)
Ⅱ.Fe2+、SO32-和I-都具有还原性。
为了比较其还原性强弱,进行以下探究并回答:
(1)已知:
①还原性:
SO32->
Fe2+;
②FeSO3难溶于水。
(2)在
(1)的基础上,完成下列假设。
假设1,还原性:
I->
假设2,还原性:
SO32->
I->
Fe2+;
______________________。
(3)实验探究:
现对假设2进行探究。
完成实验步骤以及预期的现象和结论。
限选以下试剂:
0.1mol/LNa2SO3、0.1mol/LKI、0.1mol/LFeCl3、10%KSCN、新制饱和氯水、淀粉溶液、稀HNO3、1mol/LHCl、1mol/LBaCl2
预期的现象及结论
取1mL0.1mol/LNa2SO3和1mL0.1mol/LKI溶液于试管中,混合后滴入2~3滴新制氯水,振荡。
____________________________
_____________________________________
____________________________________
_______________________________________
步骤3:
取1mL0.1mol/LKI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡。
步骤4:
8.(2011广一模33)(16分)某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液。
请完成对反应物剩余情况的探究。
(1)提出合理假设:
假设1:
FeSO4有剩余;
假设2:
NaClO有剩余;
假设3:
____________________________
(2)样品初步处理:
取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液。
此澄清溶液中肯定含有的合属阳离子是_____________________
(3)设计后续实验方案验证假设。
请在答题卡上写出实验步骤以及预期现象和结论。
限选实验试剂:
3mol.L-1H2SO4,0.01mol•L-1KMnO4,20%KSCN、3%H2O2,淀粉-KI溶液、紫色石蕊溶液。
将上述澄清溶液分置于A、B试管中。
9.(2011广二模33)(16分)已知FeSO4在不同条件下分解得到的产物不同,町能是FeO和SO3,也可能是Fe2O5、303和302。
某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。
已知SO3的熔点是16.80C,沸点是44.80C
(1)装置II的试管中不装任何试剂,其作用是_______,试管浸泡在500C的水浴中,目的是
(2)装置III和装置IV的作用是探究本实验气体产物成分。
请完成实验设计,填写检验试剂、预期现象与结论。
3mol.L-1.H2S04、6mol.L-lNaOH、0.5mol.L-1BaCl2O.5mol.L-1Ba(NO3)20.01mol.L-1酸性KMnO4溶液、0.Olmol.L-1溴水。
检验试剂
装置III的试管中加人______。
产生大量白色沉淀,证明气体产物中含有SO3。
装置IV的试管中加人______
____________________________________________________________
(3)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是______。
2011广东高考化学模拟题汇编——表达型实验题参考答案
1.(16分)Ⅰ.(5分)
大理石m/g
②
③
④
308
细
2.00
1.00
(Ⅱ)③
(Ⅲ)④
Ⅱ.(11分)
(1)不合理,(1分)HNO3会将+2价Fe氧化成+3价。
(1分)
(2)①假设1:
只存在+2价Fe;
只存在+3价Fe;
同时存在+2、+3价Fe(2分)
取少量样品于试管中,加入适量3mol/LH2SO4,充分溶解后将溶液分装于A、B两试管中。
样品固体溶解,得到浅绿色或浅黄色溶液。
向A试管的溶液中滴加几滴KSCN溶液,振荡,观察(1分)
若溶液显红色,说明含Fe3+;
若不显红色,则假设1成立。
向B试管的溶液中滴加几滴0.01mol/LKMnO4溶液,振荡,观察(1分)
若溶液紫色褪去,说明含Fe2+;
若不褪色,则假设2成立。
若步骤2溶液显红色,且步骤3溶液紫色褪去,则假设3成立。
2.(16分)
(1)烧杯玻璃棒(2分);
过滤(2分)
(2)氢氧化钠(2分)(3)①硝酸钡溶液。
(2分)
②
取少量滤液于试管,往其中滴加2~3滴酚酞试液(2分)
如果酚酞变红,假设2或假设3成立。
如果酚酞不变红,假设1成立。
用试管取少量滤液,往其中滴加足量的稀硝酸至溶液呈酸性,再滴加硝酸银溶液。
若没有白色沉淀生成,则说明假设2成立。
若有白色沉淀生成,则说明假设1或假设3成立;
结合步骤4
如果酚酞变红,假设3成立(2分)
3.(16分)
(1)E(2分)
(2)3Na2CO3+3Br2=5NaBr+1NaBrO3+3co2↑(3分)
(3)假设2:
采用空气吹出吸收法,吸收液中含大量H+、Br–、SO42-。
(2分)
若溶液由无色变黄色,则假设1可能成立(2分)。
若溶液无明显变化,则假设2可能成立(1分)
往步骤1的试管中加入1mL苯,
(或几滴0.10mol/LBaCl2)(2分)
若溶液分层,上层有机层出现橙色或橙红色,则假设2成立;
(2分)若溶液只分层,无颜色变化,则假设1成立;
(或若溶液出现白色混浊,则假设2成立;
若溶液无明显现象,则假设1成立)
4.(16分)
(1)ade(3分)
(2)
(3)②相同pH值的稀硝酸,有银镜的试管(4分)银镜消失、银镜不消失(2分)
(4)不同意(1分)甲同学检验出了Fe2+,可确定Fe3+一定氧化了Ag。
乙同学虽然
验证了此条件下
能氧化Ag,但在Fe(N03)3溶液氧化Ag时,由于没有检验
的还原产物,因此不能确定
是否氧化了Ag。
5.(16分)
(1)
(3分,配平1分,条件及状态符号1分,化学式错误给O分)
(2)CaC12、Ca(ClO)2(2分,各1分)
(3)①Ca(Cl0)2(1分);
CaCO3(1分);
既含有Ca(ClO)2又含有CaC03(1分)
③(注:
没有说明用量,各扣1分;
写“否则无”合扣1分;
若没“结合步骤①”扣1分)
6.Ⅰ、B、D(4分,多选1个倒扣2分)
Ⅱ、
(1)SO32-+Br2+2OH-=H2O+SO42-+2Br-(4分)
(2)(8分)
取少量待测液加入试管中,加入过量的2mol·
L-1盐酸,再滴加适量lmol·
L-1BaCl2溶液。
(3分)
方法1:
取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。
(3分)(若再加入四氯化碳,振荡,静置后观察颜色也可)
溶液呈橙黄色,证明待测液中含Br-。
(下层液体呈橙红色,证明待测液中含Br-。
方法2:
另取少量待测液加入试管中,加入足量的2mol·
L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。
7..(16分)Ⅰ.BD(6分)Ⅱ.假设3:
还原性SO32—>Fe2+>I—(2分)答题时现的几种情形:
向试管中加入足量的
L-1HCl后再滴入数滴(少许)1mol·
L-1BaCl2,振荡试管(2分)
若没有白色沉淀产生,则说明还原性:
I—>SO32—(2分)
或:
若没有白色沉淀产生,则说明假设2不成立
若有白色沉淀产生,则说明SO32—>I—
若有白色沉淀产生,则说明假设2成立
(方法2)向试管中滴入少量淀粉溶液,振荡试管
若不变蓝色,说明还原性:
SO32—>I—
若变蓝色,说明还原性:
I—>SO32—
(方法1)向试管中滴入少量淀粉溶液,振荡试管(2分)
Fe2+>I—(2分)
(方法2)向试管中滴入少量10%KSCN溶液,振荡试管
若不变红色,说明还原性:
I—>Fe2+
若变红色,说明还原性:
Fe2+>I—
8.
.
高考化学实验题汇编与解析
第I卷(选择题共20小题)河东高考补习学校化学组2008-9-6
1.为了净化和收集由盐酸和大理石制得的CO2气体,从下图选择合适的的装置并连接。
合理的是
A.a-a′→d-d′→eB.b-b′→d-d′→gC.c-c′→d-d′→gD.d-d′→c-c′→f
2.(广东文科基础卷67)下列实验不能达到目的的是( )
A.往酸性KMnO4溶液中通入乙烯验证乙烯的还原性B.用四氯化碳萃取碘水中的碘
C.用二氧化锰和稀盐酸反应制取氯气D.加热氯化铵与氢氧化钙固体混合物制取氨气
3.(广东卷4)下列实验能达到预期目的的是
A.向煮沸的1mol·
L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0gSnCl2,用100mL蒸馏水溶解,配制1.0mol·
L-1SnCl2溶液
D.用Cu(OH)2粉末检测尿糖
4.(07江苏)用下列实验装置完成对应的实验
(部分仪器巳省略),能达到实验目的的是)
(A)干燥Cl2(B)吸收HCl
(C)石油的分馏(D)吸收NH3
5.PH试测定溶液pH的正确操作是:
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照。
比色卡对照。
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
6.(江苏卷)6下列装置或操作能达到实验目的的是
7.(江苏卷)9以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000mol·
L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象
8.(北京卷9)下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOHNa2SO4AlCl3②NaHCO3Ba(OH)2H2SO4
③HClNaAlO2NaHSO4④Ca(OH)2Na2CO3BaCl2
A.①②B.②③C.①③④D.①②④
9.(广东理科基础21)下列实验能达到目的的是
A.在容量瓶中加一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
10.从绿色化学的理念出发,下列实验不宜用图7所示装置进行的是
A.不同浓度的硝酸与铜反应B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或盐酸反应D.H2O2在不同催化剂作用下分解
11.(广东理科基础32)用石灰水、小苏打、淀粉和食醋等不能完成的实验是
A.碘盐中碘的检验 B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别 D.鸡蛋壳主要成分的检验
12.(广东理科基础35)下列有关Cl、N、S等非金属元素化合物的说法正确的是
A.漂白粉的成分为次氯酸钙B.实验室可用NaOH溶液处理NO2和HCl废气
C.实验室可用浓硫酸干燥氨气D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
13.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是
A.Ba(OH)2KSCNNaClMg(NO3)2(FeCl3溶液)
B.NaNO3NaHCO3(NH4)2SO3Na2SiO3(H2SO4溶液)
C.NH4BrK2CO3NaICaCl2(AgNO3溶液)
D.NH4ClNaBrCuSO4AlCl3(KOH溶液)
14.(2007年高考江苏卷,实验基本操作)下列有关实验的说法正确的是()
(A)除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
(B)为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
(C)制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
(D)某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
15.(2007年高考理综天津卷)为达到预期的实验目的,下列操作正确的是()
(A)欲配制质量分数为10%的ZnSO4溶液,将10gZnSO4·
7H2O溶解在90g水中
(B)欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
(C)为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
(D)为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
16.右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。
挤压滴管的胶头,下列与实验事实不相符的是()
A.CO2(NaHCO3溶液)/无色喷泉B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉(CuS黑色沉淀)D.HCl(AgNO3溶液)/白色喷泉
17.设计学生实验要注意