内容较全的氧化还原Word格式文档下载.docx
《内容较全的氧化还原Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《内容较全的氧化还原Word格式文档下载.docx(27页珍藏版)》请在冰点文库上搜索。
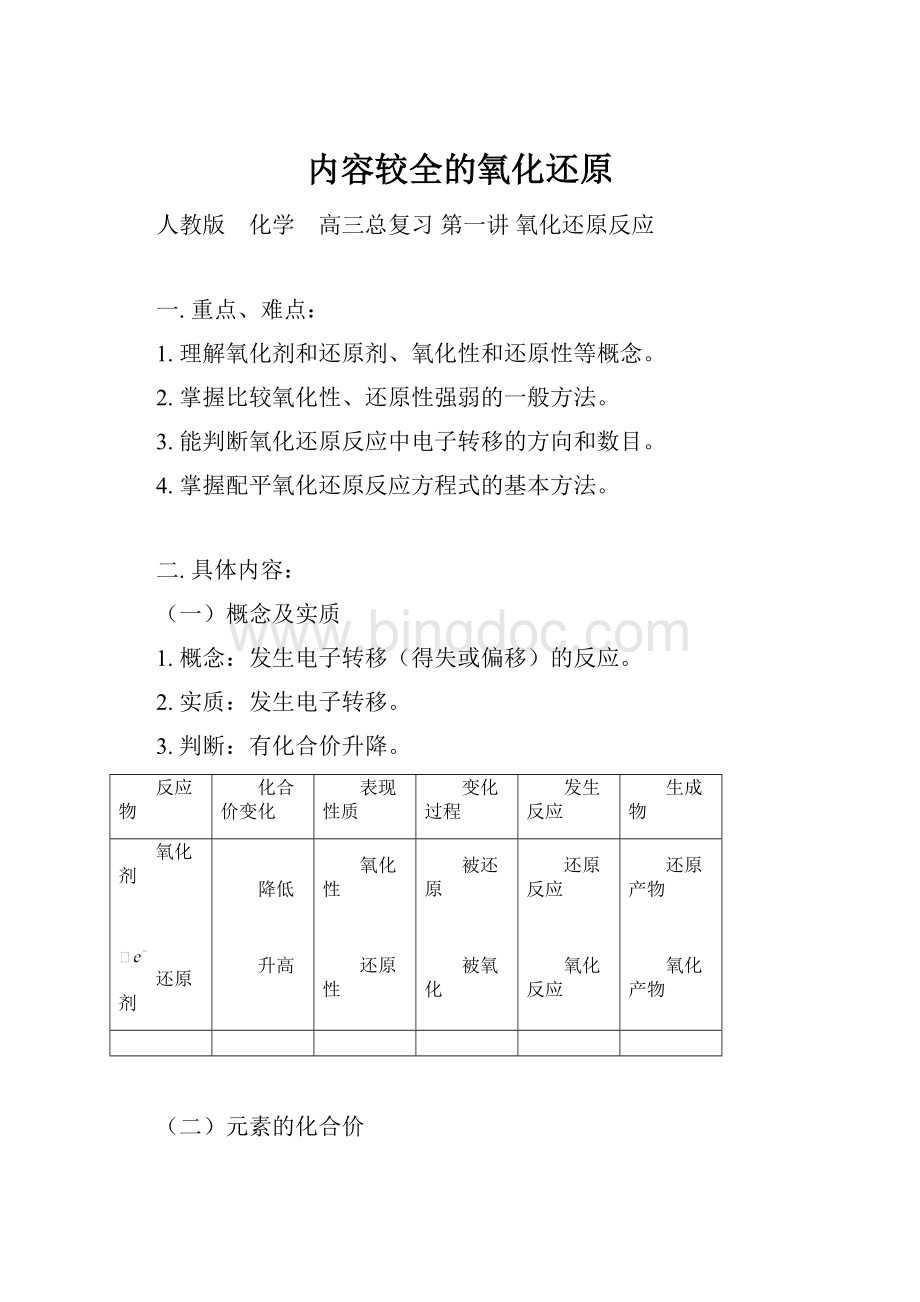
原子得、失电子数
离子的电荷数
元素的化合价
Na+
1(失)
1
+1
Cl-
1(得)
-1
共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。
如HCl:
共用电子对偏向氯原子,氯元素化合价为-1价;
共用电子对偏离氢原子,氢元素化合价为+1价。
5.有机物中:
H:
+1、O:
,再计算C元素平均化合价。
(三)氧化还原反应中电子转移的表示方法
双线桥法
1.双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2.线上标出得失电子的情况及价的升降、被氧化或被还原等内容。
氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。
氧化剂为HCl,还原剂为Zn,氧化产物为ZnCl2,还原产物为H2。
单桥线法
1.箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2.线上只标出转移电子的总数。
(四)氧化还原反应的规律
1.对立统一规律
还原剂、氧化剂相互对立又相互依存。
2.电子守恒规律
还原剂失电子总数=氧化剂得电子总数
3.性质传递规律
氧化剂+还原剂=还原产物+氧化产物
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
4.谁强谁先规律
在溶液中存在多种氧化剂,氧化性强的抢先得电子,先被还原。
在溶液中存在多种还原剂,还原性强的抢先失电子,先被氧化。
5.价态规律
(1)高低规律:
最高价态——只具氧化性
最低价态——只具还原性
中间价态——兼有氧化性和还原性
讨论分析下列氧化还原反应中电子转移的方向和数目,判断氧化产物和还原产物。
①H2S+H2SO4(浓)=S↓+SO2↑+2H2O
②KClO3+6HCl=KCl+3Cl2↑+3H2O
(2)价态归中规律:
同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉”。
(五)重要的氧化剂、还原剂
具体物质
举例
(1)活泼非金属单质
O3、Cl2、Br2、O2
(2)高价的氧化物
NO2、CO2、MnO2
(3)高价的含氧酸
HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
2FeCl3+Cu=2FeCl2+CuCl2
(5)过氧化物
Na2O2、H2O2等
(1)活泼金属单质
Na、Al、Zn、Fe
(2)某些非金属单质
H2、C、Si
(3)低价的氧化物
CO、SO2
(4)低价的酸
HCl、H2S、H2SO3
(5)低价的盐
Na2SO3、FeCl2
2FeCl2+Cl2=2FeCl3
(六)氧化性、还原性强弱的判断方法
1.金属、非金属性
(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
还原性逐渐减弱
氧化性逐渐增强
(2)对于非金属单质
氧化性逐渐减弱
还原性逐渐增强
2.氧化还原反应的性质传递规律
则:
H2>Cu
3.根据元素周期律判断
(1)同周期
左<右还原性:
左>右
(2)同主族
上>下还原性:
上<下
4.根据反应结果判断
(1)同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
Fe+S=FeS
2Fe+3Cl2=2FeCl3
(2)同一物质在相同的条件下,被不同还原剂还原得越彻底,还原剂的还原性越强
HCl+H2SO4(浓)→不反应
HBr+H2SO4(浓)→Br2+SO2↑+H2O
HI+H2SO4(浓)→I2+H2S↑+H2O
5.根据电极反应确定
(1)原电池还原性:
负极>
正极
(2)电解池阴极(氧化性):
先析出>后析出
阳极(还原性):
先反应>后反应
6.从反应所需条件来比较。
一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强。
从反应条件可以看出氧化剂的氧化能力:
KMnO4>MnO2>O2
7.外界条件对氧化性或还原性强弱的影响(同一物质在不同条件下的氧化性或还原性)
(1)物质的浓度越高,氧化性或还原性越强。
(2)温度越高,氧化性或还原性越强。
(3)酸性越强,氧化性越强;
碱性越强,还原性越强。
【典型例题】
[例1](2002年上海理综,16)人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()
A.酸性B.碱性C.氧化性D.还原性
解析:
亚硝酸盐会使Fe2+转变成Fe3+.表现了亚硝酸盐的氧化性,服用维生素C可缓解亚硝酸盐的中毒,说明维生素C还原了亚硝酸盐或使Fe3+又生成了Fe2+,即:
维生素C具有还原性。
答案:
D
思考:
维生素C和Fe2+都具有还原性,二者相比较还原性较强的是_______________?
维生素C的还原性比Fe2+强.因为维生素C能将Fe3+还原为Fe2+,而Fe2+则不能。
(也可根据同一氧化还原反应中,还原剂维生素C的还原性比还原产物Fe2+的还原性强进行分析判断)
[例2](2002年上海23)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为
价):
KCN+2KO+Cl2=KOCN+2KCl+H2O。
被氧化的元素是______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气.请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+KOH+Cl2——CO2+N2+KCl+H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质.至少需液氯_______g。
此题以污水处理为知识背景,考查了氧化还原的概念、氧化还原方程式的配平及氧化还原反应的计算。
(1)在KCN+2KOH+Cl2=KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。
(2)氧化还原方程式的配平,首先要找准变价元素,再利用化合价升降法配平,反应物KOCN中N的价态升高,KOCN为还原剂,氯气为氧化剂。
(3)20L废水中含KCN的物质的量为:
=0.2mol,由两步反应的化学方程式得出关系式:
2KCN~5Cl2,所以需氯气:
0.2mol×
=0.5mol,即35.5g。
(1)碳(或C)
在化学反应KCN+2KOH+Cl2
KOCN+2KCl+H2O中,氧化剂是___________________________;
还原剂是_________________________;
氧化产物是_________________;
还原产物是__________________。
Cl2KCNKOCNKCl
[例3](2001年上海,23)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。
例如:
(1)在上述有编号的步骤中,需用还原剂的是_______________________需用氧化剂的是__________________(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是____________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
(1)在①变化中,Cr元素由+6价变为+3价,化合价降低,需还原剂;
②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+6价,②③⑤都是非氧化还原反应;
在④步变化中,Cr元素由+3价变为+6价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法.先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;
再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
(1)①④
(2)
(3)161422637H2O
写出两性氢氧化物Cr(OH)3分别与盐酸、氢氧化钠反应的化学方程式.
Cr(OH)3+3HCl=CrCl3+3H2O
+NaOH=NaCrO2+2H2O
[例4]1962年,英国青年化学家以巴特莱特将PtF6和Xe按等物质的量在室温下混合后,首次得到含有化学键的稀有气体化合物六氟合铂酸氙:
Xe+PtF6=XePtF6。
有关此反应的叙述中,正确的是()
A.Xe是氧化剂
B.PtF6是氧化剂
C.PtF6是氧化剂又是还原剂
D.该反应不属于氧化还原反应
关键确定XePtF6中各元素的价态,须破除Xe只有0价的思维定势,由于F元素是最活泼的非金属元素,故为-1价,但F不会表现出氧化性.而Pt在PtF6中处于较高价态具备氧化性,故Xe表现还原性,失去电子.
B
[例5]三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。
当加热至一定温度时,它发生如下分解:
C3N3(OH)3=3HNCO
HNCO(异氰酸,其结构是H—N=C=O)能和NO2反应生成N2、CO2和H2O。
(1)写出HNCO和NO2反应的化学方程式.分别指明化合物中哪种元素被氧化?
哪种元素被还原?
指出氧化剂和还原剂,标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.0kgNO2气体所消耗的三聚氰酸的质量。
应首先判断HNCO中N的化合价为-3价,然后才可写出方程式.HNCO的
→
,故其中氮元素被氧化;
NO2中
,其中氮元素被还原.这个问题明确后,其他问题就简单了。
(1)
NO2是氧化剂、HNCO是还原剂;
HNCO中的氮元素被氧化,NO2中的氮元素被还原。
(2)1.0kg×
=1.2kg
[例6]常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO
=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
由此判断下列说法错误的是()
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO
、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
根据有关规律,在同一反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,可得出()
XO
>Z2>B2>A3+
B
[例7]从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;
铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;
Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。
则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
(1)由反应Fe+Cu2+=Fe2++Cu可知氧化性Cu2+>Fe2+,还原性Fe>Cu;
由Cu+2Ag+=2Ag+Cu2+可知,氧化性Ag+>Cu2+,还原性Cu>Ag,故Fe的还原性最强,Ag+氧化性最强。
(2)因Cl2、H+都能将铁氧化,被还原为Cl-、H2,所以Cl2、H+具有氧化性;
由Fe被Cl2、H+氧化的程度可知,Cl2氧化性最强。
(1)FeAg+
(2)H+、
;
[例8]
(1)配平化学方程式
KMnO4+FeS+H2SO4——MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
①标价态。
K
O4+
+H2SO4——
SO4+
(SO4)3+
↓+K2SO4+H2O
②列变化,算出一个氧化剂(或还原剂)“分子”的化合价总共降低(或升高)多少.
氧化剂KMnO4,
↓5价
③等升降。
↑3×
5(系数)5FeS;
↓5×
3(系数)3KMnO4并确定相应的其他元素的系数:
3KMnO4+5FeS+H2SO4——3MnSO4+Fe2(SO4)3+5S↓+K2SO4+H2O
④平系数。
用观察法配平其他物质的系数,一般先配盐,再配酸,最后配水,并核对氧原子数。
⑤验结果。
61024——6510324
(2)配平化学方程式并填空
当KMnO4消耗0.05mol时,产生CO2的体积为__________________L(标准状况下)。
为简化过程,可直接在原题目中进行分析。
首先列出价态变化并使之升降总数相等:
2×
55×
2
↑↓
H2C2O4+KMnO4+H2SO4——CO2+K2SO4+MnSO4+H2O
然后确定参与氧化还原反应的元素的计量数:
5H2C2O4+2KMnO4+H2SO4——10CO2+K2SO4+2MnSO4+H2O
再用观察法配平其他物质的计量数:
5H2C2O4+2KMnO4+3H2SO4=10CO2+K2SO4+2MnSO4+8H2O
最后用O原子个数进行验算。
又根据方程式得:
2KMnO4~10CO2
所以V(CO2)=0.05×
×
22.4=5.6L
523——101285.6
[例9]已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:
819,则该反应的还原产物为__________________。
Cu2S与HNO3物质的量之比为
:
=2:
13,设还原产物中N元素价态降低n价,由得失电子守恒可知:
(1×
2+8)=(13-2×
4)n,解得n=4,其还原产物为N2O。
N2O
[例10]绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1molH2SO4时,分解绿矾的物质的量是__________________。
设分解绿矾的物质的量为x,则生成氧化产物Fe2O3的物质的量为
,生成还原产物SO2物质的量为y,由得失电子守恒可知
1×
2=y×
2,即y=
,由题意可知
x-
=1mol解得x=2mol
2mol
[例11]已知下列变化过程中,0.2molRxO
参加反应时,共转移0.4mol电子。
RxO
+MnO
+H+
RO2+Mn2++H2O
(1)x值为__________。
(2)参加反应的H+的物质的量为__________mol。
由得失电子守恒可知:
0.2molx×
(4-
)=0.4mol
=2
n(MnO
)×
5=0.4mol
)=0.08mol
由电荷守恒可知:
n(H+)×
1-0.08mol×
1-0.2mol×
2=0.08mol×
n(H+)=0.64mol
(1)2
(2)0.64
【模拟试题】
(答题时间:
60分钟)
1.下列反应一定属于氧化还原反应的是()
A.化合反应B.分解反应
C.置换反应D.复分解反应
2.下列变化中,需要加入氧化剂的是()
A.SO2→SO3B.HCl→H2
C.FeCl2→FeCl3D.Fe2O3→Fe
3.按金属活动性顺序由前到后考虑,下列说法中正确的是()
A.单质的还原性逐渐减弱
B.原子的失电子能力逐渐增强
C.对应离子的氧化性逐渐增强
D.对应离子的得电子能力逐渐减弱
4.下列反应中,盐酸只作氧化剂的是()
A.Zn+2HCl=ZnCl2+H2↑
B.
C.Cl2+H2O=HCl+HClO
D.CaCO3+2HCl=CaCl2+H2O+CO2
5.下列叙述中,正确的是()
A.同一反应中,氧化剂的氧化性比氧化产物的氧化性强
B.同一反应中,还原剂的还原性比还原产物的还原性弱
C.由X原子变成X2+的反应是氧化反应
D.由X原子变成X2+,需加入还原剂
6.在3Cl2+8NH3=6NH4Cl+N2反应中,还原性最强的物质是()
A.Cl2B.NH3C.NH4ClD.N2
7.下列关于氧化还原反应的叙述中正确的是()
A.金属单质在反应中只作为还原剂
B.非金属单质在反应中只作为氧化剂
C.金属原子失电子越多,还原性越强
D.Cu2+比Fe2+氧化性强,Fe比Cu还原性强
8.一个A原子转移两个电子给两个B原子,下列说法中正确的是()
A.形成化合物AB2,A是氧化剂
B.形成化合物A2B,A被还原
C.形成化合物AB2,B被还原
D.形成化合物AB2,B有氧化性
9.某反应的化学方程式为:
aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为()
A.N2B.NOC.NO2D.NH4Cl
10.有反应:
依据上述方程式,下列微粒氧化能力排列顺序正确的是()
A.
B.
C.
D.
11.在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3gCl2参加反应,则被氧化的NH3的质量为()
A.13.6gB.10.2gC.6.8gD.3.4g
12.
离子在一定条件下可把Mn2+氧化成
,若反应后
变成
,又知反应中氧化剂与还原剂的离子个数比为5:
2,则
中R元素的化合价为()
A.+3B.+5C.+6D.+7
13.一定条件下硝酸铵受热分解的未配平化学方程式为:
NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为()
A.1:
1B.5:
4C.5:
3D.3:
5
14.下列叙述中,正确的是()
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.由X变为X2+的化学反应是氧化反应
15.下列对盐酸的有关性质叙述正确的是()
A.有酸性,没有氧化性和还原性
B.有酸性和氧化性,没有还原性
C.有酸性和还原性,没有氧化性
D.有氧化性和还原性,还有酸性
16.配平下列氧化还原反应方程式。
①P+CuSO4+H2O
Cu3P+H3PO4+H2SO4
②H2PO
+Ag++H2O
H3PO4+Ag↓+H2↑
③Fe2++O2+H2O
Fe3++Fe(OH)3↓
④S+Ca(OH)2
CaS2O3+CaS·
Sx+H2O
17.配平下列氧化还原反应方程式,并标明电子转移的方向和数目。
①H2S+H2SO3
S↓+H2O
氧化产物是_____________,还原产物是_____________,二者质量比是_____________.
②Cl2+KOH
KCl+KClO3+H2O
氧化剂是_____________,还原剂是____________,二者物质的量之比是____________.
③KClO3+HCl
KCl+Cl2↑+H2O
HCl的作用是_____________,被还原的元素是________________,当反应过程中有3mol电子转移时,可产生氯气_____________mol。
④KIx+Cl2+H2O
KCl+HIO3+HCl,若KIx与Cl2的化学计量数之比为1:
8,则x=_____________。
18.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化,_____________是氧化剂。
(2)用短线标出电子转移方向和总数。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
19.①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
③对比①和②实验所得的结果,将I2、ClO-、SO
按氧化性由强到弱的顺序排列为___________________。
20.K2Cr2O7是一种橙红色且具有强氧化性的化合物,当它被还原成三价铬时,颜色有明显变化.据此,当交通警察发现汽车行驶反常时,就上前拦车,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。
若发现硅胶变色达到一定程度,即证明司机是_________。
这是因为K2Cr2O7跟_________(写化学名称)发生了反应.反应中,当有0.06