高考化学一轮复习 热点专题突破7 化学综合实验题的突破方法练习 新人教版Word下载.docx
《高考化学一轮复习 热点专题突破7 化学综合实验题的突破方法练习 新人教版Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学一轮复习 热点专题突破7 化学综合实验题的突破方法练习 新人教版Word下载.docx(11页珍藏版)》请在冰点文库上搜索。
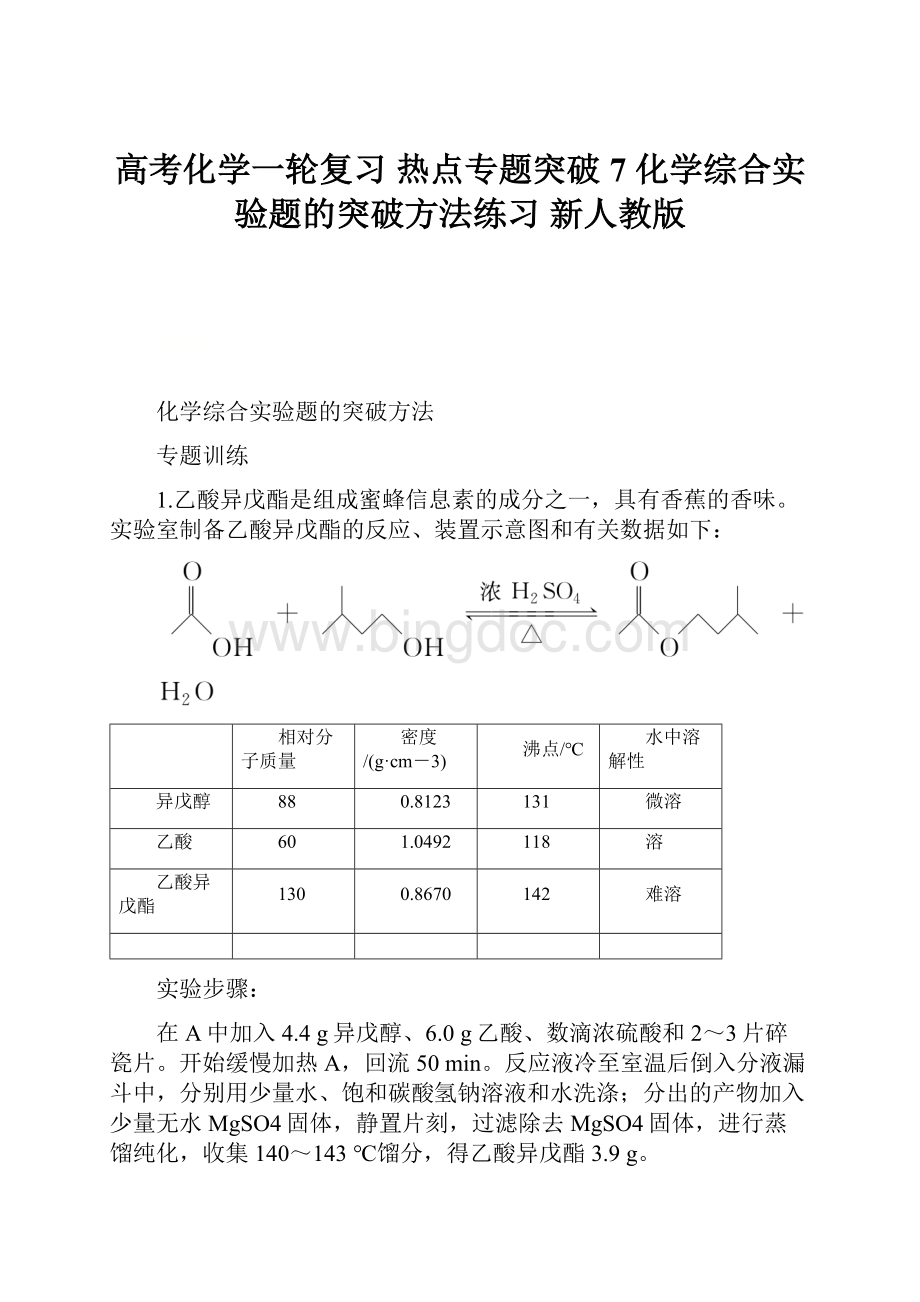
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。
开始缓慢加热A,回流50min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是____________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_______________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% D.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是
____________________________________________________。
答案
(1)球形冷凝管
(2)洗掉大部分硫酸和乙酸'
洗掉碳酸氢钠
(3)d'
(4)提高醇的转化率'
(5)干燥'
(6)b'
(7)c
(8)高'
会收集少量未反应的异戊醇
解析
(1)仪器B为球形冷凝管。
(2)第一次水洗的目的是除去作催化剂的硫酸和过量的乙酸,接下来用饱和碳酸氢钠溶液进一步除去残留的少量乙酸,第二次水洗的目的是除去过量的饱和碳酸氢钠溶液。
(3)洗涤、分液后有机层密度小,在上面,密度大的水层在下面,需将水层从分液漏斗下口放出,然后将有机层从分液漏斗上口倒出,d项正确。
(4)制备乙酸异戊酯的反应为可逆反应,加入过量的乙酸,能提高醇的转化率,从而提高乙酸异戊酯的产率。
(5)加入少量无水MgSO4能除去有机层中的少量水,起到干燥作用。
(6)蒸馏实验中温度计水银球需和蒸馏烧瓶支管口在同一高度,而c中不应该用球形冷凝管,球形冷凝管一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底,故b正确。
(7)根据题中化学方程式及所给各物质的量,可知实验中异戊醇完全反应,理论上应生成乙酸异戊酯6.5g,实验中实际生成乙酸异戊酯3.9g,故乙酸异戊酯的产率为3.9/6.5×
100%=60%。
(8)若从130℃便开始收集馏分,则收集得到的是乙酸异戊酯和少量未反应的异戊醇的混合物,导致所测出的实验产率偏高。
2.[2017·
石家庄模拟]某化学兴趣小组为研究过氧化钠与SO2的反应情况,进行如下探究。
(1)[提出假设]
向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设。
假设一:
反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:
反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:
反应后固体中__________________________,证明SO2部分被氧化。
(2)[定性研究]
为验证假设三,该小组进行如下研究,请你完善表中内容。
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
取适量反应后的固体置于试管中,___________________________________________________
______________________________________________________________________________________________________________
(3)[定量研究]
通过测量气体的体积判断发生的化学反应,实验装置如图所示:
①装置B中所盛装试剂的名称为________。
②装置D的作用是___________________________________。
③请画出装置E。
④实验测得装置C中过氧化钠的质量增加了m1g,装置D的质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),利用上述有关测量数据将下列表格补充完整。
SO2被氧化的程度
V与m1或m2的关系
未被氧化
—
完全被氧化
V=0
部分被氧化
________
答案
(1)既有Na2SO3,又有Na2SO4
(2)
加少量水溶解,加入BaCl2溶液,再加入稀盐酸
加入BaCl2溶液有白色沉淀产生,加入稀盐酸沉淀部分溶解。
证明原固体中既有Na2SO3,又有Na2SO4
(其他合理答案均可。
如先加足量盐酸,再加BaCl2溶液)
(3)①浓硫酸 ②吸收未反应的SO2
③
④0<V<
或m1>
解析
(1)结合假设一和假设二,很容易确定假设三是反应后固体为Na2SO3和Na2SO4的混合物。
(2)证明SO2部分被氧化,其反应可能为①2Na2O2+2SO2===2Na2SO3+O2,②Na2O2+SO2===Na2SO4。
为证明固体为Na2SO3和Na2SO4的混合物,实验时应取少量固体溶解于水后再加入试剂,并且现象与结论要对应。
(3)定量研究中,装置A制得的SO2气体要先干燥,故装置B中所盛试剂为浓硫酸,SO2在装置C中与过氧化钠反应,过量的SO2被装置D中的碱石灰吸收。
用装置E收集可能生成的O2并测量其体积。
若SO2完全被氧化,只发生反应②,V=0;
若SO2未被氧化,只发生反应①,利用装置C中过氧化钠的质量增加了m1g,根据差量法,可求得V=
(此处注意m2g是一个干扰数据,因为无法知道装置A中生成SO2气体的量);
若SO2部分被氧化时,反应①②均有发生,0<
V<
。
3.高纯MnCO3是广泛用于电子行业的强磁性材料。
MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2===MnSO4+H2O。
下列措施中,目的是加快化学反应速率的是________(填标号)。
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)===2NaHSO4+SO2↑+H2O。
选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
③若用空气代替N2进行实验,缺点是__________________(酸性环境下Mn2+不易被氧化)。
(2)制备MnCO3固体:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②……
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):
_______________________________________________________
(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:
_______________________
____________________________________________________________
[已知Ka2(H2SO4)=1.1×
10-2]。
答案
(1)①AB ②abef ③空气中的O2能氧化H2SO3,使SO2利用率下降
(2)水、盐酸酸化的BaCl2溶液、乙醇
(3)向Na2CO3溶液中滴加稍过量NiSO4溶液,生成浅绿色沉淀,再滴加几滴MnSO4溶液,沉淀变成白色(其他合理答案也可)
(4)用pH计测量Na2SO4溶液的pH大于7(其他合理答案也可)
解析
(1)①反应物是H2SO3、MnO2,MnO2加入前先研磨、搅拌均可加快反应速率,而提高混合气中N2比例会使SO2浓度降低,反应速率减慢,故A、B项正确,C项错误。
②制备SO2用装置b,装置a提供N2,用装置e将SO2和N2混合,用装置f吸收尾气。
③若用空气代替N2进行实验,则空气中的O2能氧化H2SO3,SO2的利用率降低。
(2)步骤②为过滤,用少量水洗涤2~3次;
然后用盐酸酸化的BaCl2溶液检验SO
,从而判断沉淀是否洗涤干净;
最后用少量C2H5OH洗涤。
(4)若H2SO4的第二步电离不完全,则第二步电离产生的SO
能发生水解,Na2SO4溶液的pH大于7。
4.草酸(乙二酸)存在于自然界的植物中,其K1=5.4×
10-2,K2=5.4×
10-5。
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。
草酸晶体(H2C2O4·
2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是________________________,由此可知草酸晶体分解的产物中有________。
装置B的主要作用是__________________________________________。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置中,依次连接的合理顺序为A、B、________。
装置H反应管中盛有的物质是________。
②能证明草酸晶体分解产物中有CO的现象是_____________。
(3)设计实验证明:
①草酸的酸性比碳酸的强____________________。
②草酸为二元酸________________________________________。
答案
(1)有气泡逸出、澄清石灰水变浑浊'
CO2'
冷凝(水蒸气、草酸等),防止草酸进入装置C反应生成沉淀,干扰CO2的检验
(2)①F、D、G、H、D、I'
CuO'
②H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
(3)①向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
②用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍
解析
(1)结合题给装置中装的药品知,草酸晶体的分解产物中有二氧化碳气体,所以装置C中观察到有气泡逸出,澄清石灰水变浑浊。
通入澄清石灰水前,气体进行了冷却,由题中信息知,草酸钙难溶于水,若气体不冷却,则挥发出的草酸蒸气也会进入装置C,与澄清石灰水反应生成沉淀,会干扰CO2的检验。
(2)由题给实验仪器和药品知,CO应与装置H中固体反应,可推测装置H中固体为CuO,CO还原氧化铜生成Cu和CO2气体,然后把CO2通入到D中,结合装置H和装置D中的现象可判断草酸晶体的分解产物中是否含有CO。
检验CO之前应先除去CO中混有的CO2,连接顺序为A、B、F、D、G、H、D、I。
(3)①向盛有碳酸氢钠的试管中加入草酸溶液,若有气泡产生,则证明草酸的酸性强于碳酸。
②证明草酸为二元酸可以用氢氧化钠标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍。