高中化学知识点铁及其化合物Word文档格式.docx
《高中化学知识点铁及其化合物Word文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学知识点铁及其化合物Word文档格式.docx(14页珍藏版)》请在冰点文库上搜索。
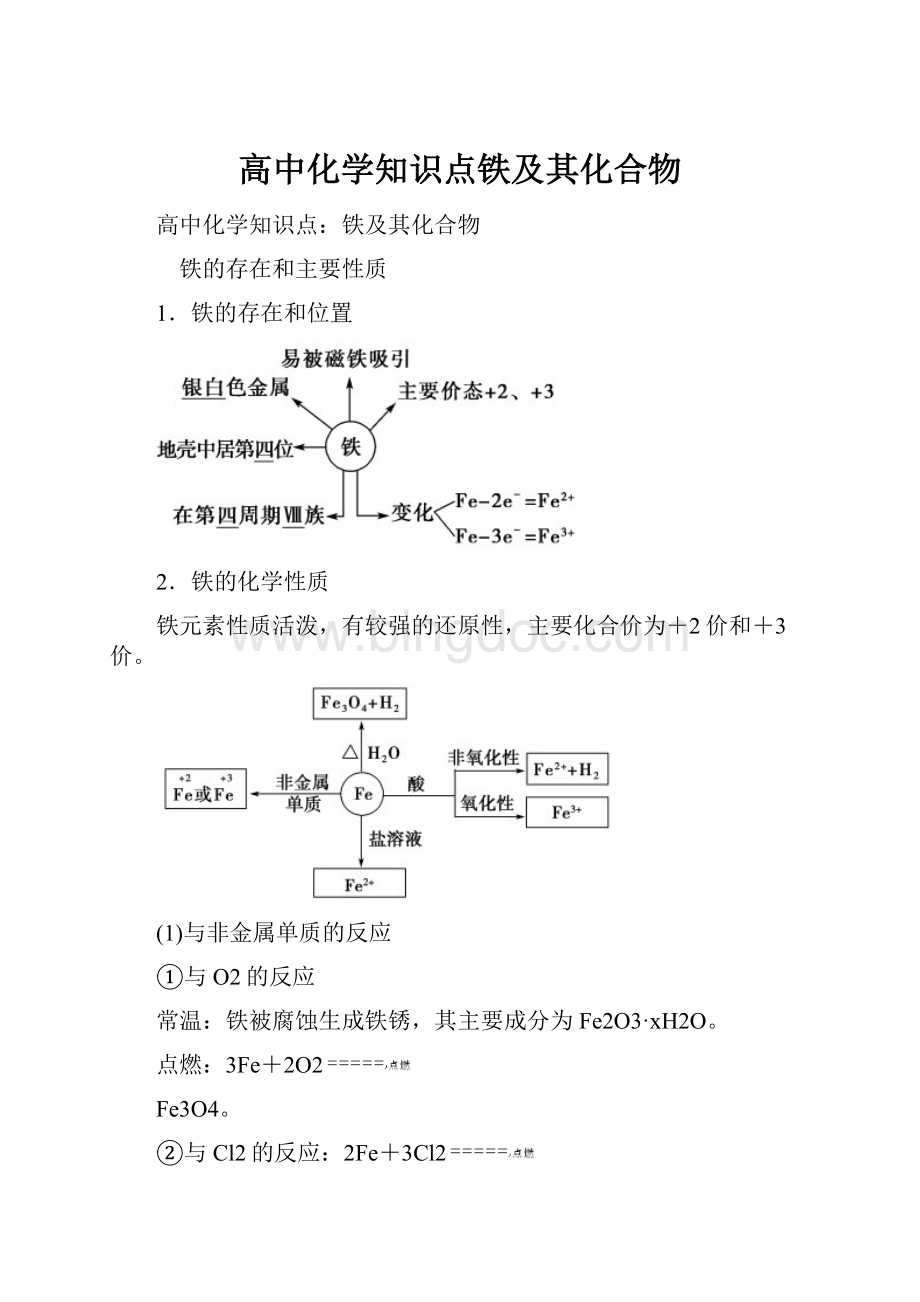
===Fe3++NO↑+2H2O。
(4)与某些盐溶液的反应
①与CuSO4溶液反应的离子方程式:
Fe+Cu2+===Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:
Fe+2Fe3+===3Fe2+。
铁的重要化合物
1.铁的氧化物
氧化亚铁(FeO)
氧化铁(Fe2O3)
四氧化三铁(Fe3O4)
俗名
铁红
磁性氧化铁
色态
黑色粉末
红棕色粉末
黑色晶体
铁元素价态
+2
+3
+2、+3
说明:
①FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式:
FeO+2H+===Fe2++H2O、
Fe2O3+6H+===2Fe3++3H2O、
Fe3O4+8H+===2Fe3++Fe2++4H2O。
②FeO与硝酸反应的化学方程式:
3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O。
2.铁的氢氧化物
Fe(OH)2
Fe(OH)3
白色固体
红褐色固体
与H+反应
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
二者的关系
在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe(OH)2、Fe(OH)3的制备可利用相应亚铁盐、铁盐与碱液反应。
3.亚铁盐与铁盐
(1)亚铁盐
含有Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有还原性,Fe2+与Zn、Cl2反应的离子方程式分别为:
Zn+Fe2+===Zn2++Fe、2Fe2++Cl2===2Fe3++2Cl-。
(2)铁盐
①氧化性
含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为:
2Fe3++Fe===3Fe2+、2Fe3++Cu===2Fe2++Cu2+。
②特性
含有Fe3+的盐溶液遇到KSCN溶液时变成红色。
1.易误诊断(正确的打“√”,错误的打“×
”)。
(1)铁元素性质活泼,自然界中的铁几乎都是以化合态形式存在,只有在陨石中有游离态的铁元素( )
(2)过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行( )
(3)铁能被磁铁吸引,则任何金属都能被磁铁吸引( )
(4)过量的铁粉与稀硝酸溶液反应的离子方程式为
Fe+4H++NO
===Fe3++NO↑+2H2O( )
(5)将NaOH溶液滴入FeSO4溶液中,可以看到稳定的白色沉淀( )
(6)FeCl2溶液保存时加Fe粉的目的是防止Fe2+被还原( )
(7)FeCl2溶液中加入KSCN溶液不变红,加入氯水后溶液变红色( )
(8)FeCl3溶液中加入KSCN溶液变红,再加入足量Fe,红色消失( )
【答案】
(1)√
(2)√ (3)×
(4)×
(5)×
(6)×
(7)√ (8)√
2.下列物质反应后一定有+3价铁生成的是________。
(填序号)
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中
【答案】 ①②④
3.将Fe3O4投入过量的盐酸中,所得溶液中含的金属阳离子有________,向该溶液中投入足量的Fe粉,发生反应的离子方程式为_______________________________。
【答案】 Fe2+、Fe3+ Fe+2Fe3+===3Fe2+、Fe+2H+===Fe2++H2↑
Fe→Fe3O4的2个反应:
Fe3O4
Fe3O4+4H2
铁的3种氧化物,2种氢氧化物,2种离子的颜色:
FeO与Fe3O4均为黑色,Fe2O3为红棕色;
Fe(OH)2为白色,Fe(OH)3为红褐色;
Fe2+为浅绿色,Fe3+为棕黄色。
铁的3种价态转化
2个特殊现象:
①Fe(OH)2→Fe(OH)3是白色→灰绿色→红褐色;
②Fe3+遇SCN-,溶液变红色。
“铁三角”转化关系及其应用
1.“铁三角”中的转化关系
2.主要应用
(1)除杂:
主要物质
杂质
除杂方法
Fe2+
Fe3+
加过量铁屑后过滤
FeCl3
FeCl2
加氯水或H2O2
Cu2+
Fe
Al
加过量强碱溶液后过滤
Fe2O3
Al2O3、SiO2
(2)判断离子共存:
NO
(H+)、ClO-、MnO
(H+)。
S2-、I-、SO
。
Fe2+、Fe3+
HCO
、CO
等水解相互促进的离子
(3)盐溶液的配制与保存:
(1)Fe2+具有较强的还原性,Fe3+水解能力强,实际上pH>
4时,Fe3+几乎完全生成Fe(OH)3沉淀。
(2)欲除去某溶液中含有的Fe2+杂质时,一般先向溶液中加入氧化剂(如H2O2),使Fe2+被氧化为Fe3+,然后加入溶于酸的难溶物调节pH,使Fe3+转化为Fe(OH)3沉淀除去。
(2013·
北京高考,节选)用含有Al2O3、SiO2和少量FeO·
xFe2O3的铝灰制备Al2(SO4)3·
18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________________________。
(2)将MnO
氧化Fe2+的离子方程式补充完整:
MnO
+
Fe2++
______===
Mn2++
Fe3++
________
(3)已知:
生成氢氧化物沉淀的pH
Al(OH)3
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
注:
金属离子的起始浓度为0.1mol·
L-1
根据表中数据解释步骤Ⅱ的目的:
____________________________________。
【解析】
(1)本小题考查常见的离子反应。
(2)利用得失电子守恒,1个MnO
反应转移5个电子,可知Fe2+、Fe3+的化学计量数为5,再结合电荷守恒,可知缺项为H+和H2O,最后利用原子守恒配平。
(3)由数据可知,Fe3+沉淀完全时,pH=2.8,由题干“调节溶液的pH约为3”可知,此时得到的沉淀为Fe(OH)3,而Fe2+、Al3+共存于滤液中。
因此,可知步骤Ⅱ是用KMnO4将Fe2+氧化为Fe3+,使Fe3+全部转化为Fe(OH)3沉淀,从而除去铁元素。
【答案】
(1)Al2O3+6H+===2Al3++3H2O
(2)5 8H+ 5 4H2O (3)pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
考向1 铁及其化合物的主要性质
1.(2012·
高考组合题)下列叙述正确的是( )
A.(山东高考)Fe与稀HNO3,稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
B.(天津高考)Fe在足量Cl2中燃烧生成FeCl2和FeCl3
C.(广东高考)Fe3+有氧化性可以解释FeCl3溶液可用于回收废旧电路板中的铜
D.(江苏高考)Fe2O3
FeCl3(aq)
无水FeCl3在给定的条件下能实现转化
【解析】 A项,Fe与稀HNO3反应不是置换反应;
B项,反应只生成FeCl3;
D项,FeCl3(aq)
无水FeCl3,不能转化。
【答案】 C
考向2 Fe3+、Fe2+、Cu、Fe的共存问题分析
2.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含铜
【解析】 氧化性Fe3+>
Cu2+,加入Fe先还原Fe3+,然后再还原Cu2+。
考向3 铁及其化合物的有关计算
3.将1.12g铁粉加入25mL2mol·
L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C.Fe2+和Fe3+物质的量之比为5∶1
D.氧化产物和还原产物的物质的量之比为2∶5
【解析】 n(Fe)=0.02mol,n(Fe3+)=2mol/L×
0.025L=0.05mol;
根据Fe+2Fe3+===3Fe2+可知Fe3+剩余0.01mol,生成Fe2+为0.06mol。
【答案】 B
Fe2+、Fe3+的检验方法
鉴别方法
直接观色
浅绿色
棕黄色
利用显色反应
与KSCN溶液
无现象
显红色
利用Fe3+的氧化性
与铜片
Cu溶解,溶液变为蓝绿色
与KI淀粉溶液
溶液变蓝
利用Fe2+的还原性
与溴水
溴水褪色
与酸性KMnO4溶液
紫色褪去
利用加碱生成沉淀反应
Fe2++2OH-===Fe(OH)2↓白色→灰绿色→红褐色
Fe3++3OH-===Fe(OH)3↓红褐色沉淀
(2012·
山东高考节选)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
a.浓H2SO4 b.稀HNO3
c.NaOH溶液d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是________(注明试剂、现象)。
【解析】
(1)冰铜(mCu2S·
nFeS)加入石英砂并通入空气焙烧生成泡铜(Cu2O、Cu)、熔渣和SO2气体(A)。
SO2是一种酸性氧化物,可用NaOH溶液或氨水吸收。
(2)溶液中滴加KSCN溶液呈红色,说明含有Fe3+。
可利用Fe2+的还原性来检验溶液中其是否存在,加入酸性KMnO4溶液,KMnO4溶液褪色,说明还存在Fe2+。
【答案】
(1)cd
(2)Fe3+ 取少量溶液,滴加KMnO4溶液,KMnO4褪色
(1)检验Fe2+时不能先加氯水后加KSCN溶液;
当溶液的浓度较稀时,利用观察法或加NaOH溶液的方法都不宜检验Fe2+和Fe3+的存在。
(2)检验Fe2+和Fe3+混合溶液时,要分两次分别检验Fe2+和Fe3+,检验Fe2+时要选择酸性高锰酸钾溶液,检验Fe3+时最好选择KSCN溶液。
考向1 铁与其他金属离子的检验
4.(2014·
成都模拟)某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
【解析】 开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,说明含Fe2+不含Fe3+,可能含Mg2+。
【答案】 D
考向2 铁离子、亚铁离子的检验顺序
5.要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作的最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4(H+)溶液 ③加入少量KSCN溶液
A.①③ B.③②
C.③①D.①②③
【解析】 先用KSCN溶液排除Fe3+,再加氧化剂,过量KMnO4(H+)为紫红色,现象不明显。
Fe2+和Fe3+的转化
高考母题
(2013·
江苏高考节选)已知
金属离子
开始沉淀的pH
沉淀完全的pH
1.1
3.2
Al3+
3.0
5.0
5.8
8.8
从硫铁矿烧渣(成分为Fe2O3、Al2O3、SiO2)出发,补充完整由烧渣制备FeSO4溶液的步骤:
向一定量烧渣中加入足量的稀H2SO4充分反应,___________________________________________________,得到FeSO4溶液。
【答案】 “过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
教材溯源
Fe3+和Fe2+的转化
(人教必修1P61)
在盛有2mLFeCl3溶液的试管中,加入少量铁粉,振荡试管。
充分反应后,滴入几滴KSCN溶液(如左图),观察并记录实验现象。
把上层清液倒入另一试管,再加入几滴氯水(如右图),又发生了什么变化?
Fe3+被还原(左),
Fe2+被氧化(右)
命题展望
Fe2+、Fe3+的相互转化是高考的重要考点,高考命题专家以教材实验Fe2+、Fe3+转化为题源进行多角度设计,高考还可能从以下进行命题:
1.如何除去FeCl3中的Fe2+?
【提示】 加入氯水或H2O2溶液。
2.如何除去FeCl2溶液中的Fe3+?
【提示】 加入铁屑。
3.通过什么反应说明氧化性Cl2>
Fe3+?
【提示】 2Fe2++Cl2===2Fe3++2Cl-
4.写出FeO与稀HNO3反应的离子方程式
【提示】 3FeO+10H++NO
===3Fe3++NO↑+5H2O
5.如何除去MgCl2溶液中的少量Fe3+?
【提示】 加入过量的Mg、MgO、Mg(OH)2、MgCO3中之一,充分反应,然后过滤。
6.Fe2+与NO
能否大量共存?
若向其中再加入少量盐酸,情况又会如何?
【提示】 Fe2+与NO
能大量共存,但在酸性条件下,NO
能将Fe2+氧化成Fe3+而不能大量共存。