元素及其无机化合物Word文件下载.docx
《元素及其无机化合物Word文件下载.docx》由会员分享,可在线阅读,更多相关《元素及其无机化合物Word文件下载.docx(31页珍藏版)》请在冰点文库上搜索。
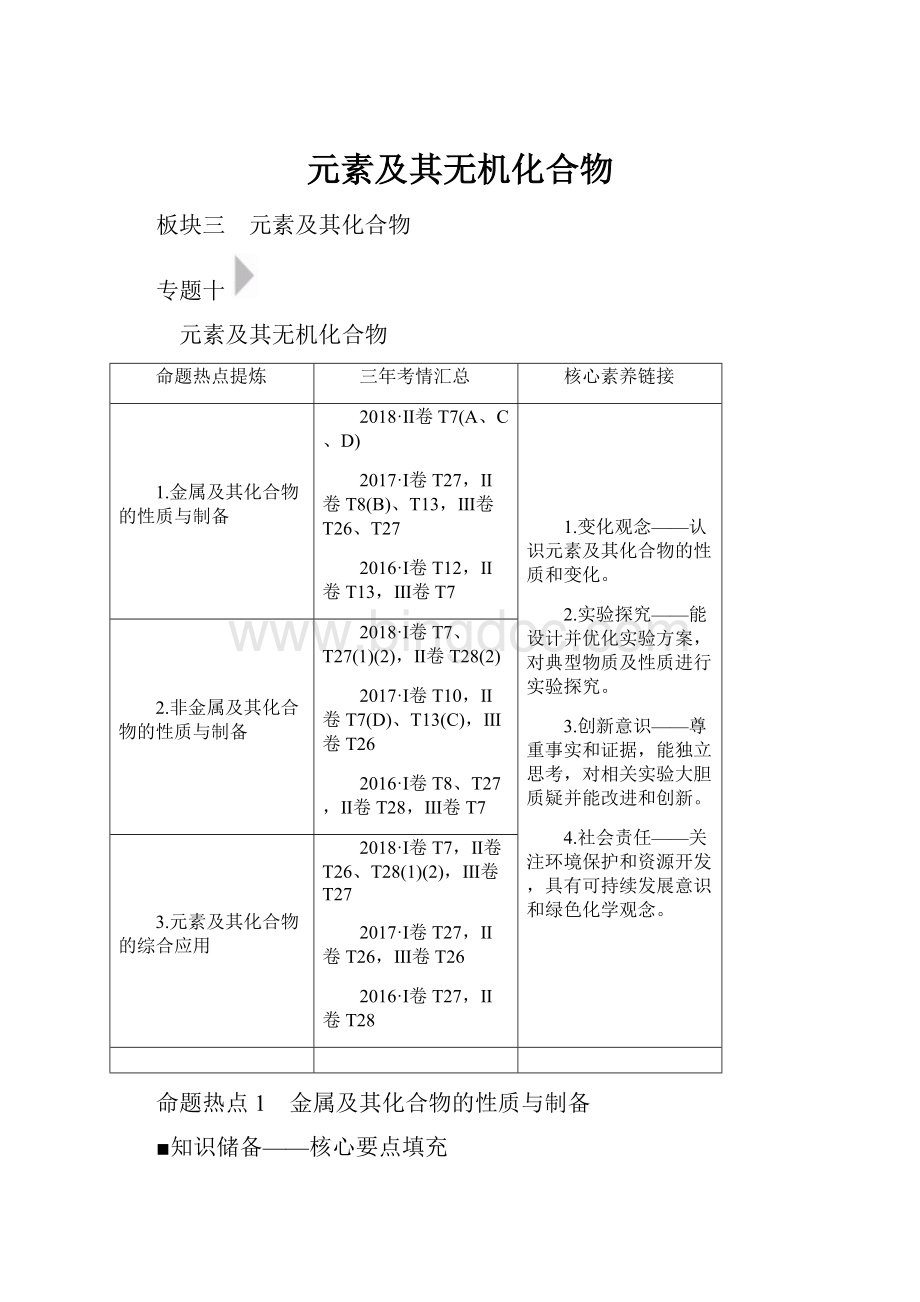
④2Cl-+2H2O
2OH-+H2↑+Cl2↑;
⑥Na++NH3+CO2+H2O===NaHCO3↓+NH
;
⑦CO
+CO2+H2O===2HCO
。
(2)镁及其化合物之间的转化关系
写出图中标号的化学方程式:
①3Mg+N2
Mg3N2;
②2Mg+CO2
2MgO+C;
③Mg3N2+8H2O===3Mg(OH)2+2NH3·
H2O;
④Mg+2H2O
Mg(OH)2+H2↑。
(3)铝及其化合物之间的转化关系
①2Al+2NaOH+2H2O===2NaAlO2+3H2↑;
⑥2Al+Fe2O3
2Fe+Al2O3。
②Al2O3+2OH-===2AlO
+H2O;
③Al3++3NH3·
H2O===Al(OH)3↓+3NH
④Al(OH)3+OH-===AlO
+2H2O;
⑤AlO
+CO2+2H2O===Al(OH)3↓+HCO
或2AlO
+CO2+3H2O===2Al(OH)3↓+CO
(4)铁及其化合物之间的转化关系
①3Fe+4H2O(g)
Fe3O4+4H2;
⑤4Fe(OH)2+O2+2H2O===4Fe(OH)3。
②Fe2O3+6H+===2Fe3++3H2O;
③Cu+2Fe3+===2Fe2++Cu2+;
④2Fe2++H2O2+2H+===2Fe3++2H2O。
(5)铜及其化合物之间的转化关系
①2Cu+O2+CO2+H2O===Cu2(OH)2CO3;
②Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
③Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O。
2.金属及其化合物的特性及应用
(1)Na2O2遇CO2或H2O可产生O2,可用于呼吸面具中供氧剂。
(2)碳酸氢钠可用于胃酸中和剂的原理是(写出离子方程式)HCO
+H+===CO2↑+H2O,但胃溃疡者慎用。
(3)纯碱清洗油污的原理是(写离子方程式)CO
+H2O
HCO
+OH-。
(4)明矾和铁盐作净水剂的原理是在水中生成胶体,吸附悬浮物后沉降。
(5)侯氏制碱法涉及的物质有NaCl、NH3、CO2、H2O。
(6)FeCl3溶液可用于腐蚀印刷Cu电路板的化学方程式为2FeCl3+Cu===CuCl2+2FeCl2。
(7)CuSO4可用于杀菌消毒的原因是Cu2+使蛋白质变性。
(8)泡沫灭火器中的两试剂是NaHCO3和Al2(SO4)3溶液,反应的化学方程式为6NaHCO3+Al2(SO4)3===2Al(OH)3↓+6CO2↑+3Na2SO4。
■真题再做——感悟考法考向
1.下列关于金属及其化合物的叙述正确的是________(填序号)。
①(2017·
全国卷Ⅱ)乙醇和水都可与金属钠反应产生可燃性气体,说明乙醇分子中的氢与水分子中的氢具有相同的活性
②(2017·
全国卷Ⅱ)将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,说明CO2具有氧化性
③(2017·
全国卷Ⅱ)向2mL0.1mol·
L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液,黄色逐渐消失,加KSCN溶液颜色不变,说明还原性:
Fe>Fe2+
④(2016·
全国卷Ⅲ)Al2(SO4)3和小苏打反应应用于泡沫灭火器灭火
⑤(2016·
全国卷Ⅱ)将MgCl2溶液加热蒸干制备无水MgCl2
⑥(2016·
全国卷Ⅰ)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
⑦(2016·
全国卷Ⅱ)将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑧(2016·
全国卷Ⅱ)除去Cu粉中混有CuO的方法是加入稀硝酸溶解、过滤、洗涤、干燥
⑨(2016·
全国卷Ⅲ)因为铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
⑩(2015·
全国卷Ⅱ)钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为NA
⑪(2015·
全国卷Ⅱ)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡
⑫(2015·
全国卷Ⅰ)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明铝的熔点较低
⑬(2015·
全国卷Ⅱ)浓硝酸滴入用砂纸打磨过的铝条中,产生红棕色气体
⑭(2015·
全国卷Ⅱ)氯化铝溶液滴入浓NaOH溶液中,产生大量白色沉淀
⑮(2015·
全国卷Ⅰ)将铜粉加入1.0mol·
L-1Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现
⑯(2018·
全国卷Ⅱ)碳酸钠可用于去除餐具的油污
⑰(2018·
全国卷Ⅱ)Al(OH)3可用于中和过多胃酸
【答案】 ②③④⑥⑩⑯⑰
2.(2016·
全国卷Ⅱ,节选)某班同学用如下实验探究Fe2+、Fe3+的性质。
回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·
L-1的溶液。
在FeCl2溶液中需加入少量铁屑,其目的是______________________________
_________________________________________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。
FeCl2溶液与氯水反应的离子方程式为_________________________________________________________
【解析】
(1)Fe2+具有很强的还原性,易被空气中的O2氧化为Fe3+,在FeCl2溶液中加入少量铁屑,可防止Fe2+被氧化。
(2)Fe2+被氧化为Fe3+,Cl2被还原为Cl-,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
【答案】
(1)防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2Cl-
[误区警示] 金属及其化合物的性质及其应用的8大误区
(1)溶液中加入KSCN溶液,溶液变红色,只能说明溶液中含有Fe3+,无法证明是否含有Fe2+。
(2)既能与酸反应生成气体,又能与碱反应生成气体的物质不一定是Al,还有可能是(NH4)2CO3或NH4HCO3等。
(3)Fe与Cl2反应,不论Cl2是否过量,产物均为FeCl3而不是FeCl2。
(4)Na在氧气中燃烧,不论氧气是否足量,产物均为Na2O2。
(5)常温下,浓H2SO4和浓HNO3遇Fe、Al钝化,表现了浓H2SO4和浓HNO3的强氧化性,不能认为不反应。
(6)明矾、铁盐净水的原理是形成胶体吸附悬浮物沉降而不能杀菌消毒。
(7)Fe与HNO3反应最终以Fe2+还是Fe3+的形式存在,决定于二者的相对量。
(8)Fe3+与Cu反应不能认为Cu比Fe活泼,因该反应不是置换反应。
■模拟尝鲜——高考类题集训
1.(2018·
合肥调研)在给定条件下,下列物质的转化不能实现的是( )
A.Fe2O3
FeCl3溶液
无水FeCl3
B.饱和NaCl溶液
NaHCO3
Na2CO3
C.Al2O3
NaAlO2溶液
Al(OH)3
D.MgCl2溶液
Mg(OH)2
MgO
A [加热会促进FeCl3水解,且水解生成的HCl易挥发,故最终得不到无水FeCl3,A项符合题意。
向饱和NaCl溶液中先通入NH3,后通入CO2,发生反应:
NaCl+H2O+CO2+NH3===NaHCO3↓+NH4Cl,过滤可得到NaHCO3,NaHCO3受热分解即可得到Na2CO3,B项不符合题意。
Al2O3与NaOH溶液反应可生成NaAlO2溶液:
Al2O3+2NaOH===2NaAlO2+H2O,向NaAlO2溶液中通入CO2可生成Al(OH)3沉淀,C项不符合题意。
MgCl2溶液和石灰乳能发生复分解反应得到Mg(OH)2,Mg(OH)2煅烧分解生成MgO,D项不符合题意。
]
2.(2018·
湘东五校联考)向CuSO4溶液中逐滴加入碘化钾溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变棕色,再向反应后的溶液中加入过量SO2,溶液变无色。
则下列说法正确的是( )
A.通入22.4LSO2参加反应时,有2NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加碘化钾溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,微粒的氧化性:
Cu2+>I2>SO2
D [题中没有指明温度和压强,22.4LSO2的物质的量无法确定,故转移电子数无法确定,A项错误;
通入SO2时发生反应:
SO2+I2+2H2O===H2SO4+2HI,SO2将I2还原为I-,体现了SO2的还原性,B项错误;
滴加碘化钾溶液时,CuSO4转化为CuI,则CuSO4被还原,故KI被氧化,CuI是还原产物,C项错误;
由2Cu2++4I-===2CuI↓+I2、SO2+I2+2H2O===H2SO4+2HI,结合氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,可得氧化性:
Cu2+>I2>SO2,D项正确。
3.(2018·
蓉城名校联考)下列说法正确的是( )
A.1molFeI2与足量氯水反应时转移的电子数为2NA
B.明矾用作净水剂不涉及化学变化
C.灼烧白色粉末火焰呈黄色,证明原粉末中有Na+、无K+
D.向饱和Na2CO3溶液中通入过量CO2,会有NaHCO3晶体析出
D [氯水足量时能将FeI2氧化成Fe3+和I2,故1molFeI2与足量氯水反应转移3mol电子,A项错误;
明矾中Al3+水解生成Al(OH)3胶体,Al(OH)3胶体能吸附水中悬浮物而起到净水作用,涉及化学变化和物理变化,B项错误;
做钾的焰色反应实验时,需透过蓝色钴玻璃观察以除去钠的焰色干扰,C项错误;
溶解度:
Na2CO3>NaHCO3,向饱和Na2CO3溶液中通入过量CO2,溶液中会析出NaHCO3晶体,D项正确。
4.(2018·
山西八校联考)谢弗勒尔盐(Cu2SO3·
CuSO3·
2H2O)是一种不溶于水、酸和乙醇的固体,100℃时发生分解。
可由CuSO4·
5H2O和SO2制备得到,实验装置如图所示:
A B C
(1)装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸或98%浓硫酸,其原因是_________________________________________________________
(2)装置B中发生反应的离子方程式为____________________________
(3)装置C的作用是______________________________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
检验已洗涤干净的方法是___________________________________________________
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料纯净CuSO4·
5H2O的实验方案:
向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入________溶液,加入适量纯净的________调节3.2<pH<4.2,静置,过滤,将滤液水浴加热蒸发浓缩至表面出现晶膜,冷却结晶,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·
5H2O。
[已知该溶液中氢氧化物开始沉淀至沉淀完全时的pH范围分别为:
Fe(OH)2(5.8~8.8);
Cu(OH)2(4.2~6.7);
Fe(OH)3(1.1~3.2)]
【解析】
(2)装置B为Cu2SO3·
2H2O的制备装置,由3Cu2+得2×
e-,Cu2SO3·
2H2O、SO2失2e-,SO
,根据得失电子守恒、电荷守恒及原子守恒,配平离子方程式为3Cu2++3SO2+6H2O===Cu2SO3·
2H2O↓+8H++SO
(3)最后一个装置为SO2尾气吸收装置,由于SO2易溶于水,故装置C为安全瓶,起到防止倒吸的作用。
(4)根据Cu2SO3·
2H2O的制备反应,欲检验Cu2SO3·
2H2O是否洗涤干净,可以通过检验最后一次洗涤液中是否含SO
,实验操作为取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净。
(5)加入稍过量的硫酸溶液,得到CuSO4、FeSO4、H2SO4的混合溶液,从提供的氢氧化物开始沉淀至沉淀完全的pH范围可知,Fe2+不能通过直接沉淀而除去,否则Fe2+沉淀完全时Cu2+也沉淀完全,因此需要加入氧化剂先将Fe2+转化为Fe3+,再调节3.2<pH<4.2,此时Fe3+沉淀完全,Cu2+未开始沉淀,加入H2O2溶液,不会引入新的杂质,调节pH时加入纯净的CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3。
【答案】
(1)二氧化硫在稀硫酸中的溶解度太大;
浓硫酸中H+浓度小不适宜制备二氧化硫
(2)3Cu2++3SO2+6H2O===Cu2SO3·
(3)作安全瓶,防止倒吸
(4)取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净
(5)H2O2 CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
命题热点2 非金属及其化合物的性质及制备
1.非金属及其化合物的相互转化关系
(1)碳、硅及其化合物的转化关系
①SiO2+2C
Si+2CO↑;
②SiO2+2NaOH===Na2SiO3+H2O;
③Si+2NaOH+H2O===Na2SiO3+2H2↑;
④Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓;
⑤SiO2+4HF===SiF4↑+2H2O。
(2)氯及其化合物之间的转化关系
②Cl2+2NaOH===NaClO+NaCl+H2O;
④2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O;
⑦3Cl2+6KOH(浓)
KClO3+5KCl+3H2O;
⑧CH2===CH2+Cl2―→CH2Cl-CH2Cl。
①Cl2+SO2+2H2O===2Cl-+SO
+4H+;
③Cl2+H2O
H++Cl-+HClO;
⑤MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
⑥Cl2+SO
+H2O===2Cl-+SO
+2H+。
(3)硫及其化合物之间的转化关系
①SO2+2H2S===3S↓+2H2O;
③C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
④2CaSO3+O2===2CaSO4;
⑤Na2SO3+H2SO4===Na2SO4+SO2↑+H2O。
(4)氮及其化合物之间的转化关系
①2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②4NH3+5O2
4NO+6H2O;
③3NO2+H2O===2HNO3+NO;
④C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
⑤3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;
⑥NH3+HCl===NH4Cl。
2.非金属及其化合物的特性及应用
(1)硅及其化合物
①硅是半导体材料,制作硅芯片、硅光电池等。
②SiO2是一种酸性氧化物,高熔点、高硬度,可用于制备光导纤维,生产玻璃作装饰物等。
③硅胶具有多孔、表面积大、吸附性强,可应用于干燥剂和催化剂载体。
(2)氯水、次氯酸盐溶液可作漂白剂、消毒剂的实质粒子是HClO,能作杀菌消毒的物质常有Cl2、O3、ClO2、H2O2、次氯酸盐、Na2O2。
(3)通入品红溶液褪色的常见气体有Cl2、SO2、O3,若溶液加热又恢复红色的气体是SO2。
(4)Na2S2O3溶液中加稀H2SO4,现象是溶液中变浑浊,且有气泡生成,其离子方程式为S2O
+2H+===S↓+SO2↑+H2O。
(5)SO2可作漂白剂,可应用于漂白纸浆、毛、丝、草帽辫等。
(6)干冰升华吸热,可用于人工降雨,氨气易液化且汽化时吸收大量热,可作制冷剂。
3.常见气体的制备原理(写化学方程式和收集方法)
(1)CO2:
CaCO3+2HCl===CaCl2+CO2↑+H2O,向上排空气法。
(2)O2:
2H2O2
2H2O+O2↑或2KClO3
2KCl+3O2↑,排水法。
(3)Cl2:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,向上排空气法。
(4)SO2:
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O或
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,向上排空气法。
(5)NH3:
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,向下排空气法。
(6)NO2:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,向上排空气法。
(7)NO:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,排水法。
(8)H2:
Zn+H2SO4===ZnSO4+H2↑,排水法。
1.
(1)(2018·
全国卷Ⅰ)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式
___________________________________________________________。
(2)(2018·
全国卷Ⅲ)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式________________________。
【答案】
(1)2NaHSO3===Na2S2O5+H2O
(2)2SiHCl3+3H2O===(HSiO)2O+6HCl
2.下列关于非金属及其化合物的叙述正确的是________(填序号)。
(1)(2017·
全国卷Ⅱ)甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红,说明生成的氯甲烷具有酸性
(2)(2017·
全国卷Ⅱ)加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,说明NH4HCO3显碱性
(3)(2016·
全国卷Ⅲ)漂白粉能漂白织物的原因是次氯酸盐具有氧化性
(4)(2015·
全国卷Ⅱ)向苦卤中通入Cl2是为了提取溴
【答案】 (3)(4)
3.(2017·
全国卷Ⅰ)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。
下列说法正确的是( )
A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
B [A项,若③中为焦性没食子酸溶液,则进入④中的气体还会有水蒸气。
B项,若在④处收集气体点燃,发出“噗”声,则证明制取的氢气较纯,可以加热管式炉。
C项,为了防止生成的W被氧化,反应结束时应先停止加热,待管式炉冷却后再关闭活塞K。
D项,二氧化锰与浓盐酸反应制取氯气需要加热,而启普发生器不能加热。
4.(2016·
全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。
某同学在实验室中对NH3与NO2反应进行了探究。
(1)氨气的制备
①氨气的发生装置可以选择上图中的____________________________,
反应的化学方程式为___________________________________________
________________________________________________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:
发生装置→________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
在一定温度下按图示装置进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中
①Y管中
________
②反应的化学方程式
_______________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
③______________
________________
④___________________
______