新课标高考化学总复习讲义第7章 第3节化学平衡的移动和化学反应的方向含答案解析Word格式文档下载.docx
《新课标高考化学总复习讲义第7章 第3节化学平衡的移动和化学反应的方向含答案解析Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《新课标高考化学总复习讲义第7章 第3节化学平衡的移动和化学反应的方向含答案解析Word格式文档下载.docx(24页珍藏版)》请在冰点文库上搜索。
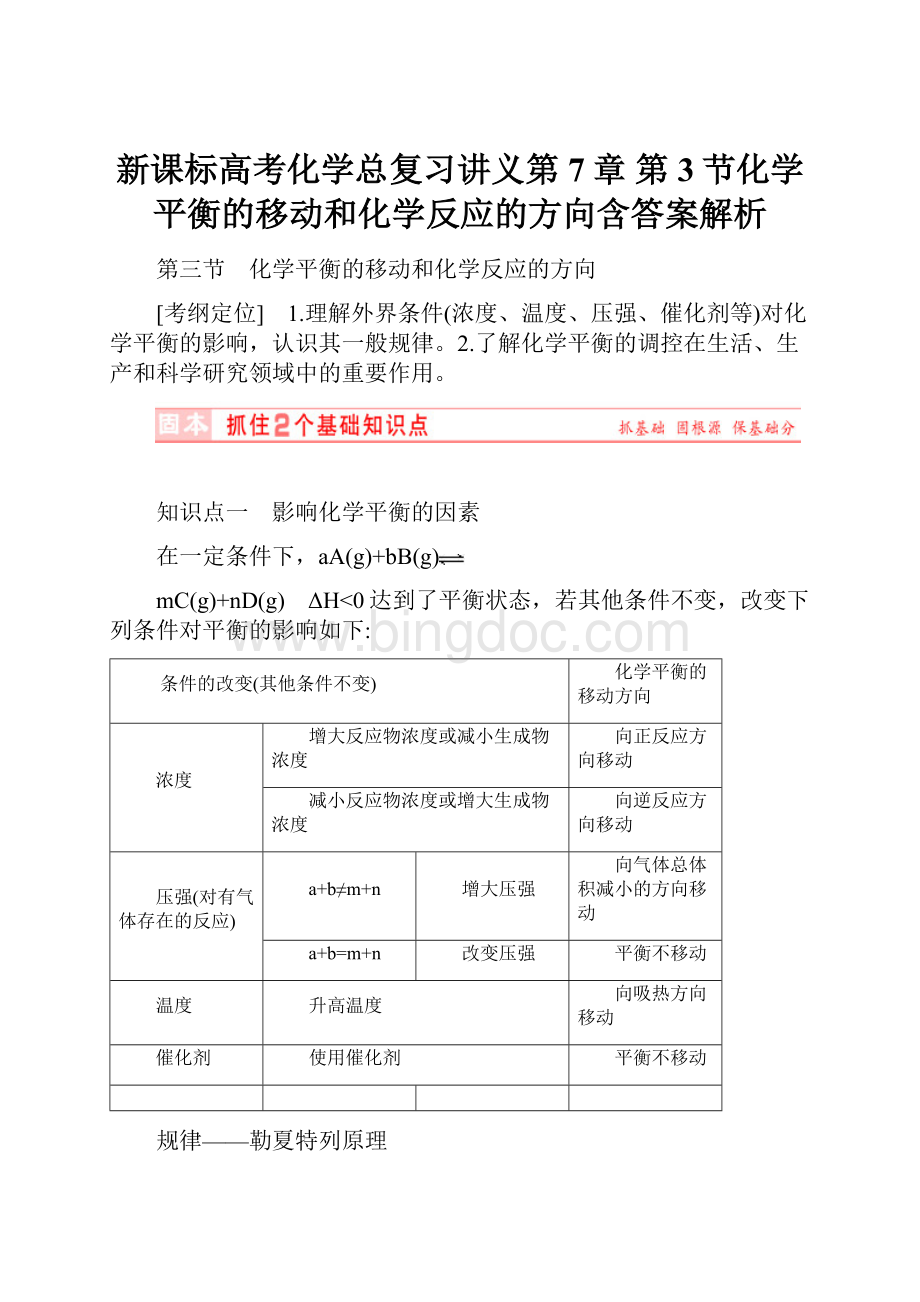
(2)增大 增大 正反应方向
(3)增大 正反应方向
(4)不变,不 (5)增大 不
2.对于反应2SO2(g)+O2(g)
2SO3(g),向密闭容器中充入2molSO2和1molO2,一定温度下达到平衡,c(SO2)=amol/L,c(SO3)=bmol/L,若将容器缩小为原来的
,达到新平衡时,amol/Lc(SO2)2amol/L,c(SO3)2bmol/L。
(填“>
”“<
”或“=”)。
<
<
>
知识点二 化学反应进行的方向
1.自发过程
(1)含义:
在一定条件下,不需要借助外力作用就能自动进行的过程。
(2)特点:
①体系趋向于从高能量状态转变为低能量状态(体系对外部做功或释放能量);
②在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2.熵
(1)熵是量度体系混乱度程度的物理量,符号为S。
(2)当物质由固体变为液体或气体时,体系的混乱度增大,即ΔS>
0,当物质由液体变为气体时,体系的混乱度增大,即ΔS>
0。
反之,ΔS<
3.化学反应的方向的判据
对于ΔH>
0,ΔS>
0的吸热反应,高温下反应可自发进行;
对于ΔH<
0,ΔS<
0的放热反应,低温下,反应可自发进行;
0的反应,任何温度均可自发进行;
0的反应,任何温度均不能自发。
3.下列说法是否正确?
(填“√”或“×
”)
(1)化学反应总是伴随着能量变化
(2)能够自发进行的反应不一定都是放热反应
(3)只有放热反应才能够自发进行
(4)能够自发进行的反应就一定能够发生并完成
(5)若一个反应的ΔH>
0,该反应一定不能自发进行
(6)同一物质:
固体→液体→气体变化是焓增和熵增的过程
(1)√
(2)√ (3)×
(4)×
(5)√ (6)√
4.下列说法正确的是
A.ΔH<
0、ΔS>
0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B
解析:
ΔH<
0,则ΔG<
0,任何温度下反应都能自发进行,A错误,B正确;
用焓变和熵变判断反应的自发性,都有例外,故都不能单独作为反应自发性的判据,而应用复合判据,C错误;
使用催化剂只能降低反应的活化能,不能改变反应的方向,D错误。
考点一[047] 化学平衡移动
考题引领
下列说法是否正确?
(用“√”或“×
1.(2012·
安徽高考)平衡时,其他条件不变,分离出固体生成物,v正加快
2.(2010·
全国卷Ⅱ)工业上生产硫酸的过程中,使用过量的空气可提高SO2的转化率
3.对于N2(g)+3H2(g)
2NH3(g)反应达到的平衡,在恒温恒容下通入Ne气体压强增大,而平衡不移动
4.(2014·
临沂模拟)化学平衡正向移动,反应物的转化率不一定增大
1.×
固体不影响反应速率
2.√ 充入过量的O2,使平衡向右移动,促进SO2的转化
3.√ 4.√
一、化学平衡移动的分析思路
二、平衡移动的几种特殊情况
1.当反应混合物中存在与其他物质不相混溶的固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡无影响。
2.反应实例2NO2N2O4
条件变化
平衡移动
NO2%
α(NO2)
恒温恒容,充入NO2
正移
减小
增大
恒温恒容,充入N2O4
逆移
三、“无关气体”对化学平衡的影响
1.恒温、恒容条件
原平衡体系
体系总压强增大→体系中各反应成分的浓度不变→平衡不移动。
2.恒温、恒压条件:
容器容积增大
体系中各组分的浓度同倍数减小(等效于减压)→
3.同等程度地改变反应混合物中各物质的浓度时,应视为压强的改变。
如恒温恒容条件下,N2+3H22NH3达到平衡时,n(N2):
n(H2):
n(NH3)=1:
2:
3,若再向该容器充入1molN2、2molH2和3molNH3时平衡向正方向移动。
四、勒夏特列原理的理解
1.原理的适用范围是只有一个条件变化的情况(温度或压强或一种物质的浓度),当多个条件同时发生变化时,情况比较复杂。
2.这种“减弱”并不能抵消外界条件的变化,更不会“超越”这种变化。
如原平衡体系的压强为p,若其他条件不变,将体系压强增大到2p,平衡将向气体体积减小的方向移动,达到新平衡时的体系压强将介于p~2p之间。
——————[1个示范例]——————
(2014·
南京市模拟)将水蒸气通过红热的碳即可产生水煤气,反应为C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.5kJ·
mol-1
(1)下列措施中,能提高碳的转化率的是(填字母序号)。
a.容器的容积不变,增加水蒸气的物质的量B.缩小容器的容积,增大压强
C.扩大容器的容积,减小压强D.其他条件不变,升高温度 e.压强不变,充入He气 f.及时将水煤气从容器中移走 g.加入催化剂 h.采取措施使化学平衡常数K增大
(2)当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是(填字母序号)。
a.CO的质量分数一定增加B.CO的产量一定增加
c.反应物的转化率一定增大D.反应物的浓度一定降低 e.生成CO的速率一定大于生成H2O的速率 f.正反应速率一定增大 g.逆反应速率一定减小 h.可以增加碳的质量,使平衡向正反应方向移动 i.c(H2O)/c(CO)的值一定减小 j.化学平衡常数K一定增大
(1)依据转化率α=
×
100%,a、c、d、f均能使平衡右移,碳起始的物质的量不变,碳转化的物质的量增大,符合;
b平衡向左移动,使碳转化的物质的量减小,不符合;
e相当于减压,使平衡右移,碳转化的物质的量增大,符合;
g平衡不移动,不符合,h化学平衡常数K只随温度变化,所以采取的措施一定是升高温度,符合。
(2)加入水蒸气平衡右移,水的转化率降低、水蒸气浓度增大,化学平衡常数不变,所以c、d、j均错,CO质量分数=
,减小CO的浓度,平衡右移,CO的质量、气体的总质量均减小,但CO的质量减小的多,所以a错误;
加入水蒸气平衡右移,c(H2O)、c(CO)均增大,但c(H2O)增大的多,i错误;
平衡右移生成物的产量一定增大,b正确;
平衡向正反应方向移动,所以v(正)>
v(逆),e正确,由减压,平衡向正反应方向移动,正逆反应速率均降低,f错误;
由升高温度可知g错误;
碳是固体,可知h错误。
(1)a、c、d、e、f、h
(2)b、e
——————[2个预测练]——————
考向预测1 判断平衡移动的方向
上海高考节选)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl
(g) ΔH=QkJ·
mol-1(Q<
0)
完成下列填空:
(1)上述反应达到平衡后,下列说法正确的是。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(2)若平衡时H2和HCl的物质的量之比
为
,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比
”、“=”或“<
”)。
(1)因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,b正确;
温度不变,加压或改变反应物的浓度等平衡常数不变,a错误;
其他条件不变,增加固体Si3N4平衡不移动,c错误;
其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。
(2)降低温度,化学平衡向放热反应方向移动,即正向移动,n(H2)减小,n(HCl)增大,故
减小。
(1)bd
(2)<
考向预测2 勒夏特列原理的含义
2.下列措施或操作不能用勒夏特列原理解释的是
A.工业合成氨加入高效催化剂提高经济效益
B.工业合成SO3:
2SO2+O2
2SO3时增大O2的浓度
C.对于2NO2(g)N2O4(g)反应,压缩体积提高NO2的转化率
D.对于2SO2(g)+O2(g)2SO3 ΔH<
0,升高温度,SO2的转化率减小
加催化剂,只改变反应速率不改变平衡状态。
A
考点二[048] 化学平衡的综合图象分析
1.(2011·
安徽高考)对于ΔH<
0的反应,v正与T的关系图为
2.由图
可知T2>
T1
3.
对该图示,若T1>
T2,则该反应的ΔH>
温度升高,v正、v逆均增大
2.√ 3.√
一、常见平衡图象的类型
1.含量时间温度(压强)图:
常见形式有如下几种。
(C%指产物的质量分数;
B%指某反应物的质量分数)
(T2>
T1,正反应为吸热反应)
(p1>
p2,正反应为气体体积减小的反应)
2.恒压(温)线:
该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型有
3.其他
(1)如右图,对于化学反应mA(g)+nB(g)qC(g)+pD(g),M点前,表示从反应物开始,则v(正)>
v(逆);
M点为刚好达到平衡点。
M点后为平衡受温度的影响情况,即升温,A%增加,平衡左移,ΔH<
(2)如右图,对于化学反应mA(g)+nB(g)qC(g)+pD(g),l线上所有的点都是平衡点。
在上方(E点),A%大于此压强时平衡体系中的A%,所以,E点v(正)>
在下方(F点),A%小于此压强时平衡体系中的A%,则v(正)<
v(逆)。
(3)如下图,对于aA(g)+bB(g)
cC(g)反应,n(A)、n(B)是A、B的物质的量,交点n(A):
n(B)=a:
b。
二、分析图象的4种方法策略
1.看图像:
一看轴,即纵、横坐标的意义;
二看点:
即起点、拐点、交点、终点;
三看线,即线的走向和变化趋势;
四看辅助线,即等温线、等压线、平衡线等;
五看量的变化,如浓度变化、温度变化、转化率变化、物质的量的变化等。
2.依据图像信息,利用平衡移动原理,分析可逆反应的特征:
吸热还是放热,气体的化学计量数增大、减小还是不变,有无固体或纯液体参加或生成等。
3.先拐先平:
在化学平衡图像中,先出现拐点的反应先达到平衡,可能是该反应的温度高、浓度大、压强大或使用了催化剂。
4.定一议二:
勒夏特列原理只适用于一个条件的改变,所以图像中有三个变量,先固定一个量,再讨论另外两个量的关系。
(2013·
安徽高考)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项
x
y
容器内混合气体的密度
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
通过题给条件,判断平衡移动的方向,分析平衡移动后各量的变化规律,再结合图像进行判断。
,考向预测1 根据图像确定反应特点
3.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
A.CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g) ΔH<
B.CO2(g)+H2(g)CO(g)+H2O(g) ΔH>
C.CH3CH2OH(g)CH2=CH2(g)+H2O(g) ΔH>
D.2C6H5CH2CH3(g)+O2(g)2C6H5CH=CH2(g)+2H2O(g) ΔH<
观察图象可知,达到平衡用的时间短反应速率快,T2>
T1、p1>
p2。
升高温度水蒸气的百分含量降低,说明平衡逆向移动,正反应放热,ΔH<
0;
增大压强水蒸气的百分含量增大,说明平衡正向移动,正反应气体分子数减少,综合分析A选项中反应符合要求。
A.该反应的正反应是吸热反应,当升高温度时,平衡向正反应方向移动,生成气体的质量增加,由于容器的容积不变,所以容器内混合气体的密度增大,A项正确。
B.方法一:
增大CO的物质的量,平衡向正反应方向移动,生成CO2的量虽然增多,但平衡时CO增加的量要比CO2增加的量要多,所以CO2与CO的物质的量之比减小。
方法二:
因为容器的容积不变,增加CO的物质的量,相当于增加了CO的浓度,由于反应物中只有CO为气体,根据“等效平衡”原理,增加CO的物质的量的过程可以看作是增大压强的过程,即平衡向逆反应方向移动,所以CO2与CO的物质的量之比应该减小。
C.增加SO2的浓度,虽然平衡向逆反应方向移动,但由于温度没有改变,所以平衡常数K不变。
D.MgSO4是固体,虽然它的质量增加了,但平衡并不发生移动,所以CO的转化率不会因为MgSO4质量的增加而增大。
考向预测2 综合图像考查
马鞍山模拟)有一反应:
2A+B2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v(正)<
v(逆)
由于温度升高,B的转化率增大,说明平衡正向移动,推知该反应是吸热反应,A错。
在T1温度下,由a点达到平衡时,B的转化率不断减小,若采取加压措施,结合化学方程式可知B的转化率会不断增大,故C错。
在T2温度下,c点会达到平衡状态,此过程中B的转化率不断增大,说明该过程v(正)>
v(逆),D错。
平衡转化率的变化分析方法
1.当改变温度或压强时平衡向正反应方向移动,平衡转化率一定增大。
2.当两种或两种以上的可逆反应,增加一种反应物的浓度,平衡向正向移动,其他反应物的转化率增大而本身转化率降低。
3.当只改变生成物的浓度,平衡向正向移动,平衡转化率一定增大。
4.对于aA(g)bB(g)+cC(g)反应,加入一定的A建立平衡体系
(1)如果在恒温恒容下再加入A物质,达到新平衡时A的转化率有下列三种情况
①a=b+c,A的转化率不变
②a>
b+c,A的转化率增大
③a<
b+c,A的转化率减小
(2)如果在恒温恒压下再加入A物质,达到新平衡时A的转化率不变。
5.对于aA(g)+bB(g)cC(g)反应,加入amolA和bmolB建立平衡体系。
如在恒温恒容下按n(A):
b的量加入A、B,A、B转化率有下列三种情况 ①a+b=c,A、B转化率不变 ②a+b>
c,A、B转化率增大 ③a+b<
c,A、B转化率减小。
6.如果某一反应达到平衡,在恒温恒容下再按原平衡各组分的物质的比加入各组分,反应物的转化率变化按增大压强分析。
在恒温恒容条件下,将2molSO2和1molO2充入密闭容器中,发生反应2SO2(g)+O2(g)
2SO3(g) ΔH<
0,充分反应达到平衡,改变下列条件达到平衡时SO2的转化率如何改变?
(增大或减小或不变)
(1)在相同条件下,再充入1molO2气体。
(2)在相同条件下,再充入1molSO2和0.5molO2。
(3)升高温度。
(4)在相同条件,充入He气。
(1)增大
(2)增大 (3)减小 (4)不变
(1)再充入1molO2,平衡右移,SO2转化率增大。
(2)再充入1molSO2和0.5molO2。
加入的量比没有改变,平衡时压强增大,正反应方向程度大,SO2的转化率增大。
(3)升温,平衡向吸热方向移动即逆向移动,SO2的转化率减小。
(4)恒温恒容充入惰气He,平衡不移动,SO2的转化率不变。
1.(选修4P32T6改编)在密闭容器中的一定量混合气体发生反应:
xA(g)+yB(g)
zC(g)。
平衡时测得A的浓度为0.50mol·
L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol·
L-1。
下列有关判断正确的是
A.x+y<
zB.平衡向正反应方向移动
C.B的转化率增大D.C的体积分数下降
假设平衡不移动,容积扩大到原来的2倍,c(A)=
=0.25mol/L<
0.30mol/L,由此可知,平衡向逆向移动,逆向是气体体积增大的方向,即x+y>
z。
2.(选修4P32T8)2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)PCl5(g)。
达平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
A.0.40molB.0.20molC.小于0.20molD.大于0.20mol,小于0.40mol
如果移走1.0molPCl3和0.5molCl2,再达平衡时压强比原平衡小,化学平衡向逆反应方向移动。
3.(2014·
山东省济宁市高三上学期期末考试)在一定容器密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g)
2C(g) ΔH<
0,达到平衡后,只改变一个条件(x),下列量(y)的变化一定符合图中曲线的是
再加入A
B的转化率
加入催化剂
A的体积分数
充入氦气
A的转化率
C的体积分数
催化剂不能影响化学平衡,B项不正确;
充入氦气,不能影响平衡,A的转化率不变,C项不正确;
该反应为放热反应,升高温度平衡逆向移动,C的转化率降低,D项不正确。
4.(2013·
全国高考)反应X(g)+Y(g)
2Z(g) ΔH<
0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
根据该反应的特点结合平衡移动原理逐项分析。
A.该反应为反应前后气体物质的量不变的反应,平衡不受压强影响,减小容器体积,平衡不移动。
B.催化剂不能使平衡移动,不改变产物的产率。
C.增大c(X),平衡正向移动,Y的转化率增大,X本身的转化率反而减小。
D.该反应的正反应是放热反应,降低温度,平衡正向移动,Y的转化率增大。
5.(高考组合题)下列说法正确的是。
A.(2012·
江苏高考)CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<
B.(2011·
江苏高考)一定温度下,反应MgCl2(l)
Mg(l)+Cl2(g)的ΔH>
C.(2011·
北京高考)升高温度可缩短ΔH<
0的可逆反应达平衡的时间并能提高平衡转化率
D.(2013·
重庆高考)反应E(g)+F(s)2G(g)的ΔS>
E.(2010·
天津高考)ΔH<
0的可逆反应,升高温度,平衡常数K正减小,K逆增大
F.(2010·
江苏高考)常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>
BDEF
A项,CaCO3的分解是吸热反应,ΔH>
0,反应是否能够自发进行取决于ΔH-TΔS的正负,错误;
B项,镁在氯气中燃烧是放热反应,反之则为吸热反应,正确;
C项,ΔH<
0为放热反应,升温平衡逆向移动,降低平衡转化率,错误;
D项,固体生成气体,ΔS>
0,正确;
E项,ΔH<
0的反应,正反应为放热反应,正确;
F项,应依据ΔH—TΔS来判断反应能否自发进行。
由方程式知ΔS>
0,则ΔH>
0,正确。
6.现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
CO和H2在一定条件下合成甲醇的反应为:
CO(g)+2H2(g)
CH3OH(g) ΔH1。
现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如图1和图2。
(1)该反应的ΔH10(填“<
”、“>
”或“=”,下同),K1K2。
(2)将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有。
(1)<
(2)升温或减压
(1)从图1看,温度升高,CH3OH的物质的量减小,平衡逆向移动,所以正反应是放热反应,ΔH1<
温度越高,K值越小,K1>
K2。
(2)容器c中温度比容器d中温度低,则平衡时容器c中甲醇的体积分数比容器d中甲醇的体积分数大,使容器c的平衡逆向移动可以转变到容器d中的平衡状态,升温或减压都可以实现。