药品注册申请程序Word格式文档下载.docx
《药品注册申请程序Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《药品注册申请程序Word格式文档下载.docx(7页珍藏版)》请在冰点文库上搜索。
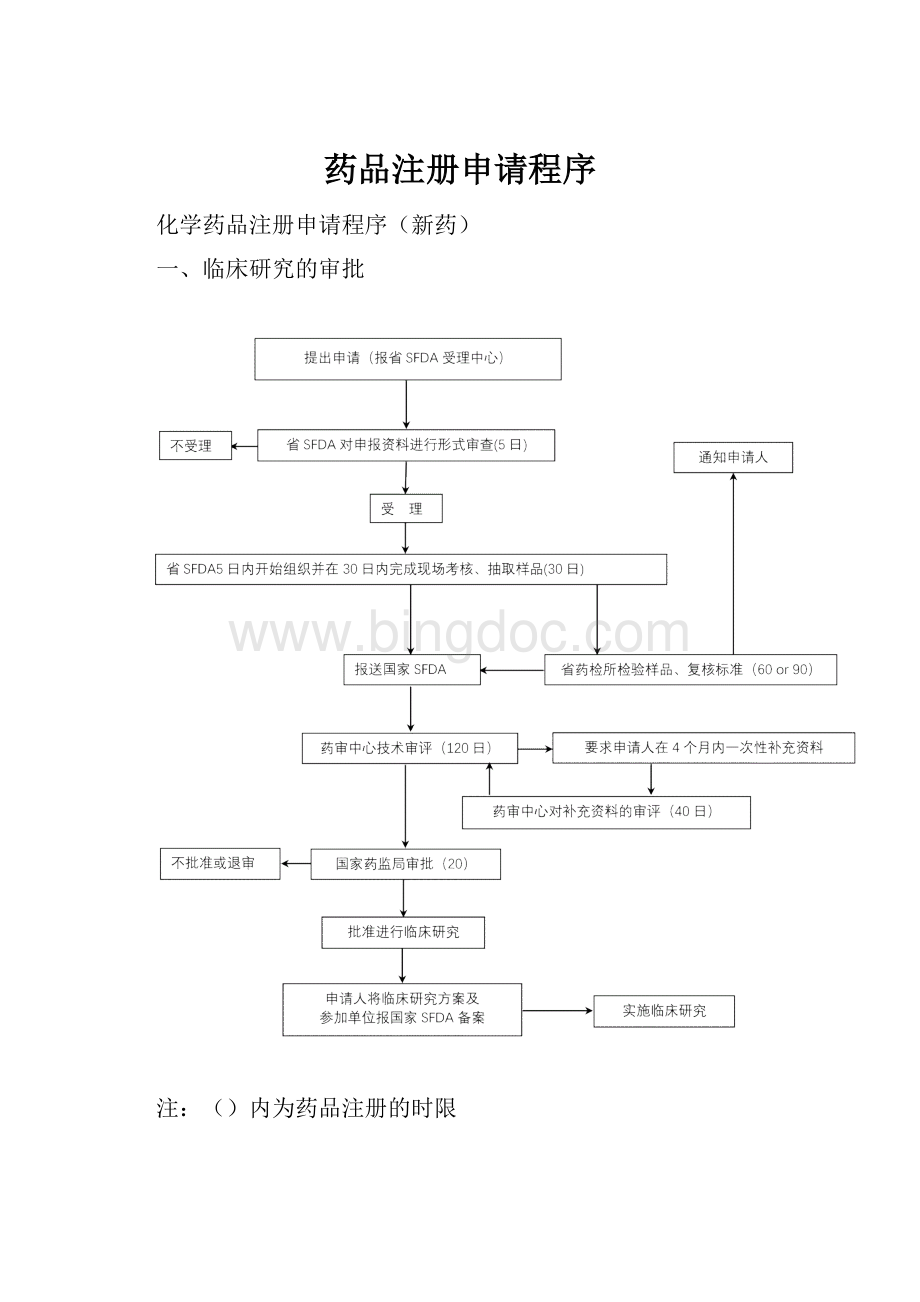
()内为药品注册的时限
二、临床研究的实施
取得《药物临床试验批件》
从具有药物临床试验资格的机构中,选择承担药物临床试验的机构,商定临床试验的负责单位、主要研究者及临床试验参加单位。
与选定的临床试验负责单位和参加单位签订临床试验合同,提供研究者手册,参照有关技术指导原则与研究者共同设计和完善临床试验方案。
临床试验方案提请临床试验机构伦理委员会进行审查
向选定的临床试验单位免费提供临床试验用药物和对照用药品,并附样品检验报告书;
提供临床试验所需要的费用
在药物临床试验实施前,将已确定的临床试验方案和临床试验负责单位的主要研究者姓名、参加研究单位及其研究者名单、伦理委员会审核同意书、知情同意书样本等报送国家食品药品监督管理局备案,并抄送临床试验单位所在地和受理该申请的省、自治区、直辖市(食品)药品监督管理部门
药物临床试验过程中,申请人任命监查员,按照《药物临床试验质量管理规范》监督试验过程
完成临床试验后,向国家食品药品监督管理局和有关省、自治区、直辖市(食品)药品监督管理部门提交临床试验和统计分析报告。
实施临床试验
三、新药生产的审批
省SFDA对申报资料进行形式审查(5日)
不受理
受理
提出申请,报送临床试验资料及其他变更和补充的资料(报省SFDA受理中心),
向中检所报送制备标准物质的原料及有关资料
省SFDA5日内开始组织并在30日内完成现场考核、抽取样品(30日)
通知申请人
省药检所进行药品注册检验(30)
报送国家SFDA
药审中心技术审评(120日)
要求申请人在4个月内一次性补充资料
药审中心对补充资料的审评(40日)
国家药监局审批(20)
批准生产
不批准或退审
化学药品注册申请程序(仿制)
生物制品注册申请程序(新药)
提出申请(报省SFDA受理中心)
中检所检验样品、复核标准(90)
批准进行临床研究
申请人将临床研究方案及
参加单位报国家SFDA备案
实施临床研究
同化学药品
中检所进行药品注册检验(60)
生物制品注册申请程序(仿制)
一、临床研究的申报与审批
中检所检验样品、复核标准(60-90)
药审中心技术审评(80日)
药审中心对补充资料的审评(27日)
同新药
三、生产的申报与审批