全国大联考甘肃新课标Ⅱ甘肃省兰州市届高三第二次诊断理综化学试题解析版.docx
《全国大联考甘肃新课标Ⅱ甘肃省兰州市届高三第二次诊断理综化学试题解析版.docx》由会员分享,可在线阅读,更多相关《全国大联考甘肃新课标Ⅱ甘肃省兰州市届高三第二次诊断理综化学试题解析版.docx(18页珍藏版)》请在冰点文库上搜索。
全国大联考甘肃新课标Ⅱ甘肃省兰州市届高三第二次诊断理综化学试题解析版
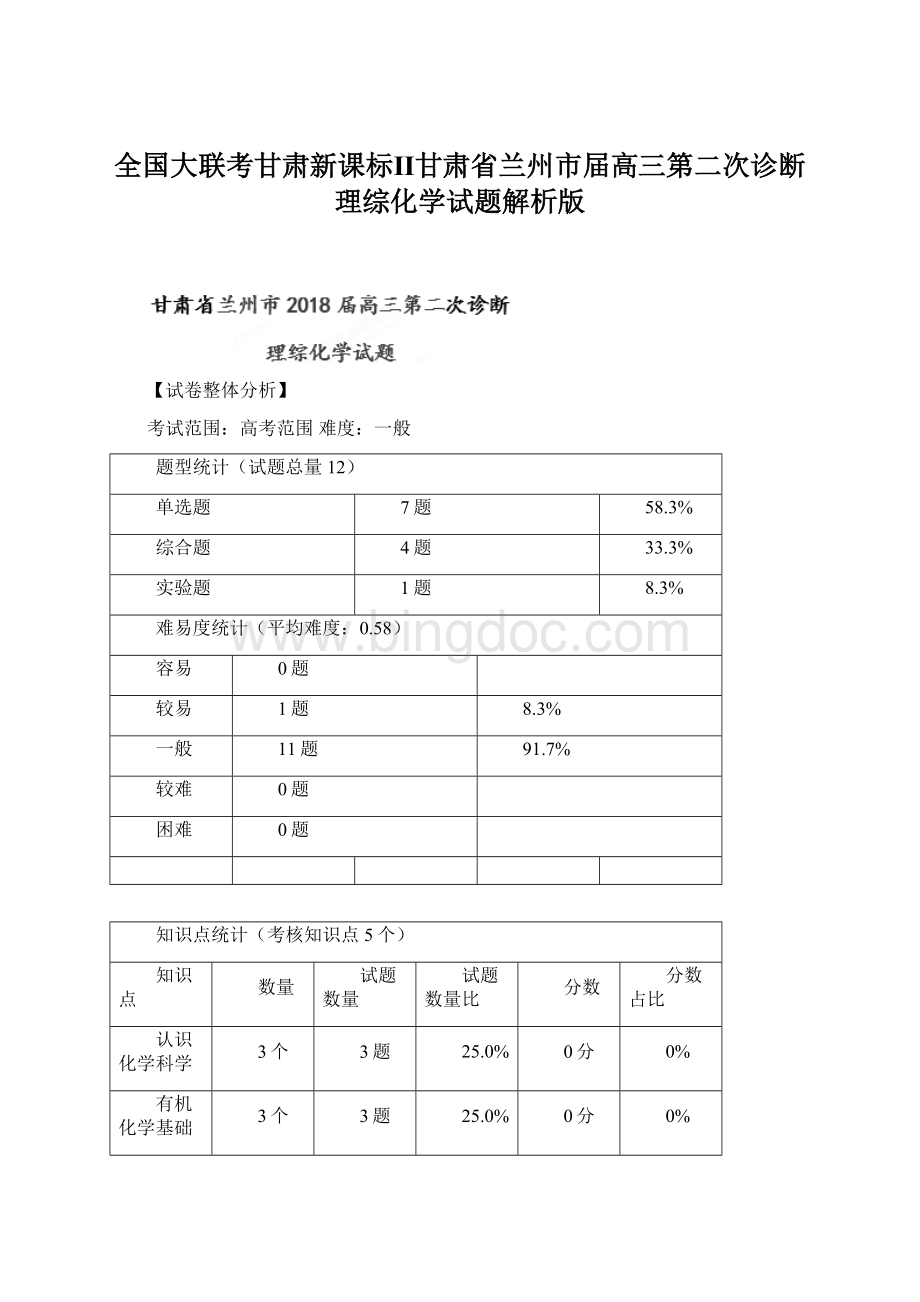
【试卷整体分析】
考试范围:
高考范围难度:
一般
题型统计(试题总量12)
单选题
7题
58.3%
综合题
4题
33.3%
实验题
1题
8.3%
难易度统计(平均难度:
0.58)
容易
0题
较易
1题
8.3%
一般
11题
91.7%
较难
0题
困难
0题
知识点统计(考核知识点5个)
知识点
数量
试题数量
试题数量比
分数
分数占比
认识化学科学
3个
3题
25.0%
0分
0%
有机化学基础
3个
3题
25.0%
0分
0%
常见无机物及其应用
2个
2题
16.7%
0分
0%
化学反应原理
3个
3题
25.0%
0分
0%
物质结构与性质
1个
1题
8.3%
0分
0%
【题型考点分析】
题号
题型
知识点
1
综合题
氧化还原反应的应用
2
单选题
硝酸的强氧化性
3
单选题
离子方程式的书写
4
单选题
氧化还原反应的应用
5
实验题
氯离子的检验
6
单选题
电解原理的应用
7
综合题
物质结构与性质综合考查
8
综合题
有机物结构式的确定
9
单选题
简单有机物同分异构体书写及辨识
10
单选题
水的离子积常数
11
单选题
有机物蒸馏
12
综合题
根据△H=反应物的键能之和-生成物的键能之和进行计算
甘肃省兰州市2018届高三第二次诊断
理综化学试题
第I卷(选择题)
1.中国传统文化对人类文明贡献巨大。
下列两篇古代文献中都涉及到了KNO3。
文献①:
《开宝本草》记载:
(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,文献②《本草纲目》“火药乃焰硝(KNO3)、硫黄、山木炭所合,以为烽燧餇诸药者。
”下列对其解释不合理的是
A.文献①中提取KNO3利用了溶解、蒸发结晶的实验过程
B.用文献①中方法制取KNO3是因为KNO3的溶解度受温度影响不大
C.文献②中火药的使用体现了硝酸钾的氧化性
D.文献②中使用火药的产物会污染环境
【答案】B
2.结合下表数据分析,下列有关说法不正确的是
物质
分子式
沸点/℃
溶解性
乙醇
C2H6O
78.5
与水以任意比混溶
乙二醇
C2H6O2
197.3
与水和乙醇以任意比混溶
A.乙醇与乙二醇含有的官能团相同,都能与NaOH发生反应
B.采用蒸馏的方法可以分离乙醇与乙二醇的混合物
C.乙醇、乙二醇都能与羧酸在一定条件下发生取代反应
D.丙三醇的沸点应高于乙醇的沸点
【答案】A
【解析】A项,乙醇与乙二醇含有的官能团都是羟基,(醇)羟基不能与NaOH发生反应,故A错误;B项,乙醇的沸点为78.5℃,乙二醇的沸点为197.3℃,二者沸点相差较大,可采用蒸馏的方法进行分离,故B正确;C项,乙醇、乙二醇都含有(醇)羟基,与羧酸在一定条件下发生酯化反应(即取代反应),故C正确;D项,由乙醇与乙二醇的沸点可得,醇含有羟基数越多、相对分子质量越大,则沸点越高,所以丙三醇的沸点应高于乙醇的沸点,故D正确。
3.下列化学反应的离子方程式书写不正确的是
A.用FeCl3溶液腐蚀印刷线路板上的Cu:
2Fe3++Cu=2Fe2++Cu2+
B.向CuSO4溶液中加入Na2O2:
2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C.稀硝酸中加入过量铁粉:
Fe+4H++NO3-=Fe3++NO↑+2H2O
D.用Na2CO3溶液浸泡锅炉水垢:
CaSO4(s)+CO32-(aq)
CaCO3(s)+SO42-(aq)
【答案】C
4.某有机物A(C9H18O2)在稀硫酸溶液中水解为相对分子质量相等的B、C,其中B分子中含有3个甲基,则A、B、C中能与氢氧化钠溶液反应的物质最多有(不考虑立体异构)
A.10种B.8种C.6种D.4种
【答案】B
【解析】由有机物的性质知A是酯,由B、C相对分子质量相等的关系知B、C各是C5H11OH、C3H7COOH中的一种,C5H11OH中含有3个―CH3,则B有3种结构:
C(CH3)3CH2OH、CH3CH2C(CH3)2OH、CH3CH(CH3)CH(CH3)OH,C3H7COOH有2种不同的结构CH3CH2CH2COOH和(CH3)2CHCOOH,故A有3
种结构的酯,A、C能与NaOH溶液反应,共有8种与NaOH溶液反应的物质,答案选B。
5.下列有关实验的叙述正确的是
A.用图1装置将氯化铁溶液直接蒸干得到氯化铁固体
B.利用图2装置可制备Fe(OH)2
C.图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.利用图4可收集氯化氢并进行尾气吸收
【答案】B
【解析】A项,在FeCl3溶液中,Fe3+发生水解:
FeCl3+3H2O
Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热使Fe(OH)3分解生成Fe2O3,故A错误;B项,如图2装置制备Fe(OH)2,稀硫酸与铁粉反应生成氢气,可排出试管中的空气,盛NaOH溶液的胶头滴管伸入FeSO4溶液中,右侧导管插入水中隔绝了空气,所以制得的Fe(OH)2可以较长时间稳定存在,故B正确;C项,稀硝酸与Cu反应生成NO气体,无色NO气体进入广口瓶,被空气中的氧气氧化为红棕色NO2气体,故C错误;D项,氯化氢的密度比空气的大,如图所示收集应该长导管进气,空气从短导管排出,故D错误。
6.SO2和NOx是大气污染物的主要成分。
防止空气污染,保卫“兰州蓝”是兰州市一项重要民生工程。
利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。
下列说法错误的是
A.电极a应连接电源的正极
B.电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C.反应过程中,H+从a极室流向b极室
D.每吸收标况下22.4LSO2,在b极室生成2NA个S2O42-
【答案】D
【解析】A项,由图可得,该装置为电解池,a极:
SO2发生氧化反应,SO2+2H2O-2e-=4H++SO42-,所以电极a应连接电源的正极,故A正确;B项,由上述分析可推出b为阴极,HSO3-发生还原反应生成S2O42-,根据电荷守恒、原子守恒,并结合电解质溶液酸碱性,电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O,故B正确;C项,电解池中阳离子移向阴极,又因为阳离子交换膜把a极室与b极室隔开,所以反应过程中,H+从a极室(阳极室)流向b极室(阴极室),故C正确;D项,阳极反应为:
SO2+2H2O-2e-=4H++SO42-,阴极反应为:
2HSO3-+2e-+2H+=S2O42-+2H2O,根据得失电子守恒,每吸收标况下22.4LSO2(即1molSO2),在b极室生成1mol(即NA个)S2O42-,故D错误。
点睛:
本题以处理大气污染物SO2和NOx的方法为切入点,考查电解池原理,分析利用题干信息(包括图示信息),掌握电解池原理应用和氧化还原反应电子守恒是解答的关键,电解池中阳极发生氧化反应、阴极发生还原反应,遵循氧化还原反应原理,可以通过分析相关元素化合价的变化确定两极反应情况。
7.某温度下,向一定体积0.1mol/L一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc(OH-)的变化关系如右图所示。
下列说法错误的是
A.该温度下,水的离子积常数为1.0×10-2a
B.M、N两点所示的溶液中,水的电离程度相同
C.Q点消耗的NaOH溶液的体积等于HA溶液的体积
D.N点溶液加水稀释,
减小
【答案】C
【解析】A项,水的离子积常数表达式为Kw=c(H+)•c(OH-),可利用图中Q点数据求得Kw,
点睛:
本题考查弱电解质的电离平衡,掌握溶液酸碱性的判断方法是根据溶液中c(H+)与c(OH-)的相对大小,结合弱酸的电离平衡常数分析是解题的关键,如题中D项根据温度一定时Ka是常数,利用Ka的表达式得出c(A-)/c(HA)=Ka/c(H+),将分析两个变量转化为分析一个变量,就好分析了。
第II卷(非选择题)
8.工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te和少量金属单质Au)中回收碲、硒的工艺流程如下:
已知:
(1)TeO2是两性氧化物。
(2)Se和TeO2的物理性质如下:
物理性质
熔点
沸点
水溶性
Se
221℃
685℃
难溶于水
TeO2
733℃
1260℃
微溶于水
(1)“培烧”时,为提高原料的利用率,可采取的措施有_________(写一条即可)。
(2)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(3)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。
如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为______________。
(4)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是______________。
(5)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有10mol电子转移时,会生成______molSe。
过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),理由是_______________。
(已知25℃时,亚硒酸(HSeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7)
【答案】将阳极泥粉碎(通入过量的空气)等Au、CuO硫酸浓度过大,TeO2会溶于酸,导致TeO2沉淀不完全2SO32-+Te4++2H2O=Te↓+2SO42-+4H+2.5降低Se的沸点,避免Se与空气中氧气发生反应【解析】
(1)“培烧”时,为提高原料的利用率,可以将阳极泥粉碎以增大接触面积,或通入过量的空气使阳极泥充分反应。
9.回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。
其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。
合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g)△H=akJ/mol
已知:
键
H-H
C=O
C=C
O-H
C-H
键能/kJ/mol
436.0
745.0
615.0
462.8
413.4
则a=________。
(3)T℃时。
在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H<0,混合气体中CH3OH的体积分数与氢气的物质的量的关系如图所示。
图1中A、B、C三点对应的体系。
CO的转化率最大的是____(填字母),判断理由是____________。
(4)工业上也用合成气(H2和CO)合成甲醇,反应为2H2(g)+CO(g)
CH3OH(g)△H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO的平衡转化率为60%若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:
①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
【答案】CO2
C+O2-375C在恒容密闭容器中,随着氢气物质的量(n)增大,c(H2)增大,平衡正向移动,CO2转化率增大压强正向移动因为阳极发生4OH--4e-=O2↑+2H2O,产生的H+发生H++HCO3-=H2O+CO2↑HCO3-存在电离平衡:
HCO3-
H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生(或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生)
【解析】
(1)过程2中在700K条件下,二氧化碳和氧化亚铁发生反应生成碳和四氧化三铁;过程1中四氧化三铁在太阳能或>2300K时分解生成氧化亚铁和氧气,所以CO2为原料制取炭黑过程中的氧化亚铁做催化剂,根据反应物和生成物及反应条件书写化学方程式为:
CO2
C+O2。
,因为容器容积为10L,所以各物质平衡浓度为:
c(H2)=0.08mol/L、c(CO)=0.04mol/L、c(CH3OH)=0.06mol/L,平衡常数K=
=
=234.375;若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH若保持温度和容器休积不变,则此时c(H2)=0.28mol/L、c(CO)=0.24mol/L、c(CH3OH)=0.26mol/L,Q=
=
≈13.82(5)①装置图中与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑,根据电荷守恒,水电离出的H+与HCO3-反应会产生CO2,离子方程式为:
H++HCO3-=H2O+CO2↑。
②HCO3-存在电离平衡:
HCO3-
H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;或者阴极H+放电破坏水的电离平衡,OH-浓度增大,OH-与HCO3-反应生成CO32-。
10.氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。
实验室利用SO2、Cl2和SCl2制备SOCl2,部分装置如下图所示:
已知:
①SOC12遇水剧烈反应,液面上产生白雾,并有气体产生。
②SOC12沸点为77℃,SC12的沸点为50℃。
请回答:
(1)实验室制取SOCl2的反应方程式为___________。
(2)实验室制取SOC12在三颈烧瓶中合成,整个装置所选仪器的连接顺序是⑥→_____→①,_______→②(某些仪器可以重复使用)。
(3)使用冷凝管的作用是__________;冷凝管上连接的干燥管的作用是__________。
(4)实验结束后,将三颈烧瓶中混合物分离实验操作名称是__________。
(5)若反应中消耗的Cl2的体积为896mL(已折算为标准状况,SO2足量)最后得到纯净的SOCl26.76g,则SOCl2的产率为_________(保留二位有效数字)。
(6)取少量的SOCl2加入足量NaOH溶液,振荡静置得到无色溶液,检验溶液中存在Cl-的方法是________________。
【答案】SO2+Cl2+SCl2
2SOCl2⑫→⑪→⑨→⑩⑦→⑨→⑩冷凝、回流SCl2和SOCl2吸收逸出的Cl2、SO2,防止空气中的水蒸气进入反应装置使SOCl2水解蒸馏(或分馏)71%取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-
【解析】
(1)由已知结合图示信息,实验室利用SO2、Cl2和SCl2制备SOCl2使用活性炭作催化剂,化学方程式为:
SO2+Cl2+SCl2
2SOCl2。
(2)实验室利用SO2、Cl2和SCl2制备SOCl2,在三颈烧瓶中合成,三颈烧瓶中盛着液态SCl2和催化剂活性炭;⑥为制取Cl2装置,经饱和食盐水除杂和浓硫酸干燥后的氯气进入三颈烧瓶中,故⑥→⑫→⑪→⑨→⑩→①;⑦为制取SO2装置,经浓硫酸干燥后的SO2进入三颈烧瓶中,故⑦→⑨→⑩→②。
点睛:
本题主要考查物质的制备和实验仪器的使用,重在实验能力和分析能力的考查,解题时首先要明确:
①制备物质的方法;②相关物质的性质(尤其是一些特殊性质),如本题中涉及的SOC12易水解、SOC12和SC12的沸点低。
注意紧扣实验目的,结合题中给出的仪器药品,选择所需装置及连接顺序。
本题易错点为Cl-的检验,注意明确制得的不纯SOCl2中的杂质成分,选择合适试剂排出干扰。
11.下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:
2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:
1的化合物,下列说法正确的是_____( 填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:
1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧ 的+3价化合物MCl3·6H2O 有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010 molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3B.[M(H2O)5Cl]Cl2·H2OC.[M(H2O)4Cl2]Cl·2H2O
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA 为______。
【答案】1s22s22p63s23p64s2Mg3N2离子键Csp3H3O+BCu2O288×1030/da3
(4)H与N形成的相对分子质量最小的化合物是NH3,氨气中价层电子对个数=3+
(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,所以与化合物NH3互为等电子体的阳离子较多,例如:
H3O+、NH4+、Na+、Mg2+、Al3+等。
11.黄酮益酸类化合物K具有抗菌、消炎的作用,合成路线设计如下图所示:
已知部分有机化合物转化的反应式如下:
ⅰ.
(R为烃基)
ⅱ.
(R、R´代表烃基或氢)
ⅲ.
(R代表烃基或氢)
请回答:
(1)A的结构简式_______,其核磁共振氢谱吸收峰面积比为________。
(2)F的结构简式_______,C→D的反应类型为_______。
(3)G与试剂b反应的化学方程式为______________。
(4)满足下列条件D的同分异构体共有_____种。
①能发生银镜反应②分子中含有酯基③苯环上有两个取代基
写出符合上述条件且苯环上的一氯取代物只有两种的同分异构体的结构简式______。
(5)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂设计出合成苯乙酸乙酯(
)的简单流程图______。
(无机试剂任选)
【答案】
3:
2:
2:
1
取代
6
、
【解析】
(1)由B的分子式、C的结构简式及A→B→C的转化关系可得,A为甲苯,其结构简式为:
;分子中有4种不同化学环境的氢原子,分别为甲基上的3个氢原子、苯环上与甲基邻位上的2个氢原子、苯环上与甲基间位上的2个氢原子、苯环上与甲基对位上的1个氢原子,故其核磁共振氢谱吸收峰面积比为3:
2:
2:
1。
(2)由E和G的结构简式、F的分子式及E→F→G的转化关系可得,F的结构简式为:
;由流程中C、D的结构简式及反应条件可得,C发生取代反应生成D。
(3)H发生反应③生成J,由J的结构简式并结合已知ⅲ可得,H为:
;G(
)与试剂b在“碱、∆”条件下反应生成H,结合已知ⅱ可得,试剂b为乙醛,则G与试剂b反应的化学方程式为:
+CH3CHO
+H2O。
。
点睛:
本题通过有机合成综合考查了有机物结构与性质,涉及结构简式的书写、有机反应类型、限制条件的同分异构体书写、合成路线的设计等知识,有一定综合性,解题时注意结合已知信息根据合成流程进行推断,针对本题特点,流程虽然比较长,但是解题时针对各个小题切入分析更有针对性,注意根据有机物之间组成元素的异同及官能团的转化确定结构简式;限制条件的同分异构体的书写是易错点,如第(4)小题既要注意取代基的的种类的判断,又要注意取代基之间位置关系的判断;第(5)小题合成路线图的设计,综合性较强,是对分析能力的考查,要注意从已知或流程中获得启发,关键是利用转化关系中隐含的增长碳链信息。