金属有机化学复习题Word文件下载.doc
《金属有机化学复习题Word文件下载.doc》由会员分享,可在线阅读,更多相关《金属有机化学复习题Word文件下载.doc(18页珍藏版)》请在冰点文库上搜索。
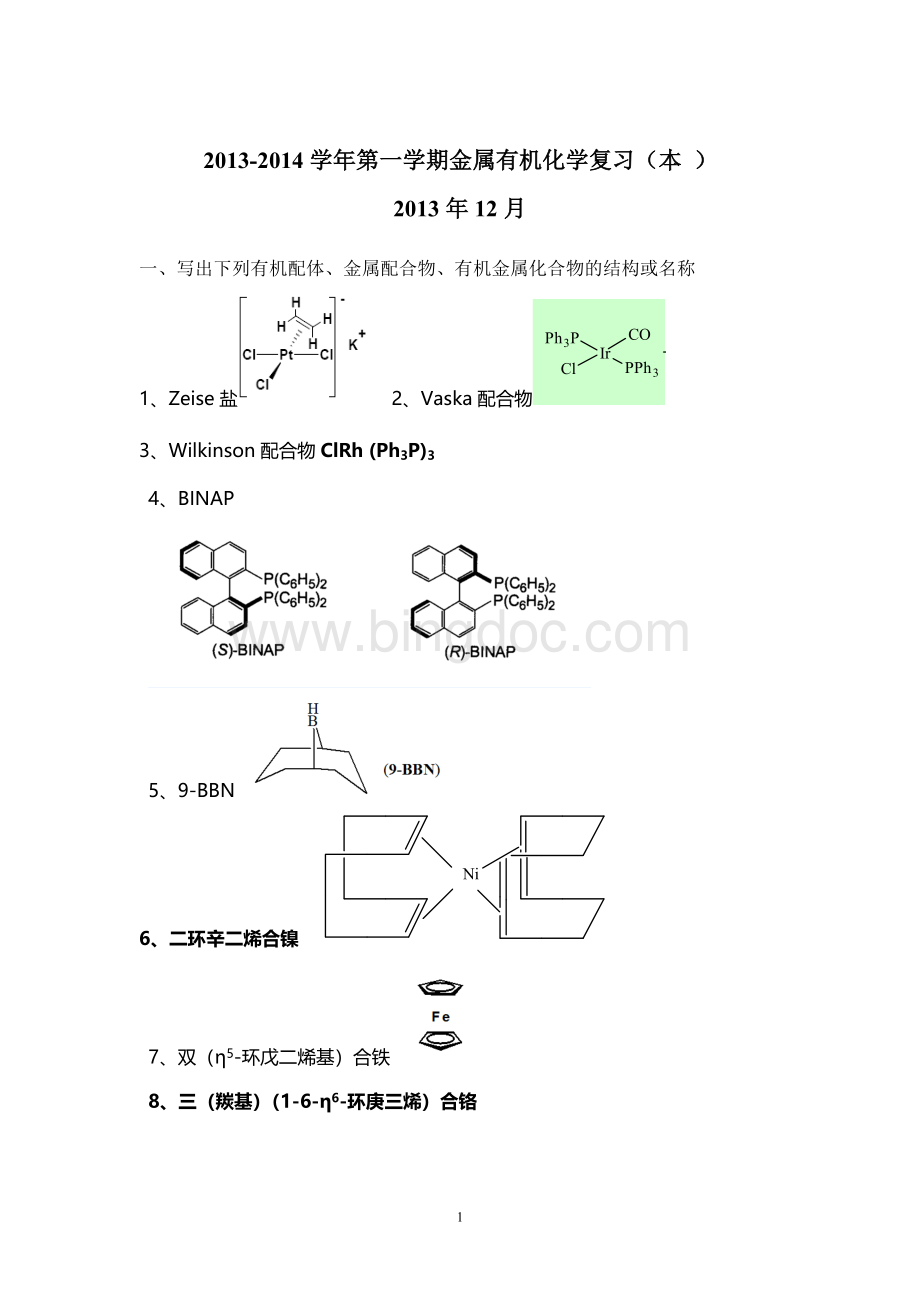
14、η5-Cp2Zr(CH3)2
15、Et2AlCl二乙基氯化铝
二、解释下列各名词
1、金属有机化合物含有金属-碳键(M-C)的化合物定义为金属有机化合物
2、过渡金属有机化合物含有过渡金属-碳键(M-C)的化合物,过渡金属含有d电子,在(n-1)d,ns,np原子构型中,(n-1)d轨道能级与ns接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数
5、环状多烯π-金属配合物
6、高自旋配合物成对能(P)大于分裂能(△)的配合物,当P>△时,因电子成对需要的能量高,电子将尽量以单电子排布分占不同的轨道,取高自旋状态。
7、低自旋配合物成对能(P)小于分裂能(△)的配合物,当P<△时,电子成对耗能较少,此时将取低自旋状态。
8、反馈π-键
烯烃的π电子配位到金属的σ空轨道,形成σ授予键,同时充满电子的金属d轨道与烯的反键空轨道π*相重叠,形成π反馈键。
9、晶体场分裂能
中心离子的d轨道的简并能级因配位场的影响而分裂成不同
组能级之间的能量差,以△表示
10、电子成对能
所谓成对能是电子在配对时为了克服静电场的排斥作用所需的能量,通俗地讲就是使自旋成对的两个电子占据同一轨道所必须付出的能量,以P表示。
11、光谱化学序列
将一些常见配体按光谱实验测得的分裂能从小到大次序排列起来,便得光谱化学序列
12、配位饱和及配位不饱和满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物
13、插入反应
不饱和烃或含有孤对电子的化合物插入过渡金属有机物的M-C,M-X或M-H键的反应称为插入反应,其逆反应称为反插入(脱出)反应
14、还原消除反应
还原消除(reductiveelimination)是氧化加成反应的逆反应,其氧化态及配位数均降低2。
还原消除反应是一个协同过程,伴随着氧化数降低和配位数减少,其实质是过渡金属有机物的一种分解反应。
还原消除反应是催化反应中给出有机产物的一步。
15、氧化加成反应
中性分子加到配位不饱和的低价过渡金属有机配合物上,使配合物中心金属的配位数和氧化态都同时上升的反应
16、Heck反应
在三乙胺存在下,醋酸钯催化卤代芳烃与烯烃反应生成苯乙烯型化合物
17、Suzuki偶联反应
在Pd(PPh3)4催化下,芳基硼酸与溴或碘代芳烃的交叉偶联反应.该反应因具有反应条件温和、可容忍多种活性官能团、受空间位阻影响不大、产率高以及芳基硼酸经济易得且对潮气不敏感等优越性而成为普遍适用的C一C键偶联方法。
三、完成下列合成反应
RhCl(PPh3)3,
C6H5Li,(C6H5)2CuLi
Fe(CO)5,
Co2(CO)8,Co4(CO)12
Ni(COD)2,
n-C4H9Li,
,
(Bu)2CuLi,PhCH=CHCH2Bu
Grignard试剂合成方程式为:
硼氢化反应方程式为:
硼氢化反应是反马氏规则的顺式加成
四、1970年Monsanto公司最先在工业上实现了手性铑配合物催化C=C不对称加氢,合成治疗帕金森综合症的特效药L-Dopa。
催化剂就是含手性双膦配体(R,R)-Dipamp的Wilkinson型配合物,得到94%ee的L-Dopa。
直到20世纪90年代Burk(杜邦公司)发现更好(99%ee)的配体DuPhos。
后来,Noyori发现新类型的手性配体(R)or(S)-BINAP,其Rh络合物催化不对称氨基酸合成的ee%最高达100%;
后来用其Ru络合物催化各种官能化烯烃的氢化,如用来合成非麻醉性消炎止痛药Naproxen(萘普生)和i-Buprofen(S-异丁基布洛芬)。
试写出这三种手性配体的结构式。
五、完成下列叙述题
1、举例说明何谓有机金属化合物,何谓金属配合物,它们在结构和性能上有何异同。
金属有机化合物含有金属-碳键(M-C)的化合物
金属与有机配体键合,但不存在直接的金属-碳键,也不是金属有机化合物,而是配位化合物。
2、简述有机金属化合物的特性。
3、简述配合物的18电子规则,并应用18电子规则说明下列化合物的稳定性差异。
(1)Fe(η5-C5H5)2
(2)Ti(η5-C5H5)2(3)Co(η5-C5H5)2
Fe(η5-C5H5)2Fe2+6电子C5H5-6电子6+2*6=18
Ti(η5-C5H5)2Ti2+2电子C5H5-6电子2+2*6=14不稳定
Co(η5-C5H5)2Co2+6电子C5H5-6电子6+2*6=18不稳定,但可以再失1个电子来稳定
4、简述配合物的EAN规则和18电子规则,并应用18电子规则说明二茂铁与二茂镍的稳定性差异。
(1)Fe(η5-C5H5)2
(2)Ni(η5-C5H5)2
Ni(η5-C5H5)2Ni2+6电子C5H5-6电子6+2*6=18不稳定,但可以再失1个电子来稳定
5、根据晶体场理论说明二价锌的配合物通常为无色配合物,而三价钛分别与不同配体结合后产生不同颜色,如:
[Ti(OH2)6]3+带有紫色
这是因为在晶体场的影响下,过渡金属离子的d轨道发生分裂,由于这些金属离子的d轨道没有充满,在吸收了一部分光能后,就可产生从低能量的d轨道向高能量d轨道的电子跃迁,这种跃迁称d-d跃迁。
配离子的颜色是从人射光中去掉被吸收的光,剩下来的那一部分可见光所呈现的颜色。
吸收光的波长越短,表示电子跃迁(被激发)所需要的能量越大,亦即Δ大,反之亦然。
而Zn2+d-d分裂能Δ值在可见光范围外~无色
在配位场的作用下,裂分的这些d能级对理解经典的配位化合物的吸收光谱、磁性和esr谱十分重要。
但在金属有机化学中,因为过渡金属有机物中由d-d跃迁引起的光谱带常被强的“电荷转移”吸收所掩盖。
事实上,随着10DQ变大,d-d跃迁光谱移至紫外区域。
所以三价钛分别与不同配体结合后产生不同颜色,[Ti(OH2)6]3+带有紫色
6、简述在八面体配合物中,d轨道裂分形成t2g轨道和eg轨道的原理并画出能级裂分图。
7、简述在四配位的正四面体过渡金属配合物中,d轨道裂分形成t2轨道和e轨道的原理并画出能级裂分图,标出相应能级的轨道符号,计算出△t值。
六、写出下列过渡金属催化反应的反应
1、写出乙烯通过催化水合反应合成乙醛的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
瓦克(Wacker)烯烃氧化反应
以顺时针方向分别是配体解离,烯烃配位,烯烃插入和氧化加成,还原消除。
2、由丁烯在Wilkinson催化剂作用下合成戊醛的反应机理(画出催化循环过程图),并写出
每步基元反应的名称。
顺时针分别是烯烃配位,配体解离,氧化加成,烯烃插入,配体配位,还原消除,氧化加成,配体解离,烯烃配位。
3、由Ni(CO)4催化下,由乙炔、乙醇合成丙烯酸乙酯的反应机画出催化循环过程图,并写出每步基元反应的名称。
4、写出在Wilkinson配合物[RhCl(PPh3)3]催化下,均相氢化合成4-(2-硝基乙基)亚甲二氧基苯的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
5.给出金属有机化学基元反应的各个名称,并分别举例说明。
⑴配体的配位和解离;
⑵氧化加成和还原消除;
(3)插入和脱出(反插入)反应;
(4)配体与外来试剂的反应
6.简述18电子规则的原理及应用,并举5个以上的典型例子加以说明。
18电子规则:
对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
它是一个经验规则,满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物。
18电子规则的重要性:
根据n+2x(CN)=18,当电子数n固定时,配合物的最高配位数可推知,同时也可以推测配合物的几何构型。
d6电子构型,为六配位的八面体;
d10电子构型,为四配位四面体。
具有同种d电子构型的络合物,配位数和配合物的构型相同。
络合物
金属(0)dn
配体电子数
总电子数
Ni(CO)4
Ni=10
4(CO)=4×
2
18
π-C5H5V(CO)4
V=5
2;
π-C5H5=5
Mn2(CO)10
2Mn=2×
7
10(CO)=10×
Mn-Mn=2
π-C3H5Fe(CO)2NO
Fe=8
2(CO)=2×
NO=3
π-C3H5=3
7.Fischer型卡宾和Schrock型卡宾在结构特点和反应性能上的不同之处在于:
Fischer型卡宾
特点:
含有一个或两个与卡宾C相连的杂原子(O,N)。
•卡宾C具有亲电性,易受亲核试剂进攻。
•亲电试剂可以进攻带孤对电子的卡宾杂原子。
•卡宾配体的β-H酸性较强,可被碱除去,生成金属卡宾阴离子,它可进一步与各种亲电试剂反应。
•金属卡宾中的羰基可被其它配体取代。
Schrock型卡宾
与卡宾C相连的只有碳或氢原子。
又称烃叉络合物
e.卡宾碳可被亲电试剂进攻
f.强碱可以夺取与卡宾碳直接相连的质子
g.卡宾络合物中的其它配体也可发生反应
前期过渡金属以形成Schrock卡宾为主
七、试根据下面反应过程,指出哪些反应步骤有基元反应发生并说明基元反应的类型?
1CO配体解离2烯烃配位3烯烃插入4CO配位5羰基插入6氢气氧化加成7还原消除
例:
Reppe反应是典型的金属催化循环反应,试根据下面反应过程,指出哪些反应步骤有基元反应发生并说明基元反应的类型?
1氧化加成+配体解离2配体配位3、4插入5还原消除