专题06 元素及其化合物三年高考化学试题附解析801377Word格式.docx
《专题06 元素及其化合物三年高考化学试题附解析801377Word格式.docx》由会员分享,可在线阅读,更多相关《专题06 元素及其化合物三年高考化学试题附解析801377Word格式.docx(18页珍藏版)》请在冰点文库上搜索。
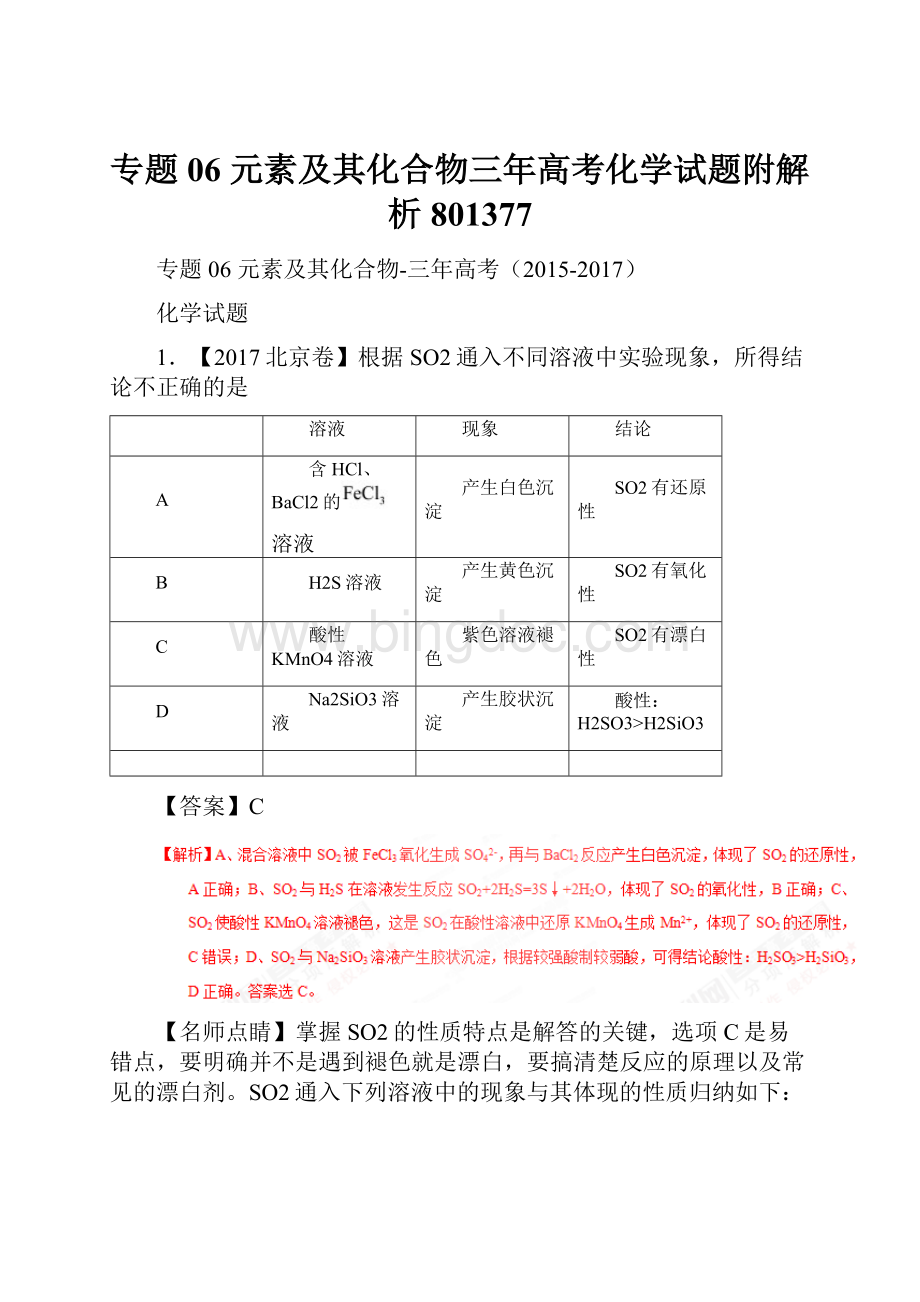
酸性KMnO4
溴水
品红
氢硫酸
(H2S溶液)
变红
褪色
生成浅黄色沉淀
性质
酸性氧化物
还原性
漂白性
氧化性
2.【2017江苏卷】下列有关物质性质与用途具有对应关系的是
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
【答案】A
【解析】A.过氧化钠可以和二氧化碳反应生成氧气,A正确;
B.因二氧化氯具有氧化性才用于自来水的杀菌消毒,B错误;
C.二氧化硅透光性好,用于制造光导纤维,C错误;
D.液氨气化时吸收大量热,所以氨可用作制冷剂,D错误。
【名师点睛】本题考查常见无机物的性质和用途。
解题的关键是要熟悉常见化学物质的重要性质,性质决定用途,性质和用途之间的对应关系要理清。
在学习元素化合物内容时,以“物质的结构决定物质的性质、物质的性质决定物质的用途”为主线构建知识网络,关注元素化合物性质在生产和生活中的应用。
3.【2017江苏卷】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe
FeCl2
Fe(OH)2
B.S
SO3
H2SO4
C.CaCO3
CaO
CaSiO3
D.NH3
NO
HNO3
【名师点睛】本题考查是元素化合物之间的转化关系及反应条件。
解题的关键是要熟悉常见物质的化学性质和转化条件,特别是要关注具有实际应用背景或前景的物质转化知识的学习与应用。
4.【2016新课标2卷】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;
再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为
A.NaHCO3、Al(OH)3
B.AgCl、NaHCO3
C.Na2SO3、BaCO3
D.Na2CO3、CuSO4
【答案】C
【解析】
试题分析:
A.NaHCO3、Al(OH)3中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化碳和水,最终无固体存在,A项错误;
B.AgCl不溶于酸,固体不能全部溶解,B项错误;
C.亚硫酸钠和碳酸钡加入足量水时,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀和二氧化碳和水,符合题意,C项正确;
D.Na2CO3、CuSO4中加入足量稀硫酸,振荡后无固体存在,D项错误;
答案选C。
【考点定位】考查物质的推断和性质。
【名师点睛】该题既能检查学生元素化合物基础知识的掌握情况,又能检查学生灵活应用知识的能力,更能考查学生的逻辑推理能力,难度较大,解答时应认真分析题干,找出明显条件和隐蔽条件。
5.【2016浙江卷】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:
NH4++NO2−==N2↑+2H2O
【答案】B
【考点定位】考查工业废水、废气的处理等知识。
【名师点睛】工业废气中的二氧化碳和二氧化硫都可以被过量的石灰乳吸收,而氮气、一氧化碳、一氧化氮不能被吸收,从亚硝酸钠和铵根离子反应生成无污染的气体分析,无污染的气体为氮气,则说明一氧化氮被氢氧化钠吸收,因为存在反应NO+NO2+2NaOH=2NaNO2+H2O,所以要使气体中的一氧化氮被氢氧化钠吸收,应该通入空气,使部分一氧化氮变成二氧化氮,且不能过量。
剩余的气体为一氧化碳,所以捕获的产物为一氧化碳。
本题考查的是非金属及其化合物的性质。
结合元素守恒和元素化合价的变化分析各物质的成分。
6.【2016海南卷】下列叙述错误的是
A.氦气可用于填充飞艇
B.氯化铁可用于硬水的软化
C.石英砂可用于生产单晶硅
D.聚四乙烯可用于厨具表面涂层
考点:
考查化学在生活的应用正误判断
【名师点睛】化学是一门实用性的学科,在日常生活及工农业生产和科学技术中应用十分广泛。
解答此类题时需注意各物质的性质与用途。
7.【2016江苏卷】下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al2O3熔点高,可用作耐高温材料
【答案】D
A、SO2用于漂白纸浆是利用其与某些有色物质作用,生成不稳定的无色物质,不是氧化性,二氧化硫与硫化氢反应生成S单质和水,表现氧化性,A错误;
B、NH4HCO3用作氮肥是因为其中含有氮元素,易被农作物吸收,与热稳定性无关,B错误;
C、Fe2(SO4)3用作净水剂是因为铁离子水解生成氢氧化铁胶体,胶体具有吸附性,能吸附水中悬浮的杂质而净水,C错误;
D、Al2O3熔点高,可用作耐高温材料,D正确。
答案选D。
【考点定位】本题主要是考查元素及其化合物性质和用途的判断
【名师点晴】掌握常见物质的性质和用途是解答的关键,注意相关基础知识的积累。
易错点是A项,注意理解二氧化硫的化学性质的多样性,例如二氧化硫通入下列溶液中的现象与其体现的性质可总结如下:
品红溶液
SO2的性质
溶于水显酸性
8.【2016江苏卷】在给定的条件下,下列选项所示的物质间转化均能实现的是
A.SiO2
SiCl4
Si
B.FeS2
SO2
H2SO4
C.N2
NH3
NH4Cl(aq)
D.MgCO3
MgCl2(aq)
Mg
【考点定位】本题主要是考查元素及其化合物相互转化的有关判断
【名师点晴】掌握常见元素及其化合物的性质是解答的关键,注意相关基础知识的积累,注意二氧化硅化学性质的特殊性。
金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:
1.热分解法:
适用于不活泼的金属,如汞可用氧化汞加热制得;
2.热还原法:
用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;
3.电解法:
适用于K、Ca、Na、Mg、Al等活泼金属;
4.其他方法:
如CuSO4+Fe===Cu+FeSO4。
9.【2016上海卷】向新制氯水中加入少量下列物质,能增强溶液漂白能力的是
A.碳酸钙粉末B.稀硫酸C.氯化钙溶液D.二氧化硫水溶液
【考点定位】考查氯水的性质。
【名师点睛】氯水的成分及其性质是中学化学的重要考点,在新制的氯水中存在下列关系:
Cl2+H2O
H++Cl−+HClO、HClO
H++ClO−、H2O
H++OH−,氯水中存在三分子:
H2O、Cl2、HClO,四离子:
H+、Cl−、ClO−、OH−。
所以,新制的氯水呈浅黄绿色,有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①Cl2的强氧化性;
②HCl的酸性;
③HClO的强氧化性(漂白性等)、弱酸性;
④Cl−的性质等。
特别注意的是氯气和水的反应为可逆反应、HClO存在电离平衡,分析氯水的性质时要结合反应条件及平衡移动原理。
10.【2016上海卷】一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是
A.过量的氢气与氮气B.过量的浓盐酸与二氧化锰
C.过量的铜与浓硫酸D.过量的锌与18mol/L硫酸
【答案】AC
A.H2和N2制备NH3是可逆反应,反应物始终不能消耗完;
B.可以加入过量的浓盐酸,使二氧化锰彻底反应完全;
C.浓硫酸随着反应变稀,稀硫酸不再与铜反应;
D.18mol/L的浓硫酸与锌开始反应产生SO2,随着反应进行,浓硫酸变稀,再与锌反应产生H2。
故选AC。
【考点定位】考查常见可逆反应的判断。
【名师点睛】常见化学反应中,有些反应能否发生(或者能否完全反应)以及生成产物的种类,除了与反应本身特点有关外,往往与反应物的量(或浓度)有关。
常见反应有:
①所有的可逆反应;
②二氧化锰只能与浓盐酸反应生成氯气;
③铜只能与浓硫酸在加热条件下反应;
④活泼金属与稀硫酸反应生成氢气、与浓硫酸生成二氧化硫,两个反应的原理不同;
⑤澄清石灰水中通入二氧化碳(或二氧化硫)气体,随着气体的量不同产物不同;
⑥碳酸钠溶液中逐滴加入稀盐酸的反应;
⑦可溶性铝盐与强碱溶液、可溶性偏铝酸盐与强酸溶液的反应;
⑧银氨溶液的配制过程;
⑨变价金属铁与定量浓硫酸、浓稀硝酸的反应等等。
建议整理的过程中写出相应的离子方程式。
11.【2016上海卷】类比推理是化学中常用的思维方法。
下列推理正确的是
A.CO2是直线型分子,推测CS2也是直线型分子
B.SiH4的沸点高于CH4,推测H2Se的沸点高于H2S
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
【答案】AB
【考点定位】考查类比推理方法在掌握化学知识中的合理运用。
【名师点睛】类比推理是学习和研究化学物质及其变化的一种常用的科学思维方法。
由于物质的结构决定性质、性质决定用途,结构相似的物质往往具有相似的物理、化学性质。
所以,依据事先设定好的“标准”将物质进行合理分类,对掌握物质的结构、通性等化学知识起着事半功倍的作用。
但由于各种物质组成和结构具有一定的差异性,运用类推法时一定不能完全照搬。
12.【2015安徽卷】下列有关说法正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
【解析】A、Na2CO3固体受热不易分解,故A错误;
B、Fe(OH)3胶体是红褐色,故B错误;
C、以上三种气体都不与浓硫酸反应,能用浓硫酸干燥,故C正确;
D、SiO2和氢氟酸反应,没有生成盐和水,不是两性氧化物,故D错误;
此题选C。
【考点定位】本题考查几种常见无机化合物的性质,包括盐、氧化物和氢氧化物的性质,还涉及到胶体的性质。
13.【2015北京卷】下列关于自然界中氮循环(如图)的说法不正确的是:
A.但元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
非金属元素氮的物理和化学性质
14.【2015福建卷】纯净物X、Y、Z转化关系如图所示,下列判断正确的是
A.X可能是金属铜
B.Y不可能是氢气
C.Z可能是氯化钠
D.Z可能是三氧化硫
【考点定位】考查物质的性质及转化关系的正误判断的知识。
15.【2015新课标1卷】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:
“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。
”这里的“强水”是指
A.氨水B.硝酸C.醋D.卤水
【解析】根据所给四种物质的氧化性的强弱可判断,该强水为硝酸,硝酸具有强氧化性,可溶解大部分金属。
答案选B。
【考点定位】本题考查历史背景下的化学知识,核心考点为元素化合物知识。
难度为容易等级
16.【2015新课标2卷】海水开发利用的部分过程如图所示。
下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
【解析】A.氯气具有强氧化性,能把溴离子氧化为单质溴,因此向苦卤中通入Cl2是为了提取溴,A正确;
B.粗盐中的钙离子、镁离子等可采用沉淀法除去,所得氯化钠溶液可采用重结晶等过程提纯,B正确;
C.工业生产常选用来源更广泛、价格更便宜的石灰乳作为沉淀剂,用氢氧化钠不经济,C错误;
D.富集溴一般先用空气和水蒸气吹出单质溴,SO2具有还原性,能被溴氧化,因此再用SO2将其还原吸收,D正确,答案选C。
【考点定位】本题以海水的综合开发利用为载体重点考查了粗盐的提纯、海水提取溴、物质的分离与提纯操作、试剂的选取等,题目难度中等。
17.【2015浙江卷】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·
7H2O),设计了如下流程:
下列说法不正确的是()
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·
7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·
7H2O
【考点定位】本题以流程图的形式考查离子反应、物质分离、实验流程、实验评价、实验条件控制等。
涉及试剂的选择、溶液pH控制、硫酸亚铁性质、实验条件选择和控制等。
18.【2015重庆卷】下列说法正确的是
A.I的原子半径大于Br,HI比HBr的热稳定性强
B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C.Al2O3和MgO均可与NaOH溶液反应
D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
【解析】A.非金属性Br>
I,则HBr比HI的热稳定性强,A错误;
B.非金属性P>
Si,则H3PO4比H2SiO3的酸性强,B正确;
C.Al2O3属于两性氧化物,能与氢氧化钠溶液反应,MgO属于碱性氧化物,与NaOH溶液不反应,C错误;
D.SO2在酸性环境中能被Ba(NO3)2氧化成硫酸钡,则SO2和SO3混合气体通入Ba(NO3)2溶液只得到BaSO4白色沉淀,D错误;
【考点定位】本题主要考查原子半径的大小比较,由非金属性强弱来比较气态氢化物的稳定性以及最高价含氧酸的酸性的强弱,铝、镁、硫的化合物的化学性质。
19.【2015上海卷】下列物质见光不会分解的是
A.HClOB.NH4ClC.HNO3D.AgNO3
【考点定位】考查物质的稳定性与反应条件的关系的知识。
20.【2015上海卷】二氧化硫能使溴水褪色,说明二氧化硫具有
A.还原性B.氧化性C.漂白性D.酸性
【解析】二氧化硫能使溴水褪色,是由于发生反应:
Br2+SO2+2H2O=H2SO4+2HBr。
在该反应在二氧化硫中的S元素的化合价升高,失去电子,表现还原性。
故答案的A。
【考点定位】考查二氧化硫的化学性质的知识。
21.【2015山东卷】某化合物由两种单质直接反应生成,将其加入BaHCO3溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是
A.AlCl3B.Na2OC.FeCl2D.SiO2
【解析】A、AlCl3可由单质Al与Cl2反应制得,AlCl3与Ba(HCO3)2反应生成CO2和Al(OH)3沉淀,同时有气体和沉淀产生,正确;
B、Na2O与Ba(HCO3)2反应生成BaCO3沉淀、Na2CO3和H2O,没有气体生成,错误;
C、因为Cl2具有强氧化性,Cl2与Fe反应只能生成FeCl3,FeCl2不能由两种单质直接反应生成,错误;
D、SiO2不与Ba(HCO3)2反应,错误。
【考点定位】本题考查物质的性质,涉及了单质之间的反应以及反应现象的判断。
22.【2015江苏卷】给定条件下,下列选项中所示的物质间转化均能一步实现的是()
A.粗硅
B.Mg(OH)2
MgCl2(aq)
C.Fe2O3
FeCl3(aq)
无水FeCl3
D.AgNO3(aq)
[Ag(NH3)2]OH(aq)
Ag
【考点定位】考查元素及其化合物的性质。
23.【2015海南卷】下列叙述正确的是()
A.稀盐酸可除去烧瓶内残留的MnO2B.可用磨口玻璃瓶保存NaOH溶液
C.稀硝酸可除去试管内壁的银镜D.煮沸自来水可除去其中的Ca(HCO3)2
【答案】C、D
【解析】A、稀盐酸与MnO2不能发生反应,不能除去烧瓶内残留的MnO2,错误;
B、NaOH与玻璃中的SiO2会发生反应:
2NaOH+SiO2=Na2SiO3+H2O,产生的Na2SiO3有粘合性,将玻璃瓶与玻璃塞黏在一起,因此不能使用玻璃塞,要用橡胶塞,错误;
C、稀硝酸具有强氧化性,能够与Ag发生反应产生可溶性的AgNO3,达到除去试管内壁的银镜的目的,正确;
D、煮沸自来水,Ca(HCO3)2不稳定,受热会发生反应:
Ca(HCO3)2
CaCO3+H2O+CO2↑,达到除去Ca(HCO3)2的目的,正确。
【考点定位】本题考查物质的性质和用途。