92电解池Word格式文档下载.docx
《92电解池Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《92电解池Word格式文档下载.docx(13页珍藏版)》请在冰点文库上搜索。
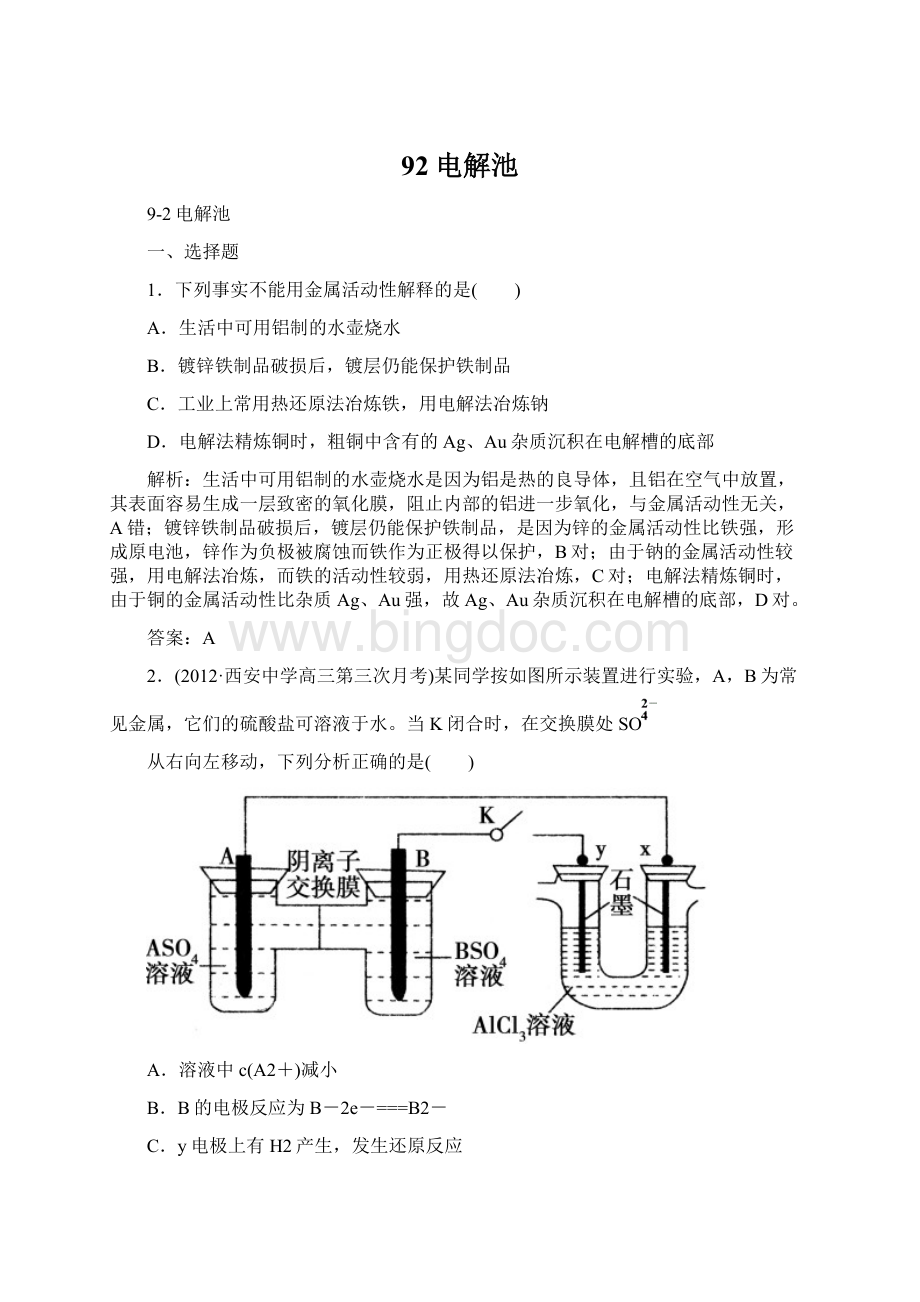
,故D正确。
D
3.(2011·
辽宁省重点中学协作体高三期末)用惰性电极电解50mL锰酸钾溶液:
K2MnO4+H2O===KMnO4+H2↑+KOH(未配平),当生成112mL氢气(标准状况)时停止通电。
下列判断正确的是( )
A.K+浓度减小
B.KMnO4在阳极区生成
C.阴极周围溶液的pH减小
D.反应过程中共转移0.005mol电子
本题考查电解池原理,考查考生知识的运用能力。
难度较小。
惰性电极电解K2MnO4溶液,溶液中K+未参与的反应,A项错误;
MnO
移向阳极,电极反应式:
-e-===MnO
,B项正确;
H+移向阴极,电极反应式:
2H++2e-===H2↑,使得阴极剩余大量的OH-,pH增大,C项错误;
每生成1molH2转移2mol电子,现生成标准状况下112mLH2,即0.005molH2共转移0.01mol电子,D项错误。
B
4.(2012·
哈尔滨市第三中学高三年级期末)下面有关电化学的图示,完全正确的是( )
本题考查电化学装置图。
A项,Zn比Cu活泼,为负极,错;
B项;
粗铜精炼时,粗铜必须作阳极,错;
C项,镀层金属作阳极,待镀金属作阴极,错;
D项,从电流方向知,碳棒为阳极,Cl-放电生成Cl2,用淀粉KI溶液检验,铁棒为阴极,H+放电生成H2,用向下排空气法收集,正确。
5.(2012·
长春市高中毕业班第一次调研考试)图中是电解CuCl2溶液的装置,其中c,d为石墨电极。
则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,氯离子浓度不变
D.电解过程中,d电极质量增加
本题考查原电池、电解池的相关知识。
根据电流方向进行推断可知,直流电源的a,b极分别为正极、负极;
电解过程中Cl-在阳极上被氧化为氯气,在阴极(d极)上析出Cu导至电极质量增加。
6.用石墨作电极电解2mol·
L-1的NaCl和1mol·
L-1的MgSO4混合溶液时,下列曲线合理的是( )
依据2NaCl+2H2O
2NaOH+H2↑+Cl2↑
MgSO4+2NaOH===Mg(OH)2↓+Na2SO4,溶液起始及最终的pH均接近于7,沉淀量从起始至最终应是先逐渐增加,后期保持不变,故D项正确。
7.(2010·
福建高考)铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是( )
A.K闭合时,d电极反应式:
PbSO4+2H2O-2e-===PbO2+4H++SO
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2mol
C.K闭合时,Ⅱ中SO
向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
根据图示,Ⅰ为原电池,a为正极,b为负极。
Ⅱ为电解池,c为阴极,d为阳极。
K闭合时,d为阳极,发生氧化反应:
PbSO4-2e-+2H2O===PbO2+4H++SO
,A项正确,根据铅蓄电池的总反应知该反应中转移电子数为2e-,则电路中转移0.2mol电子时,Ⅰ中消耗0.2molH2SO4,B项正确;
K闭合时,Ⅱ中SO
向阳极(d极)迁移,C项错误;
K闭合一段时间后,c电极析出Pb,d电极析出PbO2,电解质溶液为H2SO4,此时可以形成铅蓄电池,d电极作正极,D项正确。
C
8.(2011·
黄冈高三期末)如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( )
A.甲池b极上析出金属银,乙池c极上析出某金属
B.甲池a极上析出金属银,乙池d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
a:
阴极;
b:
阳极;
c:
d:
阳极。
A、B均不对,而D中,若电解Mg(NO3)2溶液,实际上就是电解水,不会有固体析出;
C中通过计算可知CuSO4不足。
9.在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀。
取一定量溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的质量之比为( )
A.35.5:
108 B.1:
2
C.108:
35.5D.8:
1
电解前,AgNO3、Ba(NO3)2、NaCl、K2SO4之间发生反应,最终溶质只剩下NaNO3、KNO3。
只有水被电解,显然D项正确。
10.(2012·
石家庄市高中毕业班教学质量检测
(一))全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统。
电池反应为VO
+V2++2H+
VO2++V3++H2O,下列说法正确的是( )
A.该电池属于一次电池
B.电池工作时,H+由正极流向负极
C.电池放电时,负极的电极反应为VO2++H2O===VO
+2H++e-
D.电池充电时,阴极的电极反应为V3++e-===V2+
本题考查电化学原理应用。
难度较大。
该电池为可充电电池,属于二次电池,故A选项错误;
电池工作时,H+在原电池的内部由负极流向正极,故B选项错误;
电池放电时,负极发生氧化反应为V2+-e-===V3+,故C选项错误;
电池充电时,阴极发生还原反应:
V3++e-===V2+,故D选项正确。
11.用质量均为100g的铜片作电极,电解AgNO3溶液,电解一段时间后两极质量相差28g,此时阳极质量为( )
A.121.6g B.93.6g
C.89.6g D.88.2g
设电解过程中电子转移nmol,阳极质量减少64×
g,阴极质量增加108ng,即108n+64×
=28,n=0.2mol,阳极质量为:
100g-64×
g=93.6g。
12.电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg+B.0.02mol/LZn2+
C.0.20mol/LCu2+D.0.20mol/LPb2+
根据离子的放电顺序可知,当电路中通过0.04mol的电子时,能析出金属的只有选项A和C,100mL溶液中分别含有Ag+:
0.01mol,1.08g;
Cu2+:
0.02mol,1.28g可知选C。
13.(2012·
北京市东城区高三第一学期期末)用a,b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)n(CuSO4)=19]。
t1时刻a电极得到混合气体,其中Cl2在标准状况下为224mL(忽略气体的溶解);
t2时刻Cu全部在电极上析出。
A.a电极和电源的负极相连
B.t2时,两电极的质量相差3.84g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH--4e-===2H2O+O2↑
本题考查电解原理及其具体应用,考查考生综合运用知识灵活解决问题的能力。
根据a电极得到含Cl2的混合气体,断定a电极为阳极,应与电源的正极相连,A项错误;
电解过程等效于首先电解CuCl2,而后电解CuSO4溶液,所以a电极质量不变,由电解液中溶质的比例以及所得的n(Cl2)推得,b电极上n(Cu)=n(CuSO4)=60mol,质量增加3.84g,B项正确;
当Cl-电解完全后,a电极发生反应2H2O-4e-===4H++O2↑,溶液中c(H+)增大,pH减小,C项错误;
t2时,Cu全部析出,开始电解水,b电极发生的反应是2H2O+2e-===H2↑+2OH-,D项错误。
14.(2011·
山东理综)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
根据原电池的构成条件可知该镀锌装置不能构成原电池,A项错;
电镀时能量守恒,而锌析出量与能量的转化无关,只与通过的电量成正比,故B项错;
因电流恒定,单位时间内通过导线的电子恒定,故升高温度不改变电解反应速率,C项正确;
镀锌层破损后则构成锌铁原电池,铁作正极,锌作负极,对铁制品仍有保护作用,故D项错。
15.(2012·
长沙市高考模拟高考
(一))用甲图所示装置通电10min后,去掉直流电源,连接成乙图所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
下列说法正确的是( )
A.甲图装置中的现象是U形管两端生成等体积的气体,U形管中溶液部分压入烧杯中
B.甲图装置通电10min后U形管中溶液的pH降低
C.乙图装置进行实验时石墨电极的电极反应为O2+2H2O+4e-===4OH-
D.若乙图装置中转移电子0.2mol,则生成白色胶状物质的质量为10.7g
本题考查电化学。
甲图装置中两极产生H2和O2,且两者体积不等,A错误;
甲图装置中实质是电解水,c(NaOH)增大,pH增大,B错误;
乙图装置中石墨电极是正极,O2得电子发生还原反应,C正确;
乙图装置中Fe失电子,发生氧化反应,由Fe-2e-===Fe2+,n(Fe2+)=
=0.1mol,n[Fe(OH)2]=0.1mol,m[Fe(OH)2]=9g,D错误。
二、非选择题
16.如图,C、D、E、F、X、Y都是惰性电极。
将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。
试回答下列问题:
(1)A极为电源的________极。
(2)甲装置中电解反应的总化学方程式是____________________
____________________________________________________________________________________________________________________。
(3)乙装置中F极附近显红色的原因是______________________
___________________________________________________________________________________________________________________。
(4)欲用丙装置精炼铜,G应该是________(填“纯铜”或“粗铜”),电解质溶液的成分是________。
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的胶粒,那么装置丁中的现象是:
___________________________________________
_________________________________________________________。
本题的突破口为“F极附近显红色”,显红色的原因是生成了OH-,而OH-是由于水电离出的H+放电,促进了水的电离而生成的。
H+放电说明该极为阴极,B极为负极,则A极为正极。
(4)电解精炼铜时应将粗铜作阳极,精铜作阴极,CuSO4溶液作电解质溶液。
通电后,阳极(粗铜)的主要反应是Cu-2e-===Cu2+。
当粗铜的表面出现比铜活泼的金属时,它们也会放电。
但生成的阳离子的氧化性比铜离子弱,不可能在阴极上析出,故留在溶液中。
而粗铜中活泼性比铜弱的金属会在阳极的底部沉积,成为阳极泥。
所以,阴极(精铜)的反应只有Cu2++2e-===Cu,这样就可以在阴极上获得纯净的金属铜。
(5)氢氧化铁胶粒带正电荷,向阴极(Y极)移动,则该极附近红褐色变深。
(1)正
(2)CuCl2
Cu+Cl2↑
(3)F极为阴极,H+放电,促进了水的电离,生成了OH-,使酚酞显红色 (4)粗铜 硫酸铜溶液 (5)Y极附近红褐色变深
17.在如图所示的装置中,若通往电流电5min时,铜电极质量增加2.16g,试回答:
(1)电源电极X为______极。
(2)pH变化:
A______,B______,C______(填“增大”、“减小”或“不变”)
(3)通电5min时,B中共收集224mL气体(标准状况),溶液体积为200mL。
则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH为______(设电解前后溶液体积无变化)。
(1)C装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极。
(2)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大。
B装置阴极上先析出铜,当铜离子消耗完后析出氢气,而阳极上析出氧气,溶液中氢离子浓度增大。
C装置阴极析出银单质,阳极上的银失去电子变成银离子,理论上溶液的物质的量浓度不变。
(3)B装置两极上电子转移的数目与C装置中转移的电子数目相同。
C装置中转移的电子数目为
=0.02mol。
经判断,B装置两极上的反应为:
阴极:
Cu2++2e-===Cu,2H++2e-===H2↑
阳极:
4OH--4e-===O2↑+2H2O
根据题意可知:
2n(H2)+2n(Cu)=4n(O2)=0.02mol,n(H2)+n(O2)=
,解得n(Cu)=0.005mol,CuSO4溶液的物质的量浓度为:
0.005mol/0.2L=0.025mol/L。
(4)A装置的反应为:
2KCl+2H2O
2KOH+H2↑+Cl2↑,即反应中转移电子的物质的量与生成的氢氧根离子的物质的量相等,为0.02mol。
c(OH-)=
=0.2mol/L,故pH=13。
(1)负
(2)增大 减小 不变
(3)0.025mol/L (4)13
18.(2012·
海南化学)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为_____________、________________;
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是______,电解氯化钠溶液的总反应方程式为_______________;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为_______(法拉第常数为F=9.65×
104C·
mol-1,列式计算),最多能产生的氯气体积为______L(标准状况)。
(1)甲烷燃料电池的总反应方程式为:
CH4+2O2+2OH-===CO
+3H2O,正极反应式为2O2+4H2O+8e-===8OH-,负极反应式由总反应式减去正极反应式即可得到;
(2)由图示可知,甲烷燃料电池中通入CH4的一极为负极,因而与之相连的b电极为阴极,产生的气体为氢气;
(3)1mol甲烷被氧化失去电子8mol,电量为8×
9.65×
104C,题中虽有两个燃料电池,但电子的转移只能用一个电池的甲烷量计算,可根据CH4~8e-~4Cl2计算出标准状况下产生氯气的体积为4L。
(1)O2+2H2O+4e-===4OH-
CH4+10OH--8e-===CO
+7H2O
(2)H2 2NaCl+2H2O
(3)
×
8×
mol-1=3.45×
104C 4
19.已知20℃时NaCl的溶解度为36g。
某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11.2m3气体(已折算成标准状况)。
请回答下列问题:
(1)该反应的离子方程式为__________________。
(2)取阳极区溶液作系列实验,下列结论中错误的是( )
A.滴加酚酞试剂,先变红后褪色
B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生
D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:
kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?
(折算成标准状况,假设该燃料电池的电量利用率为90%)
(1)2Cl-+2H2O===2OH-+Cl2↑+H2↑
(2)A
(3)n(H2)=
=500mol
n(总NaCl)=1000/0.9mol
m(总NaCl)=1000/0.9mol×
58.5g/mol=65000g
m(NaCl溶液)=65000g×
136/36×
10-3=245.6kg
(4)由n(H2)=500mol得:
n(CH4)=500mol×
2/8=125mol
V(CH4)=125mol×
22.4L/mol×
10-3m3/L/0.9=3.1m3