高中有机化学实验.docx
《高中有机化学实验.docx》由会员分享,可在线阅读,更多相关《高中有机化学实验.docx(23页珍藏版)》请在冰点文库上搜索。
高中有机化学实验
高中有机化学实验
一、有机化学实验的一般特点
1.加热方法的变化水浴加热的特点:
2.产物一般需分离提纯
3.温度计的使用注意温度计的位置
4.常用到冷凝、回流装置*
二、有机制备反应
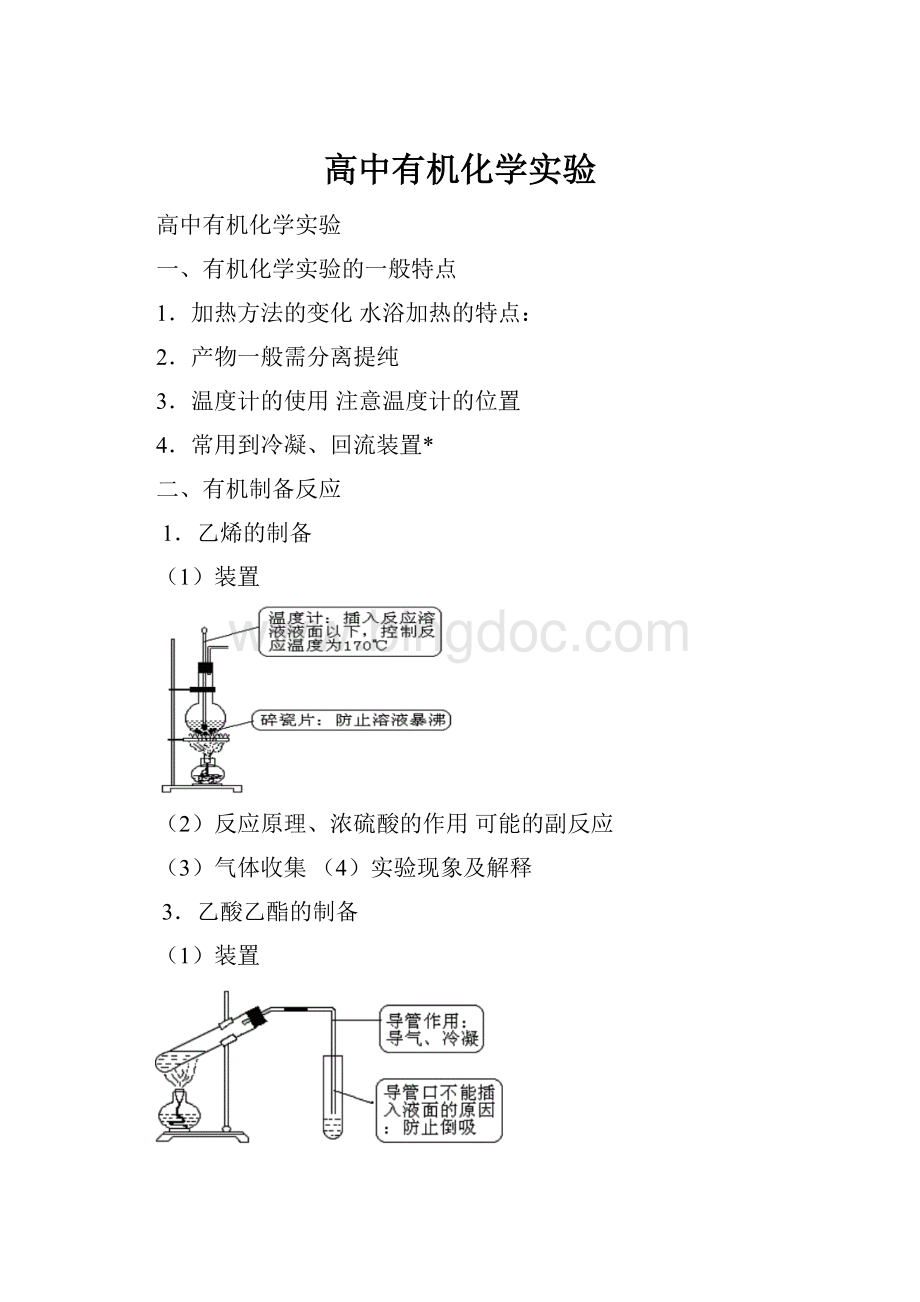
1.乙烯的制备
(1)装置
(2)反应原理、浓硫酸的作用可能的副反应
(3)气体收集(4)实验现象及解释
3.乙酸乙酯的制备
(1)装置
(2)反应原理、浓硫酸的作用
(3)饱和碳酸钠溶液的作用:
减少乙酸乙酯的溶解、除去乙酸等杂质、增大乙酸乙酯与水溶液的密度差,有利于液体分层。
4.溴苯的制备
(1)装置
(2)反应原理(3)溴苯的提取
5.硝基苯的制备
(1)装置
(2)反应原理、浓硫酸的作用
(3)浓硝酸与浓硫酸应怎样混合?
三、有机分离、提纯实验
1.分液用于两种互不相溶(密度也不同)的液体的分离。
2.蒸馏用于沸点不同的液体的分离。
分馏的原理与此相同。
3.洗气
用于气体的吸收。
一般用液体吸收(即洗气)、也可用固体吸收。
其他不常用的还有如:
盐析、渗析、过滤等
四、有机性质实验
1.卤代烃水解及卤原子的检验注意水解后溶液的酸化
2.乙醇的催化氧化实验注意现象(Cu丝先变黑后变红)及现象解释
3.银镜反应注意银氨溶液的制备、水浴加热、银镜的洗去
4.乙醛与新制氢氧化铜共热实验注意新制氢氧化铜的配制、反应原理
5.糖类水解及产物的检验注意产物检验前用碱溶液中和酸
五、有机物的分离和提纯
1.气态混合物的提纯---洗气
除去下列物质中的杂质(括号中的为杂质):
a.乙烷(乙烯):
溴水(注意:
高锰酸钾以及氢氧化钠的使用)
b.乙炔(硫化氢):
硫酸铜溶液或氢氧化钠溶液
c.甲烷(甲醛):
水(甲醛易溶于水)※家居装修
d.乙烷(水蒸气):
浓硫酸或碱石灰、五氧化二磷、氯化钙(注意:
干燥管的使用)
2.液态混合物的分离和提纯
1.分离溴水中的溴和水萃取分液(四氯化碳、苯、直馏汽油、乙酸乙酯、乙醚等)
2.分离石油中的汽油和柴油分馏
3.从皂化反应后的混合液中分离出肥皂(高级脂肪酸钠)盐析(NaCl)
※注意:
蛋白质的盐析(饱和硫酸钠溶液或硫酸铵溶液)
4.分离苯和苯酚的混合物
※不能用溴水,三溴苯酚易溶于苯
5.提纯下列物质(括号中的为杂质)
a.溴乙烷(乙醇)水(分液)
b.硝基苯(硝酸)氢氧化钠溶液(分液)
c.苯(甲苯)高锰酸钾溶液(分液)
d.溴苯(溴)氢氧化钠溶液(分液)
e.乙酸乙酯(乙酸、乙醇)饱和碳酸钠溶液(分液)
f.淀粉液(氯化钠)蒸馏水(渗析)
g.乙醇(水)CaO(蒸馏)
【跟踪练习】
1.苯甲酸广泛应用于制药和化工行业。
某同学尝试用甲苯的氧化反应制备苯甲酸。
反应原理:
实验方法:
一定量的甲苯和KMnO4溶液在100℃反应一段时间停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:
苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为___________,操作Ⅱ为______________。
(2)无色液体A是_________,定性检验A的试剂是_______________,现象是______________________________________________________________________
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。
该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。
请在答题卡上完成表中内容。
序号
实验方案
实验现象
结论
①
将白色固体B加入水中,加热溶解,
__________________
得到白色晶体和无色滤液
②
取少量滤液于试管中,
__________________________________
生成白色沉淀
滤液含Cl-
③
干燥白色晶体,
______________________________
______________________
白色晶体
是苯甲酸
(4)纯度测定:
称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH额物质的量为2.40×10-3mol。
产品中甲苯酸质量分数的计算表达式为___________,计算结果为___________(保留两位有效数字)。
2.化学上常用燃烧法确定有机物的组成。
下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。
根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是________,写出有关反应的化学方程式:
______________________________________________________________
(2)C装置(燃烧管)中CuO的作用是。
(3)写出E装置中所盛放物质的名称,它的作用是。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。
经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式。
3.如图是一套实验室制取乙烯并验证乙烯具有
还原性的实验装置。
请回答:
(1)实验步骤:
①________________________________________;
②在各装置中注入相应的试剂(如图所示);
③___________________________________________;
实验时,烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是_____________________________________________;装置甲的作用是____________________________________。
若无甲装置,是否也能检验乙烯具有还原性,简述其理由:
_____________________________________________________。
4.某化学课外小组用下图所示的装置制取溴苯。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式
_______________________________________
(2)观察到A中的现象是
___________________________________________
(3)实验结束时,打开A下端的活塞,让反应液流入B
中,充分振荡,目的是________________________________________,写出有关反应的化学方程式________________________________________________________。
(4)C中盛放CCl4的作用是______________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应。
可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。
另一种验证的方法是向试管D中加入_________________,现象是___________________________________。
5.实验室制备硝基苯的实验装置如下图所示,主要步骤如下:
①配制一定比例的浓H2SO4和浓HNO3混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用
蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓H2SO4和浓HNO3混合酸时,操作注意事项是_____________________________________________________________________________。
(2)步骤③中,为了使反应在50—60℃下进行,常用的方法是___________________。
(3)步骤④中洗涤和分离粗硝基苯应使用的仪器是_________________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是________________________________。
(5)纯硝基苯是无色、密度比水____(填“小”或“大”)、具有_______味的油状液体。
6.溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:
在试管中加入5mL1mol/LNaOH溶液和5mL溴乙烷,振荡。
实验操作II:
将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是
_______________________________________________________________
(2)观察到___________________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是____________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________________,检验的方法是_____________________________________
(需说明:
所用的试剂、简单的实验操作及预测产生的实验现象)。
7.1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。
在实验中可以用下图所示装置制备1,2二溴乙烷。
其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。
请填写下列空白:
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。
请你写出乙醇的这个消去反应方程式:
___________________________________________________。
(2)写出制备1,2二溴乙烷的化学方程式:
。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。
请写出发生堵塞时瓶b中的现象:
。
(4)容器c中NaOH溶液的作用是:
。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因:
__________________
________________________________________________________________________________________
(6)e装置内NaOH溶液的作用是。
8.某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:
______________________________________________________________________
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_____________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是_______________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是_____________,集气瓶中收集到的气体的主要成分是_____________。
(4)试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______________。
要除去该物质,可在混合液中加入_______(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过____________(填实验操作名称)即可除去。
(5)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是__________________________________________________,
②若鼓气速度过快反应会停止,原因:
_________________________________________,
③若鼓气速度过慢反应也会停止,原因:
________________________________________。
9.醇与氢卤酸反应是制备卤代烃的重要方法。
实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4
HBr+NaHSO4①
R-OH+HBr
R-Br+H2O②
可能存在的副反应有:
醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。
有关数据列表如下;
乙醇
溴乙烷
正丁醇
1-溴丁烷
密度/g·cm-3
0.7893
1.4604
0.8098
1.2758
沸点/℃
78.5
38.4
117.2
101.6
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是。
(填字母)
a.圆底烧瓶b.量筒c.锥形瓶d.布氏漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)醇;其原因是
________________________。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是___。
(填字母)
a.减少副产物烯和醚的生成b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是__。
(填字母)
a.NaIb.NaOHc.NaHSO3d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于__________;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_______。
10.实验室可利用甲醇、空气和铜制备甲醛。
甲醇和甲醛的沸点和水溶性见下表:
下图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
(1)若按(甲)装置进行实验,则通入A管的X是____________,B中反应的化学方程式为____________________________________________________________。
(2)若按(乙)装置进行实验,则B管中应装____________,反应的化学方程式为________________________________________________。
(3)C中应装的试剂是___________。
(4)在仪器组装完成后,加试剂前都必须要进行的操作是______________________;若添加药品后,如何检验(乙)装置的气密性?
_____________________________________
_______________________________________________________________________。
(5)两种装置中都需加热的仪器是___________(填“A”、“B”或“C”),加热的方式为___________________________________。
实验完成时,都应先停止对______(填“A”、“B”或“C”)加热,再____________________________。
实验完成时,先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是____________,其工作原理为:
_____________________________________________________________________。
(6)你认为用哪套装置较好?
______(填“(甲)”或“(乙)”),理由是______________________________________________。
11.关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用.
B.在洗净的试管里配制银氨溶液.
C.向银氨溶液中滴入3~4滴乙醛稀溶液.
D.加热.
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________
(2)简述银氨溶液的配制过程:
__________________________________________
________________________________________________________________________.
(3)写出乙醛发生银镜反应的化学方程式:
________________________________________________________________________.
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:
已知:
[Ag(NH3)2]+
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:
__________________________________
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是_________________.
12.某同学用右图所示实验装置制取乙酸乙酯。
回答以下问题:
饱和碳酸钠溶液
(1)在大试管中先加入3mL ,然后一边摇动一边慢慢地加入2mL 和2mL乙酸,混合均匀,然后加入几粒碎瓷片。
按上图连好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是:
。
(3)加热前,大试管中加入几粒碎瓷片的作用是 ,饱和碳酸钠溶液的作用是:
。
(4)乙酸乙酯的密度比水 (填“大”或“小”),有 气味。
(5)与书中采用的实验装置的不同之处是:
这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:
① ,② 。
(6)有甲、乙、丙三位同学,分别将乙酸与乙醇反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来。
但他们的结果却不同:
①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质。
试分析产生上述各种现象的原因。
①______________________________________________________________________________________
②______________________________________________________________________________________
③______________________________________________________________________________________
(7)下图是某同学探究“分离乙酸乙酯、乙醇、乙酸混合物”实验操作步骤流程图。
请写出图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称。
(a)____________(b)____________①__________②________③__________
13.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH.
②有关有机物的沸点见下表:
试剂
乙醚
乙醇
乙酸
乙酸乙酯
沸点(℃)
34.5
78.3
118
77.1
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸和浓硫酸,B中放有饱和碳酸钠溶液.试回答:
(1)A中浓硫酸的作用是_________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
_______________________________________________________________
(2)B中球形管的两个作用是__________________________、____________________.若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是___________________________(用离子方程式表示);反应结束后B中的现象是______________________________________.
14.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是____________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。
加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口进入。
蒸馏时要加入生石