高中化学常见气体的实验室制备.docx
《高中化学常见气体的实验室制备.docx》由会员分享,可在线阅读,更多相关《高中化学常见气体的实验室制备.docx(8页珍藏版)》请在冰点文库上搜索。
高中化学常见气体的实验室制备
三、常见气体的实验室制备
1、气体发生装置的类型
(1)设计原则:
根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
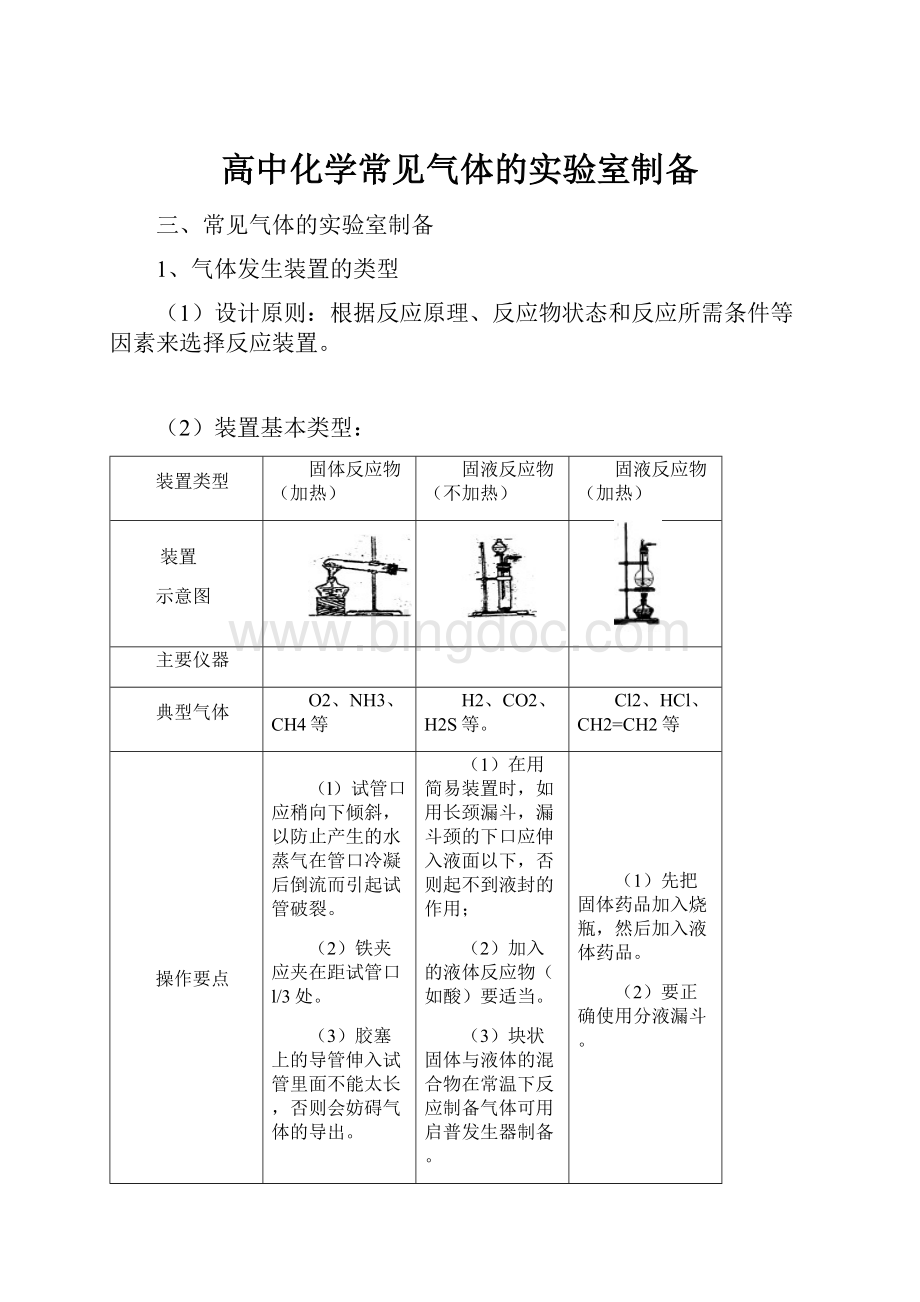
(2)装置基本类型:
装置类型
固体反应物(加热)
固液反应物(不加热)
固液反应物(加热)
装置
示意图
主要仪器
典型气体
O2、NH3、CH4等
H2、CO2、H2S等。
Cl2、HCl、CH2=CH2等
操作要点
(l)试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂。
(2)铁夹应夹在距试管口l/3处。
(3)胶塞上的导管伸入试管里面不能太长,否则会妨碍气体的导出。
(1)在用简易装置时,如用长颈漏斗,漏斗颈的下口应伸入液面以下,否则起不到液封的作用;
(2)加入的液体反应物(如酸)要适当。
(3)块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备。
(1)先把固体药品加入烧瓶,然后加入液体药品。
(2)要正确使用分液漏斗。
几种气体制备的反应原理
1、O22KClO32KCl+3O2↑
2KMnO4
K2MnO4+MnO2+O2↑
2H2O2
2H2O+O2↑
2、NH32NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
NH3·H2O
NH3↑+H2O
3、CH4CH3COONa+NaOH
Na2CO3+CH4↑
4、H2Zn+H2SO4(稀)=ZnSO4+H2↑
5、CO2CaCO3+2HCl=CaCl2+CO2↑+H2O
6、SO2Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O
7、NO2Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
8、NO3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
9、C2H2CaC2+2H2O→Ca(OH)2+CH≡CH↑
10、Cl2MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
11、C2H4C2H5OH
CH2=CH2↑+H2O
12、N2NaNO2+NH4Cl
NaCl+N2↑+2H2O
2、收集装置
(1)设计原则:
根据氧化的溶解性或密度
装置类型
排水(液)集气法
向上排空气集气法
向下排空气集气法
装置
示意图
适用范围
不溶于水(液)的气体
密度大于空气的气体
密度小于空气的气体
典型气体
H2、O2、NO、CO、CH4、
CH2=CH2、CH≡CH
Cl2、HCl、CO2、SO2、H2S
H2、NH3、CH4
(2)装置基本类型:
3、净化与干燥装置
(1)设计原则:
根据净化药品的状态及条件
(2)装置基本类型:
装置类型
液体除杂剂(不加热)
固体除杂剂(不加热)
固体除杂剂(加热)
适用范围
装置
示意图
(3)气体的净化剂的选择
选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
一般情况下:
①易溶于水的气体杂质可用水来吸收;②酸性杂质可用碱性物质吸收;③碱性杂质可用酸性物质吸收;④水分可用干燥剂来吸收;⑤能与杂质反应生成沉淀(或可溶物)的物质也可作为吸收剂。
(4)气体干燥剂的类型及选择
常用的气体干燥剂按酸碱性可分为三类:
①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。
酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。
碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。
有还原性的气体不能选用有氧化性的干燥剂。
能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成CaCl2·8NH3),不能用浓H2SO4干燥NH3、H2S、HBr、HI等。
气体净化与干燥注意事项
一般情况下,若采用溶液作除杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干燥后加热。
对于有毒、有害的气体尾气必须用适当的溶液加以吸收(或点燃),使它们变为无毒、无害、无污染的物质。
如尾气Cl2、SO2、Br2(蒸气)等可用NaOH溶液吸收;尾气H2S可用CuSO4或NaOH溶液吸收;尾气CO可用点燃法,将它转化为CO2气体。
4、气体实验装置的设计
(1)装置顺序:
制气装置→净化装置→反应或收集装置→除尾气装置
(2)安装顺序:
由下向上,由左向右
(3)操作顺序:
装配仪器→检验气密性→加入药品
典型例题
[例1]下列反应适用于实验室制氢气的是()。
①锌与稀硫酸反应②甲烷热分解③电解稀硫酸④赤热的炭与水蒸气反应
A.只有①B.①②C.①③D.①②④(1994年全国高考题)
分析与解答:
实验室里制备气体要操作简单,容易分离,经济实惠,切实可行。
甲烷在高温下才能分解成H2和C,实验室里难办到。
赤热的炭和水蒸气反应生成CO和H2,既难反应,又难分离,难以在实验里实现。
可用锌和稀硫酸反应、电解稀硫酸的方法制取氢气。
本题答案为C
[例2]今有下列气体:
H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用右图装置进行实验,填写下列空白:
①当烧瓶干燥时,从A口进气可收集的气体是___,从B口进气可收集的气体
是。
②当烧瓶中充满水时.可用来测量等气体的体积。
③当烧瓶中装入洗液,用于洗气时,气体应从口进入烧瓶。
分析与解答:
(1)本题考查学生思维的敏捷性。
用排空气法来收集气体要注意气体的密度。
由于H2、CH4、NH3的密度比空气小,不与空气发生反应,可用向下排空气的方法来收集,结合本题干燥烧瓶的位置特征,H2、CH4、NH3应从A口进气,把空气从B口赶出。
Cl2、HCl、H2S、SO2气体的密度比空气大,与空气不发生反应,应从B口进气,将空气从A口赶出。
NO能与空气中的O2反应,不能用排空气法收集。
(2)对于难溶于水的气体可用排水取气法收集;可以用来收集、测量的气体有H2、CH4、NO。
(3)当烧瓶中装有洗液时,被净化、干燥的气体应从B口进入。
[例3]
(1)在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。
应选用的仪器是(填入仪器的编号)。
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案应选用的药品是
。
(1992年上海市高考题)
分析与解答:
本题要求组装一个随开随用、随关随停的CO2发生装置。
即利用启普发生器的原理来制备CO2气体。
细心观察所给仪器,可用球形干燥管来代替启普发生器的球形漏斗,烧杯代替反应容器,应选用的仪器是a、c、d、e。
大理石与稀硫酸反应生成了微溶于水的CaSO4,阻碍了反应的进行,因而不能同时选用这两种药品。
又因为块状Na2CO3晶体溶于水,不能用启普发生器来制备CO2。
只能将浓硝酸加水稀释为稀硝酸,再与CaCO3反应制备CO2。
应选用的药品是浓硝酸、水、块状大理石。
[例4]1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
___________________________________________________________
___________________________________________________________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请
写出发生堵塞时瓶b中的现象._________________________________.
(3)容器c中NaOH溶液的作用是:
__________________________________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因.
分析与解答:
本题是是一道综合性的的实验简答题,意在考查学生的观察能力、实验能力和思维能力。
解题时依据试题信息,细心观察实验装置图,善于联系已经掌握的基础知识,进行知识的迁移,发散思维,用准确的化学语言来解答实际问题。
本题的正确答案及评分标准为:
(1)
CH2=CH2+Br2→CH2BrCH2Br(每式1分,共2分)
(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出. (2分)
(3)除去乙烯中带出的酸性气体.或答除去CO2、SO2.(2分)
(4)原因:
①乙烯发生(或通过液溴)速度过快
②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答"控温不当"亦可)
(两点各2分,共4分.答其它原因不给分也不扣分)