完整版GCP考试试题.docx
《完整版GCP考试试题.docx》由会员分享,可在线阅读,更多相关《完整版GCP考试试题.docx(12页珍藏版)》请在冰点文库上搜索。
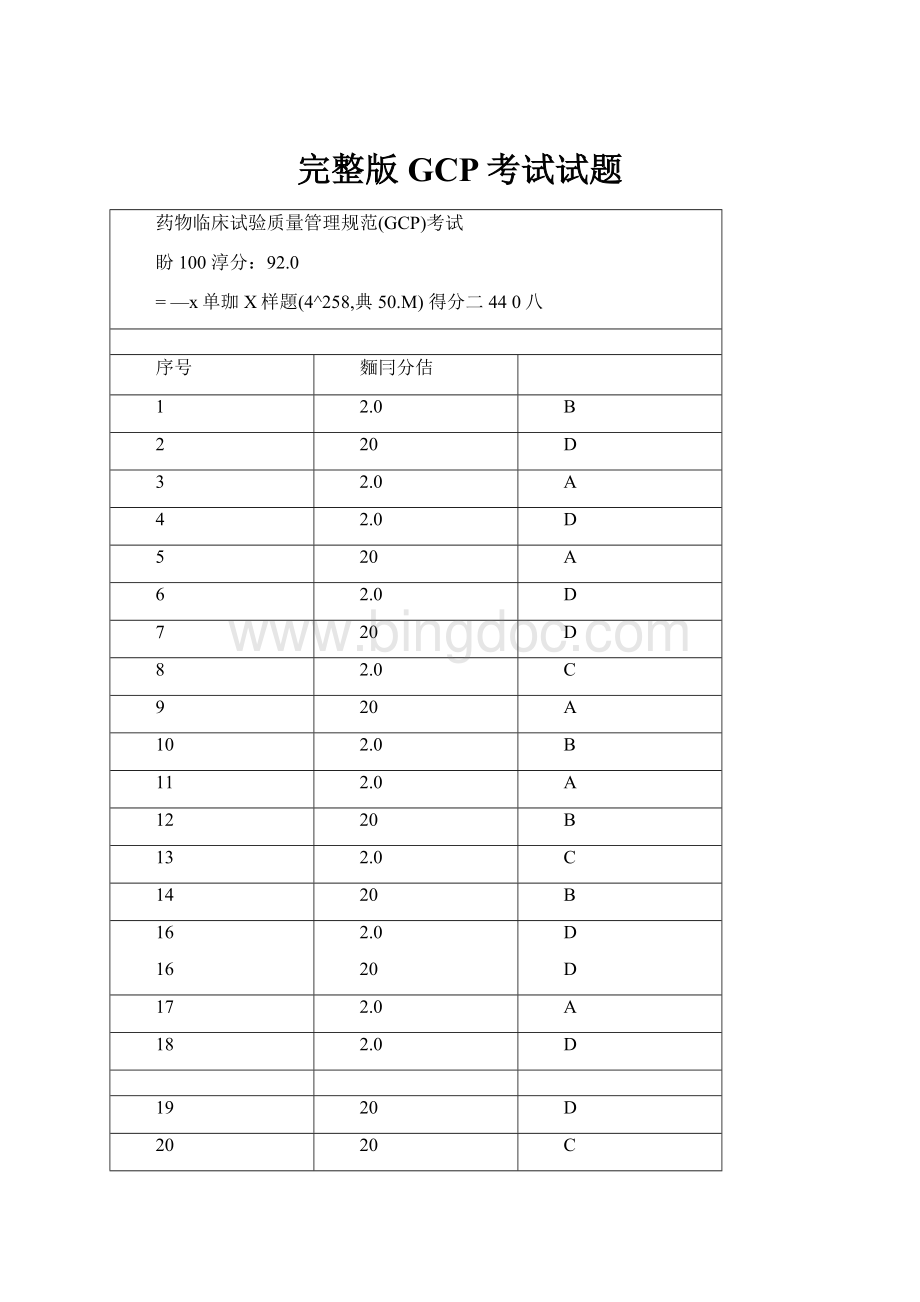
完整版GCP考试试题
药物临床试验质量管理规范(GCP)考试
盼100淳分:
92.0
=—x单珈X样題(4^258,典50.M)得分二440八
序号
麵冃分佶
1
2.0
B
2
20
D
3
2.0
A
4
2.0
D
5
20
A
6
2.0
D
7
20
D
8
2.0
C
9
20
A
10
2.0
B
11
2.0
A
12
20
B
13
2.0
C
14
20
B
16
16
2.0
20
D
D
17
2.0
A
18
2.0
D
19
20
D
20
20
C
21
20
C
22
20
A
23
20
D
24
20
A
25
20
D
1.究者孰咚方案和试诒用药
CA.曲察员
@B.軌者
Oc空研究吉
OD・I岳床功倜厉
A.雌目的
CB.
C.翩数
®D.斓雋书
3.种学术性或高业性的科学机构,申办者可委托并书面垠定其执行临床试捡中的某些工作和任务o
@A.CRO
O3-CRF
OC・SOP
OD・SAE
4.下列哪一项杲临床试洽前准备的财婪条件?
OA.龙须有充升浬曰
3.研究单位和研究者需具备一定条件
:
'C.所有烫试者均已签荃知情同意书
®D.剧具备
5.病人吱临床试洽受试者接豆一种药品百出现的不良反应事件,但不一定与治疗自因果关系・
@A.不口事件
()3.严重不良事件
OC.芙品不良反应
D.病例报最
6.经过F列哪【页枉序,临床试蝮万可实施?
A.问伦理委为会遥交申请
3.已在伦理委貝会备秦
C.试验方耘经伦理委员会□头同意
@D.趨方累已经伦理委员会隔并签发了赞曲见
7.研究者槿甫卬止一埃碼床试输,不必谀知:
A.线改雪理部门
OB.受试者
Oc.他迎頁员会
®D.专业兴
8.任药物备床试蛉的过样屮,卜列娜一」貝不杲必狽的'?
A.倨障更试者个人我益
B.保隔:
尿的科姿性
®C.廊药品楠效性
/D.保俺輕们可您住
9.实触临床试转并对益床试輪的质童和爻试者的安全和权荷的负责者.
®A.研究者
':
B.协调甘并老
OC.申力诸
OD.监査员
40.在伦埠委员会讨论会上,I、刿什么人能隽夕加役祭?
A.岔加该临床瞇的委员
@B.非商专jk的零
c.非类貝的专冢
:
D.非裘员的秘书
們益床试盼过称中左存弄ft庚治疗、圧长ft庚时沏、伤残、彩响工作能力、危及存命衣死亡、导枚无天购形手耍ft。
@A.严重不克事件
B.药品不戻反应
Oc•不艮吿件
2D.如情謔
12由申D若寿任并对审芬右负责的人R,H任务罡览查和报占试致的进行情况和核实数抿・
A.协I身吁芫者
@B.监含员
OC.研咒者
OD.申办者
13•下列MJ页杲研究者的职责?
A.任命监査员,笠査1诙•趙
B.逹丈临床輕旳庚虽控制勺庚拒保证系统
@c.负贵碍母Hd腸相X的页疗;竝
D.课迅试验赣期蚩台洛
也下列哪顶不正砒?
A.《药初临床试垃质蚩言湮坝范》圣有关右床试脸的准则
®B.《药柳6床试诒期乐彌范:
>杲有次崎床试盼的枝术标笊
:
c・《药物临床试◎育fjfe圭级范》是关于咯床试迪方垂良卜组织实施、监^棺査、记孰分祈、总结利RR
0・《药和占未试旗眸理觇茫>是咯床迄检全过程的标准规苣>
15•下列哪顶不属丁研究者的职贡?
A.他•出相关的去疗决定
OB.很告不康事尊
C.填写病例报吉表
@D.湘陆翊余励吕
佃•下列哪项不包絶在试验方莱内2
OA.雌目曲
C匕雌设计
OC.翊数
®D.程血报諭卜偿僦
仃告轴一项试输的各个方面情况石,百试者认冋并自厘參加该顶临床试验的対稈.
®A.知
CB.知情同意书
OC.血万案
(D.馭若手册
18•有关种试验用药物在进行人体研究时已有的临床与非血床数18汇编。
OA.知]情冋晨
OB.知情同意书
Oc.雌方秦
®D.研究者不朗
19•无行为從力的爻试者,其知情同吉书炫由谁签居?
OA・研究若
OB.见证人
OC.监护人
®D.CLLag之一,视翻聪
20.下列卯或不足伦理委员会审阅临床试破的姜点?
A.硏究者的姿格柏经醱
Ob.试遼方衰更日萊是否运n
®c.武齒as的统计分析方法
D.茯敦费试者知惜同黃轲式帰否话当
21•试输升始前,田外者和研究者的9R责分T协议不舟包括:
OA.试验方秦
B.试迨超
®C.蒋品牛产
OD.讹矗查
22.病例报舌表屮貝体用药剂量和时何"、虹应填坊什么符号
@A.ND
5B.NK
0C.NG
OD.NS
23•在鉴急情况下,无法取得本人艮其合法代理人的知情同竜书•如玦乏已彼证实有效的洽疗方法,而试验药物有望按救生命.恢复僅庚,减轻病需,可考虑作为受试者,但需契:
OA.伦湮委员合签晉
B.随宣者签署
CC.研究者指定人员签署
@D.在试妙凍和有艾文件中漬楚说验爻这些受试者的方法,并事尢馭得伦理委员会同意・
24•新药临床试验方案设il中,设赛对照组的意义足:
®A.的知样误差
'B.减少病毗择性误差
C.彩临極察性误差
D.排综•疾病的白然变异
25卜列哪一埃不是对伦埋委罚会的组戍娶求‘2
OA.至少有一人为医葯专业
B-至少有5人券加
OC.至少有一人应从事养医药专业
®D.至少有一人来自药I婿理却门
得分:
430
三二、尹慚題(共2殛,共50・0分》
序号
題廿分值
1
20
2
2.0
错误
3
2.0
正确
4
20
正确
5
2.0
错误
6
2.0
正确
7
20
错误
0
2.0
正确
9
20
10
2.0
1F5I
11
2.0
正确
12
2.0
止确
13
2.0
1F确
14
2.0
正确
15
2.0
正确
16
2.0
错逞
17
2.0
正确
18
20
正确
19
2.0
错误
20
2.0
21
2.0
正砸
22
20
正砸
23
20
错误
24
2.0
25
2.0
正确
1•社病例报吉表上ft■任何更正时,不得改变原始记录,只龍采用悄加叔述舁说明理由,并由研究者签〒幷注明日期・
O正确
®龌
2•临床试验所在的医疗机构除夷验室资料外的所有资料和文ft均应准备接爻勢政管理部门的视察•
O正确
©歸
3•受试者在进入農床试蛉之前,必须签署知情同意书・
®正确
O崔误
4.双盲对照爲龄坎伍发药甫严格核対随UI分组编号
®正确
O链涙
6.孟鱼页应仕毋次巧祝眄,刘确】人曲自炳创TR百滾瑕与淸雀、沆竪,WH、盜r隔站关料孩刈・
O正確
@那
6.您床時數扳言理的各种步琛均应记录在亲,以便对数抿质奉及试的实施作拎杳・
©止硝
AM*«-»
<_)Wl汽
7.益岸幽用药物的使用由研究者负贵,剩余的药物由晴究者销毀,上述过程霁由专人负盍并记录存宰"
O正硯
®密溟
8.《药物临床试捡庾童管理效気》是有关临床试馥全过程的标繼規主,包括为案设计、组织、实施、监色、稽查、记录、分析、总给和抿告的方法・
®正确
O鮮
9.唱床试蝮给束后,剔除病侧不纳入绕计分忻。
O正碓
®寮
佃•如果对伦理宙吉有不同的音见,可以向他理委员会抿交“复亩”进行沟通。
®iFtfl
O解
41.任寻求整勺研究项目的知惜冋意时,如果潜在受试者与医生有依除关畚,或可能会被迫表示同意,医生应特别谨慎。
在这些情况T,必独由一个适当的有宙格目完令匏立干汶种关糸之外的人来寻求知惜同益・
®d:
a
42.FAS指劲析集
®正确
0麝
但临床试吻方军中婪写明统H学处理方法,以斥任何变动须衣筋床试峻总结报告中述明并说明由e
®正硝
0瞬
14.伦理委员会的工作空中国育关法律范想的约束。
®正确
佃机新药临床试峻或人体生物学研究实施前绚雲经药政管遅机构批准・
®正确
O错误
16.-13人只翌经过迂为刊際RUd】监台监床试转.
正碑
©解
仃.临床试蛉开始前,研究人员应分工明确并获斜主要研究者的榜权
®正确
(■错详
彳8•单盲惫免不了研突者方面常来的主观倡伶,易造戍试蝮组和对照组的处埋不均翁
@iF确
O错误
19.1类错误是拾错误的拒绝无效假设
O正确
@蜜
20.临床试转方案应句桔监杳员的蚪名和地址。
O正确
®触
24•监查员在每次访视册究者后,需冋刑办者以书面形式損告访观甘况・
@正确
O错误
22•试卷有天情况和知情同意吊内容須先经伦理委员会批准・
@止礪
匚错逞
23•务中心临床试薪存各中心根霰各白具体话况箕理药品,何朽外序和術8。
()正确
®瞬
24.猛床试脸中随VI分配受试者只恚严格按试蝮万柔的设计步跡行,不必另外记录・
()正确
©庶
25•生物制吕、血液制帛的励检报吉由中检所提供
@IF爾
错滨