学案无机综合题特训.docx
《学案无机综合题特训.docx》由会员分享,可在线阅读,更多相关《学案无机综合题特训.docx(16页珍藏版)》请在冰点文库上搜索。
学案无机综合题特训
无机综合题集合
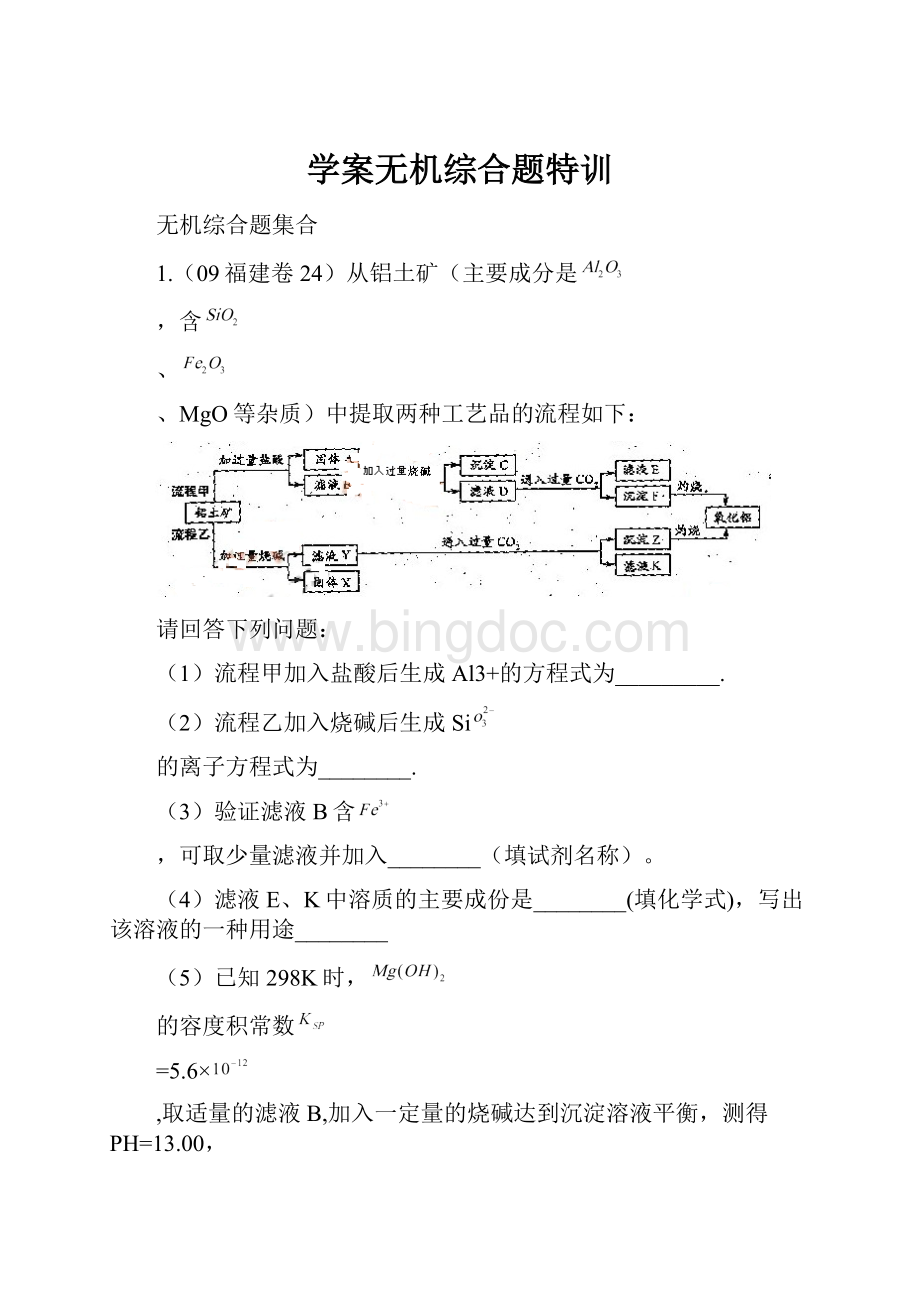
1.(09福建卷24)从铝土矿(主要成分是
,含
、
、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)流程乙加入烧碱后生成Si
的离子方程式为________.
(3)验证滤液B含
,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(5)已知298K时,
的容度积常数
=5.6×
取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,
则此温度下残留在溶液中的
=______________.
2.(’08宁夏理综26)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。
有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白:
(1)图中标号处需加入的相应物质分别是
①、②、③、④、⑤。
(2)写出①处发生反应的离子方程式;
写出③处发生反应的化学方程式。
(3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:
铁红;氧化铜。
3.(’08北京理综28)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。
取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。
当消耗2molI-时,共转移3mol电子,
该反应的离子方程式是_________________________________________________。
(5)另取原样品,加入足量稀硫酸充分反应。
若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)。
4.(’08江苏16)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式:
、
。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
。
(4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。
但
早期人们却错误地认为它的结构为:
。
核磁共振法能够区分这两
种结构。
在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
5.(’07四川理综12)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第周期第族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应
的是(填写序号)。
(4)反应④的离子方程式是:
。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净化剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。
该反应的化学方程式是:
。
6.(’06四川理综27)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。
B、E均为组成空气的成分。
F的焰色反应呈黄色。
在G中,非金属元素与金属元素的原子个数比为1∶2。
在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):
请填写下列空白:
(1)A是,C是。
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液反应生成I和D的离子方程式是。
7.(’06天津理综26)中学化学中几种常见物质的转化关系如下:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。
请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:
。
(2)A、B、H的化学式:
A、B、H。
(3)①H2O2分子的电子式:
。
②写出C的酸性溶液与双氧水反应的离子方程式:
。
(4)写出鉴定E中阳离子的实验方法和现象:
___________________________________________________________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
。
8..(’06江苏20)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
(b)反应①、②是化工生产中的重要反应。
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式。
(2)C的结构式;H的化学式。
(3)L的溶液与化合物E反应的离子方程式。
(4)化合物J的化学式。
9.(安徽省安庆一中2010届高三三模))A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是;写出工业上制备B的化学反应方程式。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是,C所含共价键的类型和数目比为;反应③的化学方程式是。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都生成有颜色气体,B的结构式是,反应③的化学方程式是。
10.(2010年湖南省重点示范高中高三冲刺模拟试题)(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的
离子方程式是。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式
表示)。
③某高效净水剂是由Y(OH)SO4聚合得到的。
工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,
该反应的化学方程式是。
11.(福建省莆田四中2010届高三三模)物质A、B、C有如下转化关系:
请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,请写出C的名称 。
(3)若A是一种黄绿色气体,M是一种常见金属。
写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式:
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-akJ·mol-1;
A转化为C的热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-bkJ·mol-1;
请写出A与C反应转化为B的热化学方程式。
(5)若C+A→B的转化关系为4NH3+6NO
6H2O+5N2。
在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。
该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
12.(江苏省口岸中学09届秋学期高三年级第二次月考)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
回答下列问题:
⑴钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。
副产品甲是。
⑵上述生产流程中加入Fe屑的目的是,检验副产品甲是否变质的实验方法是。
⑶上述生产流程中所得到的金属钛中混有少量杂质,可加入溶解后除去。
⑷最近,用熔融法直接电解中间产品乙制取金属钛获得成功。
写出电解乙制取金属钛的化学方程式。
13.(08山东德州模拟)下图所涉及的物质均为中学化学中的常见物质,其中C、D为气体,E为一种金属单质,其余为化合物,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:
F;H
(2)指出MnO2在相关反应中的作用:
反应①中是剂,反应②是剂。
(3)若反应①是加热条件下进行,则A是;若反应①是在常温条件下进行,则A是。
(4)写出反应②的化学反应方程式
14.(2007年广州市普通高中毕业班综合测试)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
已知:
①在潮湿空气中CaO2能够分解:
CaO2+2H2O==Ca(OH)2+H2O2,
2CaO2+2CO2==2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:
CaO2+2H+==Ca2++H2O2
在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。
CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
根据以上信息,回答下列问题:
(1)用上述方法制取过氧化钙的化学方程式是;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是;
(3)该制法的副产品为(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是。
A、盐酸B、氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为cmol/L的Na2SO3溶液至反应完全,消耗Na2S2O3溶液VmL。
(已知:
I2+2S2O32—==2I—+S4O62—(无色))
①第三步中说明反应恰好完全的现象是;
②CaO2的质量分数为(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”、“偏低”或“偏高”),原因是。
15.(2007年广州市普通高中毕业班综合测试)亚硝酸钙[Ca(NO2)2]为白色固体,易溶于水,常用作混凝土的缓蚀剂,具有防锈、防冻、速凝等作用。
工业上常用石灰乳吸收NOX气体的连续吸收法生产硝酸钙,工艺流程如下图:
(1)一次氧化可得到NO和NO2的混合气体,相关的化学方程式是:
。
氨的氧化反应在化学工业上还有多种实际用途,其中的一个用途是:
。
(2)经一次吸收后,可得到Ca(NO2)2,化学方程式为。
该反应中得到电子的物质是。
(3)采用二次吸收的目的是。
(4)二次吸收后的尾气若直接向大气中排放,造成的后果是。
(5)过滤后,要得到固体产品,在实验室可进行的操作是。
参考答案
1.
(1)Al2O3+6H+
2Al3++3H2O
(2)SiO2+2OH-
SiO32-+H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:
)
(4)NaHCO3;制纯碱或做发酵粉等合理答案:
(5)5.6×10-10mol/L
2.
(1)①铁屑②稀硫酸③稀硝酸④氢氧化钠⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑2Fe3++Fe=3Fe2+Cu2++Fe=Cu+Fe2+2Au3++3Fe=2Au+3Fe2+3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3用作红色涂料用作制造铜盐的原料
3.
(1)Al;
(2)①C+2H2SO4(浓)CO2↑+2SO2↑+2H2O②NO、CO2
(3)Cu2+、Fe3+、H+(4)2Fe2++3H2O2+4I-2Fe(OH)3↓+2I2
(5)CuO、C或CuO、C、Fe2O3
4.
(1)Cu+H2O2+H2SO4CuSO4+2H2O
(2)4Fe2++O2+4H+4Fe3++2H2O
2Fe3++2I-2Fe2++I2(3)10KOH+3Cl2+2Fe(OH)32K2FeO4+6KCl+8H2O
(4)13
5.
(1)四(或4)Ⅷ
(2)1∶2(3)③
(4)3Fe2++NO
+4H+3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
6.
(1)A:
碳(或C)C:
钠(或Na)
(2)Na2CO3+2HCl2NaCl+H2O+CO2↑
(3)2CO2+2Na2O22Na2CO3+O2
(4)Na2O2+S2-+2H2O4OH-+S↓+2Na+
7.
(1)1nm~100nm
(2)FeFeSH2SO4(稀)
(3)
(4)取少量E于试管中,用胶头滴管滴入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。
(或其他合理答案)(5)4Fe2++4Na2O2+6H2O4Fe(OH)3↓+O2↑+8Na+
8.
(1)2NH3+H2SO4(NH4)2SO4
(2)N≡N(NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-Cl-+SO
+H2O(4)N2H4
9.
(1)SiO2+2C
Si+2CO↑(2分)
(2)2Fe2++Cl2=2Fe3++2Cl-(2分)
H2+Cl2
2HCl(2分)
(3)︰N
N︰(2分),6:
∏=1:
2(2分),
4NH3+5O2
4NO+6H2O(2分)
(4)O=C=O(2分)Mg+4HNO3
Mg(NO3)2+2NO2↑+2H2O(2分)
10.
(1)(3分)Fe2O3+2Al
Al2O3+2Fe
(2)(3分)2Al+2H2O+2OH-
2AlO2-+3H2↑
(3)①(3分)取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+。
②(3分)Al3++3H2O
Al(OH)3+3H+
③(3分)2FeSO4+2NaNO2+H2SO4
2Fe(OH)SO4+Na2SO4+2NO↑
11.
(1)NaOH溶液或盐酸(其他合理答案)(2分)
(2)碳酸氢钠(3分)
(3)2Fe2++Cl2=2Fe3++2Cl-(3分)
(4)2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-(3a-b)/2kJ·mol-1(3分)
(5)放热减小(各2分)
12.⑴FeSO4·7H2O⑵防止Fe2+氧化取副产品甲少许溶于水,滴加适量KSCN溶液,
观察溶液是否变为血红色⑶稀盐酸⑷TiO2Ti+O2↑
△
13.
(1)F;Fe3O4;H:
FeCl3
(2)催化剂;氧化剂
(3)KClO3;H2O2(4)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
14.
(1)CaCl2+H2O2+2NH3+8H2O==CaO2·8H2O↓+2NH4Cl
(2)冰水浴冷却(或将反应容器浸泡在冰水中)(3)NH4ClA(4)稀硝酸酸化的硝酸银溶液(5)①溶液由蓝色变为无色②
③偏高在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高。
15.
(1)4NH3+5O2==4NO+6H2O,2NO+O2==2NO2工业制硝酸。
(2)Ca(OH)2+NO+NO2==Ca(NO2)2+H2ONO2
(3)提高Ca(NO2)2的产率
(4)尾气中含有氮氧化物在大气中可形成光化学烟雾和酸雨,污染环境。
(5)蒸发浓缩,冷却结晶