广东省中考化学复习资料工业流程专题训练含答案.docx
《广东省中考化学复习资料工业流程专题训练含答案.docx》由会员分享,可在线阅读,更多相关《广东省中考化学复习资料工业流程专题训练含答案.docx(20页珍藏版)》请在冰点文库上搜索。
广东省中考化学复习资料工业流程专题训练含答案
工业流程专题训练
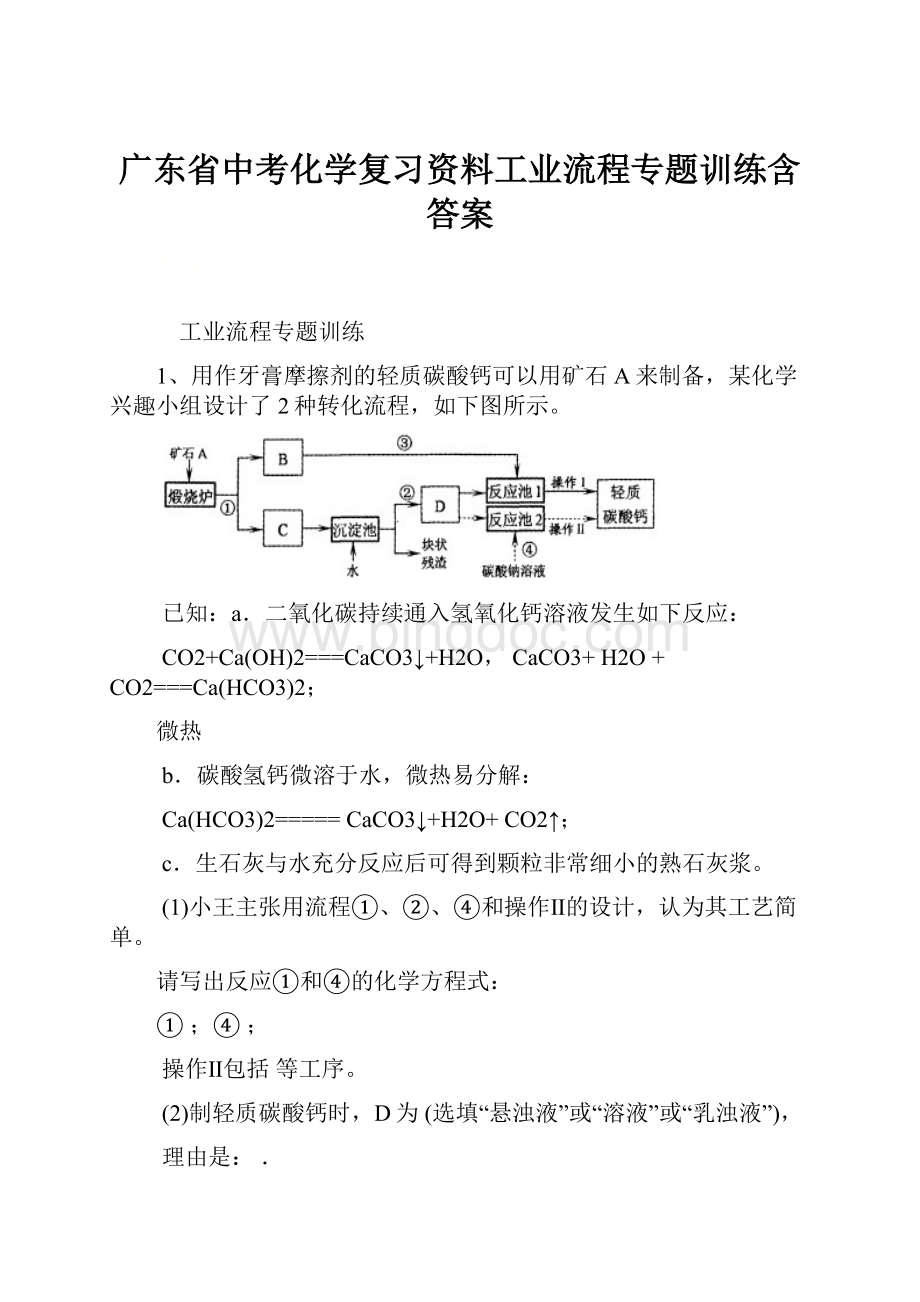
1、用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。
已知:
a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+H2O+CO2===Ca(HCO3)2;
微热
b.碳酸氢钙微溶于水,微热易分解:
Ca(HCO3)2=====CaCO3↓+H2O+CO2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。
请写出反应①和④的化学方程式:
①;④;
操作Ⅱ包括等工序。
(2)制轻质碳酸钙时,D为(选填“悬浊液”或“溶液”或“乳浊液”),
理由是:
.
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:
_______________
;操作I包括搅拌和微热等工序。
2、下面是某化工厂生产烧碱的工业流程图。
请根据以上信息回答下列问题:
(1)请写出X物质在实验室中的一种用途。
(2)反应池中发生反应的化学方程式为。
(3)操作①的名称是,结晶得到的固体烧碱中可能含有少量的(写化学式)。
(4)滤液D可加入反应池循环再利用,目的是。
3、某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
一、K2SO4的制备
(1)将CaCO3研成粉末的目的是。
(2)上述流程中可循环使用的物质有CO2和(填写化学式)。
(3)反应Ⅲ中相关物质的溶解度如下表。
你认为反应Ⅲ在常温下能实现的原因
是。
物质
KCl
K2SO4
NH4Cl
M
溶解度/g(25℃)
34.0
11.1
37.2
19.5
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入(选填序号,下同),振荡、静置,再向上层清液中滴加,观察现象即可判断。
a.AgNO3溶液b.过量的BaCl2溶液c.过量的Ba(NO3)2溶液
二、研究CaSO4•2H2O加热分解的产物。
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:
y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
电热丝
控温电加热器
ABCDE
①实验前首先要,再装入样品。
装置A的作用是。
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1gb.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3gd.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:
y的值,若无装置E,则实验测定结果将(填“偏大”、“偏小”或“无影响”)。
还可选用上述的(选填序号)两个数据组合也可求出x:
y的值。
4.下图是某工厂生产烧碱的主要流程。
(1)X的化学式为 。
(2)该厂生产过程中煅烧了含碳酸钙75%的石灰石12t,理论上可制得氧化钙 t。
(3)足量的A与纯碱在反应池中反应的化学方程式为 。
(4)结晶得到的固体烧碱,经测定含有氢氧化钠的质量分数为99.2%,还含的少量的杂质,杂质是 ,原因是 。
(5)滤液2中的溶质的化学式为 ,为了降低生产成本和防止对环境造成污染,你的建议是 。
5、制盐工业:
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是。
(2)第②步操作的目的是除去粗盐中的(填化学式,下同),第⑥步操作的目的是除去滤液中。
(3)第⑤步“过滤”操作中得到沉淀的成分有:
泥沙、BaSO4、Mg(OH)2、(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
。
(5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由是_____________________________________________________________________;
(6)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是___________。
6、煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
请回答下列问题:
(1)下列说法正确的是 。
A.煤是复杂的混合物,主要含碳元素B.由煤加工成焦炭发生的是物理变化
C.家用“液化石油气”就是煤隔绝空气加热得到的产品
D.煤燃烧排放的二氧化硫、二氧化氮是形成酸雨的主要物质
(2)煤的加工产品有很多用途,其中焦炭广泛应用于炼铁。
右图是高炉炼铁的示意图。
请根据图例回答:
①焦炭在炼铁过程中的主要作用是 ;
②请用化学方程式表示炼铁的原理 ;
③高炉炼铁会产生大量的高炉气体,其主要成分是高浓度的CO和氧化铁尘粒。
请你对高工业炉气体的处理提出合理化的建议 。
(3)化肥厂生产合成氨的原料是煤、空气、水。
生产简要流程如下:
点燃
高温
煤气发生炉中主要反应:
①C+O2=CO2;②C+H2O=CO+H2。
两个反应必须进行调控才能保持一定的炉温。
判断:
反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3,试写出该反应的化学方程式 。
7.能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。
通常天然气中含有H2S等有毒气体,下图为天然气合成氨的工艺流程。
(1)甲烷----氧气燃料电池是将______能转化为______能的装置。
CH4在空气中燃烧时,将干冷的小烧杯罩在火焰上方,可观察到烧杯内壁有______。
(2)CH4可合成多种无机物和有机物。
研究CH4和CO2反应生成CO和H2,重大意义在于______;我国科研人员首先发现CH4可直接分解获得C6H6和H2,化学方程式为__________。
(3)①中CH4与H2O(气)反应生成CO2、H2,化学方程式是______。
②中一般加人K2CO3溶液吸收CO2,此反应表示为K2CO3+CO2+H2O=2_________,N2与H2按照分子数1:
____反应生成NH3。
(4)使用Fe2O3·H2O除去H2S,生成物中含硫元素的物质有______种。
流程中参与循环的物质是_______(填化学式)。
8、有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。
某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。
方案流程如下:
回答下列问题:
(1)步骤②中:
需加入的物质是,分离所得混合物的方法是。
(2)步骤③中:
需加入的物质是,发生反应的化学方程式是。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?
,理由是.
(4)步骤④的操作是,溶液2和溶液3为什么要混合?
.
9、坐落于常熟的江苏常福电缆厂是一家以生产电缆类产品为主的企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:
零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.
甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:
在通入空气并加热的务件下,铜可与稀硫酸在溶液中发生反应(方程式为:
2Cu+2H2SO4+O2
2CuSO4+2H2O),于是他提出了另一套方案:
(1)甲方案的②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
②;③.
(2)从环保角度对两套方案的不同部分进行比较,你认为(选填“甲”或“乙”)的方案更合理.理由是:
.
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是:
.
丁又提出了疑问:
“如果铁过量,剩余的铁会混在红色粉末中,该用什么化学方法处理?
”.请提出你的想法:
.
4)最后,老师肯定了同学们的积极思考,但同时指出:
方案最后一步所得浅绿色滤液提纯结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使“绿矾”结晶的方法:
(“绿矾”溶解度随温度升高而明显增大).
10.冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。
请回答:
(1)除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于
(填写序号字母)。
A.合成材料B.合金C.金属材料D.化合物
(2)氯化钙是常用的融雪剂。
工业上以碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:
①滤渣的主要成分是(填化学式);
②加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式。
(3)已知盐酸盐(金属氯化物)跟AgNO3溶液反应生成白色沉淀。
某公司生产的融雪剂由NaCl、NaNO3、MgCl2、CuSO4中的两种物质组成。
小明为探究其成分,设计并完成下列实验:
请你推断:
融雪剂中一定不含的物质是(填写名称),融雪剂中一定含有的物质是(填化学式)。
11.每年的3月22日是“世界水日”,水与人类生活和生产的关系十分密切,请回答下列问题。
(1)①水能溶解很多种物质,是配制溶液时最常用的。
②保持水的化学性质的最小粒子是。
(2)2018年上海世博会的园区内有许多饮水处,可取水直接饮用。
所供的饮用水处理步骤如下图所示:
步骤①对应的作用是
(填字母,下同),步骤③对应的作用是。
A.杀菌消毒B.吸附杂质
(3)降雨是自然界中水循环的一个环节。
酸雨是由气体或这些气体在空气中反应后的生成物溶于雨水所形成。
A、B、C三个地区雨水的pH如右图所示,其中地区的雨水是酸雨。
(4)电解水时,加入少量NaOH可以增强水的导电性。
现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是,当溶液中NaOH的质量分数变为0.2%时,有水被分解.
12.人类的生活和工农业生产都离不开水。
下图是自来水厂净水过程示意图。
加絮凝剂
投药消毒
过滤池
取水口
清水池
活性炭吸附池
反应沉
淀池
用户
配水泵
请根据图示回答下列问题:
⑴自来水厂生产自来水时,使用的净水方法有___________________(多选)
A.沉淀B.过滤C.煮沸D.蒸馏E.吸附
⑵取水后加入絮凝剂(明矾)的作用是________________________________________;
⑶自来水厂常用二氧化氯进行投药消毒,二氧化氯的化学式为________;漂白粉(有效成分为次氯酸钙)也可用为饮水消毒剂,次氯酸钙[Ca(ClO)2]中氯元素的化合价为______。
13.酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。
某兴趣小组学收集某地的雨水进行实验。
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h
0
1
2
3
4
雨水样品的pH
4.73
4.62
4.56
4.55
4.55
②SO2能使品红溶液褪色;
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸。
【分析讨论】①正常雨水的pH范围是:
7>pH>5.6,偏酸性,这是因为。
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于。
③SO2可用氢氧化钠溶液吸收,试写出该反应的化学方程式。
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:
酸雨中溶质只含有H2SO3;猜想Ⅱ:
酸雨中溶质只含有H2SO4;
猜想Ⅲ:
酸雨中溶质。
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤。
①在滤液中滴加溶液,溶液呈色。
证明在酸雨样品中滴加的Ba(OH)2溶液已过量。
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体。
该反应的化学方程式为,根此现象有关酸雨中溶质的猜想正确。
14.碱式氯化铝是某种高效净水剂的主要成分。
实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程如下:
(1)溶解过程中,需要使用质量分数为15%的盐酸,则配制这种盐酸需要______mL,30%的浓盐酸(密度约为1.15g/cm3)和115g蒸馏水。
(2)盐酸溶解铝土矿过程中,发生反应的化学方程式为_______、________________。
(3)加少量铝粉的主要作用是:
除去浊液中的______。
(4)加CaCO3粉末的作用是调节pH至5。
请写出用pH试纸测定溶液pH的操作:
在白瓷板或玻璃片上放一小片pH试纸,____________________________________,得出被测液的pH。
15.海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钾等。
综合利用海水制备金属镁的流程如下图所示:
(1)贝壳主要成分的化学式是。
(2)操作a的名称是,在实验室中进行此项操作,需要的玻璃仪器有烧杯、玻璃棒、。
(3)工业冶炼镁常用电解MgCl2的方法,反应为:
MgCl2电解Mg+。
(4)写出第②、③两步反应的化学方程式:
②,③。
16.我国化学家侯德榜发明了联合制碱法,其生产纯碱和副产品氯化铵的工艺流程如下图所示:
(1)NH3溶于水得到氨水,将无色酚酞溶液滴人氨水中,溶液显色。
(2)写出反应l的化学方程式;该反应的基本类型为。
(3)操作a的过程是蒸发浓缩、、过滤。
(4)上述工艺流程中可循环利用的物质是。
17.粗盐中含泥沙、氯化钙、氯化镁等杂质,某同学自制的简易
净水器中放置物质的顺序错误,使净水效果不理想。
(1)请按由上到下的顺序重新排列________(填字母)。
调整
后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
(2)步骤①②都需要进行__________操作,步骤④需要进行操作。
(3)已知试剂X是碱溶液,则沉淀I为_______(写化学式),下列碱溶液不符合要求的是______(填序号)。
A.氢氧化钠溶液B.氢氧化钡溶液C.氢氧化钾溶液D.氢氧化钙溶液
(4)步骤②除去氯化钙的反应方程式是_______;步骤③中发生中和反应的化学方程式是。
18.合成氨是人类科学技术上的一项重大突破,对社会发展与进步做出了巨大贡献。
合成氨的工艺流程图如下:
高温
高温
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为__________。
(2)制取氢气的反应过程为:
C+H2O=====CO+H2,CO+H2O=====CO2+H2。
上述两个化学方程式中表现氧化性的物质是__________(填化学式)。
(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化。
净化的过程是。
(4)写出N2、H2反应生成NH3的化学方程式:
。
(5)将沸点不同的气体分离开来,常采用液化分离法。
如控制温度在-183℃时,可将空气中N2与O2分离。
根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在______℃。
物质
H2
N2
O2
NH3
沸点/℃
-252
-195.8
-183
-33.35
19、二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一。
实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。
(1)分离室中进行的操作是____________。
(2)该流程图所标出的物质中,溶于水放出大量热的氧化物是__________。
(3)“捕捉室”内发生反应的化学方程式为_____________________________。
(4)将CaO加入到x溶液中,其中发生复分解反应的化学方程式是_______________________________。
20.高纯度的CuO可用作颜料、有机合成催化剂等。
以下是用粗铜粉氧化法生产高纯度CuO的流程图(说明:
所加试剂均过量)。
回答下列问题:
(1)1:
1的H2SO4是用1体积98%的H2SO4与1体积水混合而成。
配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要_______________、_________________。
(2)写出用硫酸溶解黑色固体的化学方程式:
__________________________。
(3)在洗涤操作中,用______________(写试剂的化学式)洗涤滤渣B。
(4)若不考虑在生产过程中的损耗,要计算粗铜粉中Cu的含量,需要测定的数据是:
最终所得氧化铜的质量和________________________(用文字表示)。
1、
(1) ①CaCO3 CaO+CO2 ↑;④Ca(OH) 2 +Na2CO3 ====CaCO 3↓+2NaOH ;
搅拌过滤
(2)悬浊液;澄清石灰水中氢氧化钙浓度太小,生产效率很低。
(3)利用产生的二氧化碳比另加碳酸钠溶液更经济,生产成本更低。
若产生的二氧化碳不回收直接排放,不利于“节能减排”。
2、
(1)洗涤仪器(或做溶剂或反应物或溶解物质等合理答案)
(2)、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (3).过滤 (4).Ca(OH)2 (4). 环境污染
3、1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).
(2)CaCO3
(3)常温下K2SO4的溶解度小.
(4)减少K2SO4的溶解.c a
(5)CaCO3+2HCl=CaCl2+CO2↑+H2O
(6)①检查装置的气密性. 除去空气中的CO2和H2O(意思相近均给分).
②偏小 b、c
4、
(1)H2O
(2)5.04t
(3)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(4)Na2CO3 反应物中有物质过量,(NaOH溶液在过滤、蒸发、结晶过程中吸收了空气中的CO2气体)
(5)Ca(OH)2 将滤液Ca(OH)2重新注入到反应池中循环利用
5、
(1)加快粗盐溶解
(2)Na2SO4;过量的Na2CO3.(3)、CaCO3(4)会引进新的杂质KCl(5)不能会使产物中混有氯化钡(6)除去多余的氢氧化钠和碳酸钠
6、
(1)AD
(2)①制取CO、提供热量②Fe2O3 +3CO
2Fe +3CO2
③回收利用
(3)吸收 CO2 +NH3 +H2O = NH4HCO3
7、
(1)化学;电;小水珠(或水雾)
(2)转化CO2或控制温室效应(从生成物角度得到CO和H2有更广泛的应用等)
6CH4==C6H6+9H2
(3)CH4+2H2O==CO2+4H2;KHCO3;3
(4)2;Fe2O3·H2O
8、
(1)Fe;过滤
(2)稀硫酸;Fe+H2SO4=FeSO4+H2↑
(3)不合理;因为要使Ag+完全置换出来,必须加入过量的铁.
(4)蒸发结晶;两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用
9、
(1)②CuO+H2SO4==CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu
(2)甲方案第一步灼烧会产生污染空气的气体,粉尘,烟雾.
(3)确保CuSO4用完或将铜完全置换.将所得的铜粉酸洗后再洗涤,干燥或过滤前先加适量的酸除去剩余的铁粉
(4)降温结晶.
10、
(1)BC;
(2)①Mg(OH)2、Fe(OH)3;②Ca(OH)2+2HCl═CaCl2+2H2O;(3)硫酸铜,MgCl2.
11、
(1)溶剂 水分子
(2)B A (3)SO2 (NO2) BC(4)氧气(O2) 50.0
12、⑴A、B、E ⑵吸附杂质,使杂质沉降 ⑶ClO2、+1
13、【分析讨论】①空气中的二氧化碳溶于水呈酸性
②置换反应 ③SO2 +2NaOH==Na2SO3+H2O
【提出猜想】既有H2SO3又有H2SO4
【实验探究】
(1)①酚酞 红(或石蕊 蓝)(其他合理试剂和现象均酌情给分)
②BaSO3+2HCl=BaCl2+SO2↑+H2O 猜想III
14、
(1)100
(2)Al2O3+6HCl==2AlCl3+3H2O;Fe2O3+6HCl==2FeCl3+3H2O
(3)铁离子(Fe3+)(氯化铁)
(4)用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
15、
(1)CaCO3
(2)过滤;漏斗
(3)Cl2
(4)②CaO+H2O===Ca(OH)2
③Mg(OH)2+2HCl===MgCl2+2H2O
16、
(1)红;
(2)2NaHCO3 △Na2CO3+H2O+CO2↑,分解反应;(3)降温结晶;(4)CO2.
17、
(1)BADC.
(2)过滤;蒸发.
(3)Mg(OH)2. C.
(4)CaCl2+Na2CO3═CaCO3↓+2NaCl;NaOH+HCl═NaCl+H2O.
18、
(1)78%
(2)H2O
(3)先把原料气通过NaOH溶液(或石灰水等碱液),再通过浓硫酸(或碱石灰等干燥剂)
高温、高压
(4)N2+3H2==2NH3(5)-33.35
19、
(1)过滤
(2)CaO(或氧化钙)
(3)CO2+2NaOH=Na2CO3+H2O
(4)Na2CO3 +Ca(OH)2 =CaCO3↓+2NaOH
20、
(1)烧杯;量筒;
(2)CuO+H2SO4==CuSO4+H2O;
(3)H2SO4;
(4)粗铜的质量