原电池 化学电源Word格式文档下载.docx
《原电池 化学电源Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《原电池 化学电源Word格式文档下载.docx(10页珍藏版)》请在冰点文库上搜索。
铁棒+铜棒或铂棒+稀H2SO4,2种;
铁棒+铜棒或铂棒+Fe2(SO4)3溶液,2种;
铜棒+铂棒+Fe2(SO4)3溶液,1种。
综上共5种。
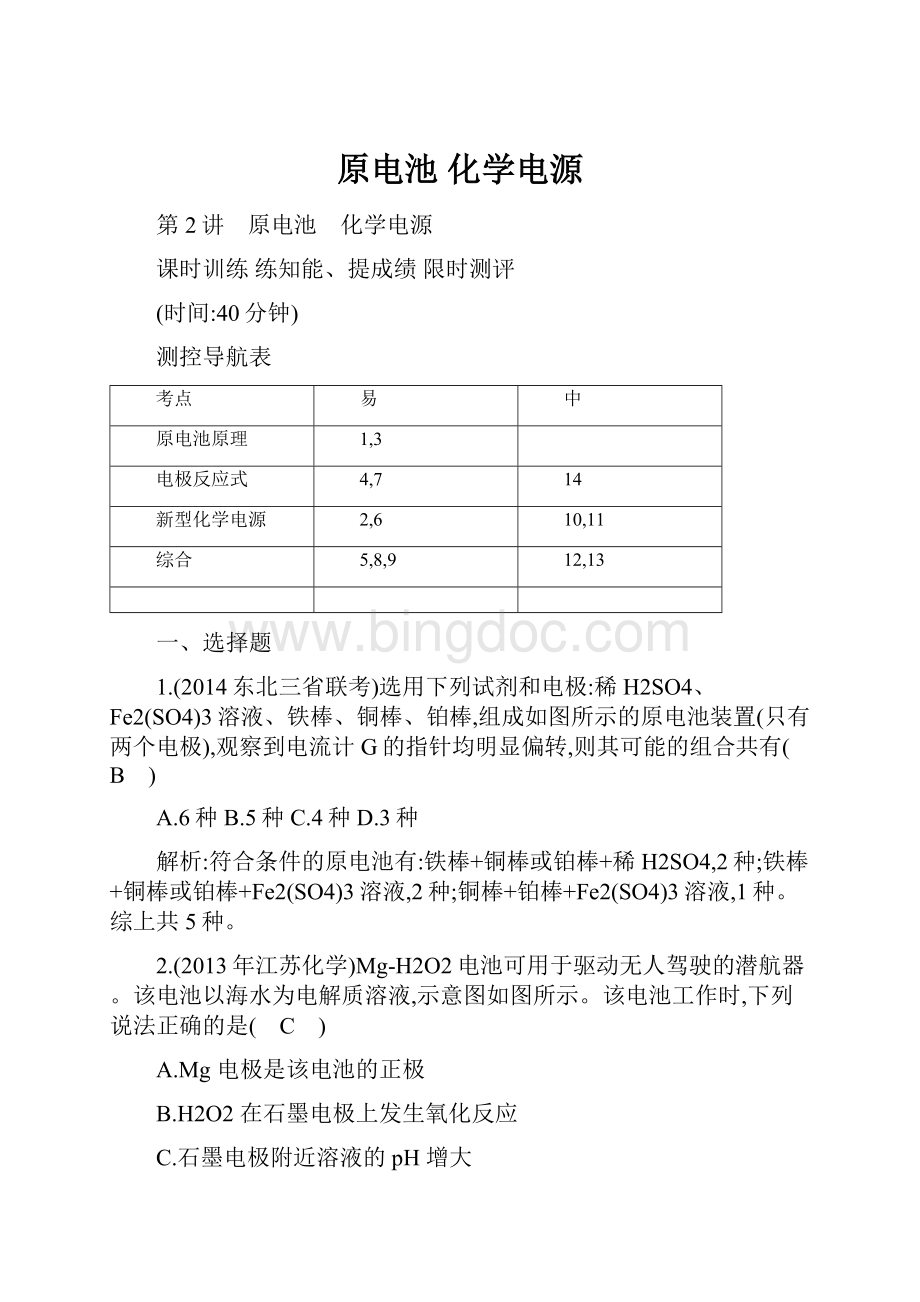
2.(2013年江苏化学)Mg-H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如图所示。
该电池工作时,下列说法正确的是( C )
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
该电池总反应为Mg+H2O2
Mg(OH)2;
负极反应为Mg-2e-
Mg2+,即Mg作负极,A项错误;
正极反应为H2O2+2e-
2OH-,H2O2发生还原反应生成OH-,故B项错误、C项正确;
原电池中阴离子Cl-移向负极,D项错误。
3.有关电化学知识的描述正确的是( A )
A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
B.某原电池反应为Cu+2AgNO3
Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极、铜作正极
D.CaO+H2O
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
原电池利用的是自发进行的氧化还原反应,A正确;
由于有Ag+,盐桥内不能有Cl-,B错误;
Fe、Cu、浓硝酸组成原电池,由于铁遇浓硝酸会钝化,则Cu为负极,Fe为正极,C错误;
CaO+H2O
Ca(OH)2不是氧化还原反应,不能设计成原电池,D错误。
4.(2014合肥高三质检)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;
电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。
下列对该燃料电池说法正确的是( D )
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应为O2+2H2O+4e-
4OH-
C.通入丁烷的一极是负极,电极反应为C4H10+26e-+13O2-
4CO2+5H2O
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体
L
原电池中阴离子移向负极,A项错误;
正极反应为O2+4e-
2O2-,B项错误;
负极反应为C4H10-26e-+13O2-
4CO2+5H2O,C项错误;
根据得失电子数相等,标准状况下生成CO2:
×
4mol×
22.4L/mol=
L,D项正确。
5.(2013北京海淀区高三期末)下列四个常用电化学装置的叙述中,正确的是( D )
图Ⅰ:
碱性锌锰电池
图Ⅱ:
铅蓄电池
图Ⅲ:
电解精炼铜
图Ⅳ:
纽扣式银锌电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
图Ⅰ所示碱性锌锰电池中MnO2是电池的正极,A错误;
图Ⅱ所示电池放电过程中:
Pb+PbO2+2H2SO4
2PbSO4+2H2O,硫酸浓度不断减小,B错误;
图Ⅲ所示装置是电解精炼铜,粗铜中的杂质放电进入电解质溶液,Cu2+浓度减小,C项错误;
图Ⅳ所示电池中正极反应:
Ag2O+2e-+H2O
2Ag+2OH-,D正确。
6.(2014广西桂林中学高三月考)普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。
根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:
2Cu+Ag2O
Cu2O+2Ag。
下列有关说法不正确的是( B )
A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:
2Cu+2OH--2e-
Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
测量原理装置图中,Ag2O/Ag极发生还原反应,电极反应式为Ag2O+H2O+2e-
2Ag+2OH-,B项不正确。
7.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是( C )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-
Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-
Ni2O3+3H2O
由总反应知,得电子的为正极(Ni2O3),失电子的为负极(Fe),A项正确;
由总反应知介质为碱性溶液,负极反应为Fe-2e-+2OH-
Fe(OH)2,B项正确;
电池充电时,阴极反应Fe(OH)2+2e-
Fe+2OH-,pH会增大,C项错误;
电池充电时,Ni(OH)2作阳极,失电子变为Ni2O3,D项正确。
8.(2012年上海化学)如图装置中发生反应的离子方程式为:
Zn+2H+
Zn2++H2↑,下列说法错误的是( A )
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
该池既可能是原电池,也可能是电解池。
若该装置为电解池,则a、b两电极的材料可以都为Zn,A错误;
在保证阳极为Zn时,该电解池的电解质溶液可以为稀盐酸,B正确;
在保证其中一电极的材料为Zn,另一电极的材料的活泼性比Zn弱的情况下,该原电池的电解质溶液为稀盐酸或稀硫酸都可以,C、D正确。
9.(2013年上海化学)糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。
下列分析正确的是( D )
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:
Fe-3e-
Fe3+
C.脱氧过程中碳作原电池负极,电极反应为:
2H2O+O2+4e-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL
(标准状况)
脱氧过程是放热的,A项错误;
脱氧过程中铁作负极,发生反应:
Fe-2e-
Fe2+,碳作正极,发生反应:
O2+2H2O+4e-
4OH-,B、C项错误;
由电池总反应及后续反应:
2Fe+O2+2H2O
2Fe(OH)2,4Fe(OH)2+O2+2H2O
4Fe(OH)3,可知:
4Fe~3O2,则1.12g铁粉,即0.02mol铁粉最多可吸收标准状况下O2为:
3×
22.4L/mol×
1000mL/L=336mL,D项正确。
10.(2014江南十校模拟)镁燃料电池作为一种高能化学电源,具有良好的应用前景。
下图是镁—空气燃料电池工作原理示意图。
下列有关该电池的说法正确的是( B )
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为:
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L
电解质溶液为NaCl中性溶液,所以正极反应类似吸氧腐蚀的正极反应,为O2+2H2O+4e-
4OH-,B正确;
负极反应为:
2Mg-4e-+4OH-
2Mg(OH)2,Mg被氧化,A错;
原电池中,电子由负极流向正极,C错;
D中O2未指定标准状况,所以无法计算其体积。
二、非选择题
11.(2014重庆南开中学、巴蜀中学期末)工业上用CO合成甲醇的反应式为:
CO(g)+2H2(g)
CH3OH(g)。
甲醇可用作燃料电池,其电池的工作原理如图所示。
(1)请写出X电极的电极反应式 。
(2)当电路中有3mole-转移时,电池负极区中n(H+)的变化量为 。
(1)从图中电子转移方向可知,X为负极、Y为正极,故X极通的a是甲醇,故该电极的反应方程式为:
CH3OH-6e-+H2O
CO2↑+6H+。
(2)正极氧气放电,消耗溶液中的H+,因溶液中只有H+通过,故电池负极区H+不变化。
答案:
(1)CH3OH-6e-+H2O
CO2↑+6H+
(2)0
12.(高考题组合)
(1)(2012年山东理综节选)利用反应2Cu+O2+2H2SO4
2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为 。
(2)(2012年天津理综改编)熔融状态下,Z(Na)的单质和FeG2(G为Cl)能组成可充电电池(装置示意图如图),反应原理为:
2Z+FeG2
Fe+2ZG
放电时,电池的正极反应式为
;
充电时, (写物质名称)电极接电源的负极;
该电池的电解质为 。
(1)根据电池反应可知,Cu作负极,电极反应为2Cu-4e-
2Cu2+,则正极反应为O2+4H++4e-
2H2O。
(2)Na与FeCl2形成的可充电电池在放电时为原电池,正极发生的反应为Fe2++2e-
Fe。
根据可充电电池装置可知,放电时熔融Na电极作负极,熔融FeCl2电极作正极;
充电时,原电池的负极接电源负极作电解池阴极,原电池的正极接电源正极作电解池阳极,故充电时钠接电源的负极。
因为该电池中电极材料为熔融Na电极和熔融FeCl2电极,所以电解质为β
Al2O3。
(1)O2+4e-+4H+
2H2O
(2)Fe2++2e-
Fe 钠 β
Al2O3
13.如图是氨氧燃料电池示意图,按照此图的提示,回答下列问题:
(1)a电极作 极(填“正”、“负”、“阴”或“阳”),其电极反应式为 ;
(2)反应一段时间后,电解质溶液的pH将 (填“增大”、“减小”或“不变”);
(3)已知①N2(g)+3H2(g)
2NH3(g)
ΔH=-92.4kJ/mol,
②2H2(g)+O2(g)
2H2O(g)
ΔH=-483.6kJ/mol,试写出氨气完全燃烧生成气态水的热化学方程式:
。
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气 L(标准状况)。
氨氧燃料电池中氨气失电子被氧化,生成氮气和水,作负极;
反应一段时间后由于生成的水稀释了氢氧化钾溶液,因此pH减小;
根据盖斯定律,由②×
3-①×
2得
4NH3(g)+3O2(g)
2N2(g)+6H2O(g)
ΔH=-1266kJ/mol;
由电子守恒可得,2NH3→3Zn,镀上97.5g锌消耗1mol氨气,在标准状况下的体积为22.4L。
(1)负 2NH3-6e-+6OH-
N2+6H2O
(2)减小
(3)4NH3(g)+3O2(g)
ΔH=-1266kJ/mol
(4)22.4
14.(2014云南玉溪模拟)
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ。
写出该反应的热化学方程式:
(2)利用该反应设计一个燃料电池:
用氢氧化钾溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。
通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式是
(3)如图所示实验装置中,石墨棒上的电极反应式为
如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填化学式)。
(1)根据已知条件可知,热化学方程式为2C2H6(g)+7O2(g)
4CO2(g)+6H2O(l) ΔH=-3116.6kJ/mol。
(2)原电池中负极失去电子,正极得到电子,所以乙烷在负极通入,氧气在正极通入;
又因为溶液显碱性,所以负极的电极反应式为:
C2H6-14e-+18OH-
2C
+12H2O。
(3)根据装置图可知,石墨是电子流出的极,所以石墨是阳极,溶液中的OH-失去电子,反应式为4OH--4e-
O2↑+2H2O;
一段时间后溶液的pH变为1,则溶液中氢离子的物质的量是0.1mol,则根据方程式2CuSO4+2H2O
2Cu+2H2SO4+O2↑可知,生成铜0.05mol,所以需要加入0.05mol氧化铜。
(1)2C2H6(g)+7O2(g)
4CO2(g)+6H2O(l)
ΔH=-3116.6kJ/mol
(2)负 C2H6-14e-+18OH-
+12H2O
(3)4OH--4e-
O2↑+2H2O CuO