硼族元素.docx
《硼族元素.docx》由会员分享,可在线阅读,更多相关《硼族元素.docx(27页珍藏版)》请在冰点文库上搜索。
硼族元素
硼族元素
硼族元素基本性质
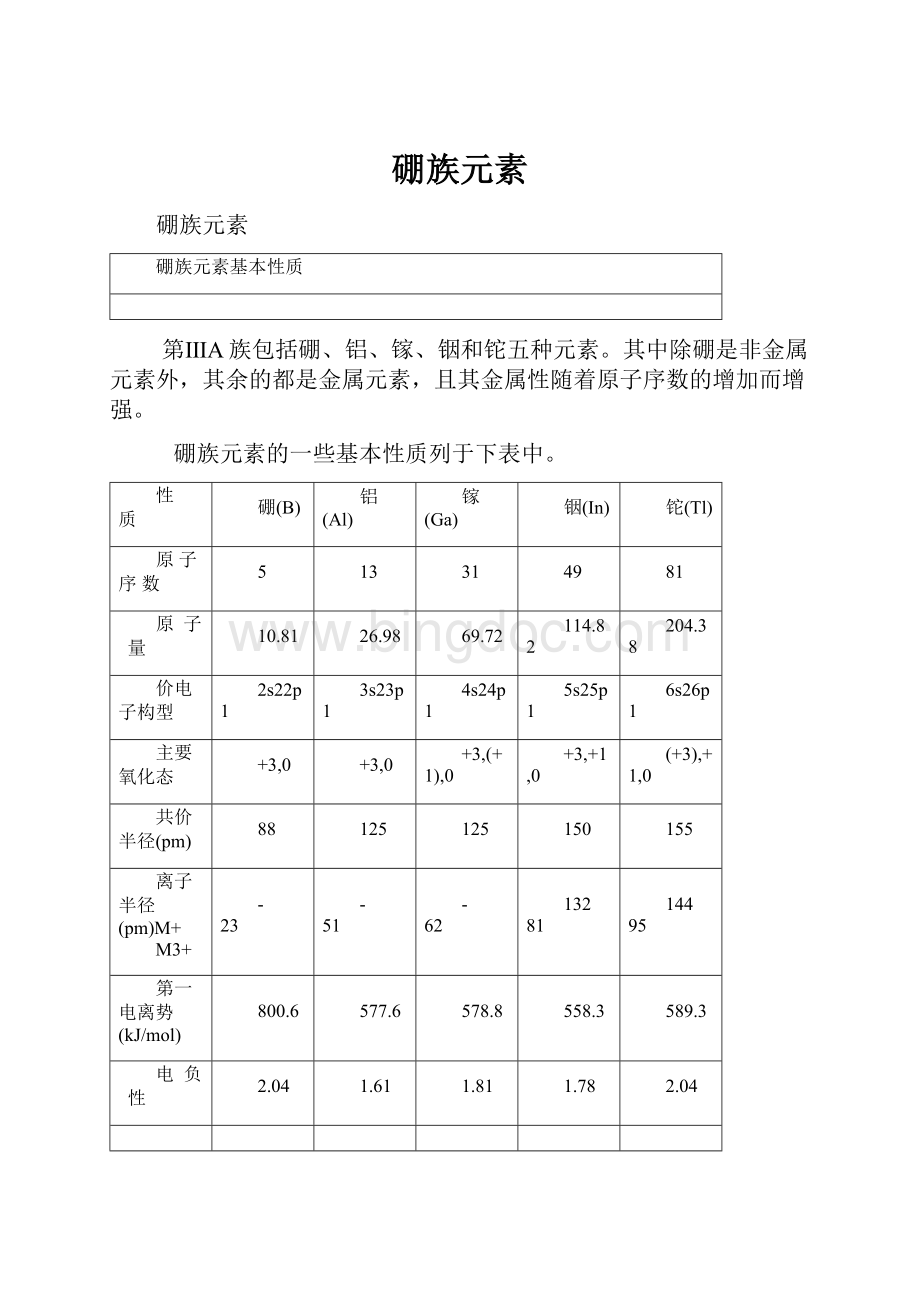
第ⅢA族包括硼、铝、镓、铟和铊五种元素。
其中除硼是非金属元素外,其余的都是金属元素,且其金属性随着原子序数的增加而增强。
硼族元素的一些基本性质列于下表中。
性 质
硼(B)
铝(Al)
镓(Ga)
铟(In)
铊(Tl)
原子序数
5
13
31
49
81
原 子 量
10.81
26.98
69.72
114.82
204.38
价电子构型
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
主要氧化态
+3,0
+3,0
+3,(+1),0
+3,+1,0
(+3),+1,0
共价半径(pm)
88
125
125
150
155
离子半径(pm)M+
M3+
-
23
-
51
-
62
132
81
144
95
第一电离势(kJ/mol)
800.6
577.6
578.8
558.3
589.3
电 负 性
2.04
1.61
1.81
1.78
2.04
硼族元素的特性
本族元素原子的价电子层结构为ns2np1,常见氧化态为+3和+1,随原子序数的递增,ns2电子对趋于稳定,特别是6s上的2个电子稳定性特别强。
使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳定性依次增强,其还原性依次减弱。
例如:
Tl(Ⅲ)是很强的氧化剂,而Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。
+Ⅲ氧化态的硼族元素具有相当强的形成共价键的倾向。
硼因原子半径较小,电负性较大,使其共价倾向最强,其它的硼族元素成键时表现为极性共价键。
硼族元素的价电子层有4条轨道(ns、npx、npy、npz),而只有3个价电子,这种价电子层中价轨道数超过价电子数的原子称为缺电子原子,中心原子价轨道数超过成键电子对数的化合物称为缺电子化合物。
如本族+Ⅲ价单分子化合物BF3、AlCl3等。
缺电子原子在形成共价键时,往往采用接受电子形成双聚分子或稳定化合物和形成多中心键(即较多中心原子靠较少电子结合起来的一种离域共价键)的方式来弥补成键电子的不足。
硼族元素电势图
下面列出了硼族元素的标准电极电势图。
硼元素
硼原子的价电子构型是2s22p1,它能提供成键的电子是2s12p1x2p1y,还有一个空轨道。
硼在化合物的分子中配位数为4还是3,取决于sp3或sp2杂化轨道中σ键的数目。
同硅一样,它不能形成多重键,而倾向于形成聚合体,例如通过B-O-B链形成B2O3或H3BO3或硼酸盐的庞大“分子”。
硼原子成键有三大特性:
(1)共价性—以形成共价化合物为特征;
(2)缺电子性—除了作为电子对受体易与电子对供体形成σ配键以外,还有形成多中心键的特征;(3)多面体习性—晶态硼和许多硼的化合物为多面体或多面体的碎片而成笼状或巢状等结构。
这种多面体习性同它能形成多种类型的键有关。
硼的化学主要表现在缺电子性质上。
单质硼
无定形和粉末状硼比较活泼,而晶态硼惰性较大。
(1)与氧的作用
4B+3O2
2B2O3 △rHθ=-2887kJ.mol-1
无定形硼在空气中燃烧,除生成B2O3以外,还可生成少量BN。
从硼的燃烧热及B-O键的键能(561~590kJ.mol-1)可知硼与氧的亲和力超过硅,所以它能从许多稳定的氧化物(如SiO2,P2O5,H2O等)中夺取氧而用作还原剂。
它在炼钢工业中用作去氧剂。
(2)与非金属作用
无定形硼在室温下与F2反应得到BF3,加热时也能与Cl2、Br2、S和N2反应,分别得到BCl3、BBr3、B2S3和BN(在1473K以上)。
它不与H2作用。
2B+3F2
2BF3
(3)与酸的作用
它不与盐酸作用,仅被氧化性酸,如浓HNO3、浓H2SO4和王水所氧化:
B+3HNO3
H3BO3+3NO2↑
2B+3H2SO4
2H3BO3+3SO2↑
(4)与强碱作用
无定形硼与NaOH有类似硅那样的反应:
2B+6NaOH
2Na3BO3+3H2↑
(5)与金属作用
硼几乎与所有金属都生成金属型化合物。
它们的组成一般为M4B、M2B、MB、M3B4、MB2及MB6,如Nb3B4、Cr4B、LaB6、…等。
这些化合物一般都很硬,且耐高温、抗化学侵蚀,通常它们都具有特殊的物理和化学性质。
硼的氢化物-硼烷
一:
硼烷的概况
用类似于制硅烷的方法已制得二十多种硼的氢化物-硼烷。
硼烷在组成上与硅烷、烷烃相似,而在物理、化学性质方面更像硅烷。
碳、硅、硼的氢化物的物理性质的比较
硼 烷
烷 烃
硅 烃
化合物
熔点/K
沸点/K
化合物
熔点/K
沸点/K
化合物
熔点/K
沸点/K
B2H6
107.5
180.5
CH4
90
110
SiH4
88
161
C2H6
101
184.7
Si2H6
141
258
C3H8
83
228
Si3H8
156
326
B4H10
153
291
C4H10
148
272.5
Si4H10
189
380
B5H9
226.4
321
C5H12
141
309.2
Si5H12
-
>373
B5H11
150
336
C6H14
178.7
342
Si6H14
-
>373
B6H10
210.7
383
-
-
-
-
-
-
-
-
-
C7H16
183.0
371.4
-
-
-
B10H14
372.6
486
C10H22
241
447
-
-
-
硼烷有BnHn+4和BnHn+6两大类,前者较稳定。
在常温下,B2H6及B4H10为气体,B5~B8的硼烷为液体,B10H14及其它高硼烷都是固体。
常见硼烷的物理性质见下表。
分子式
B2H6
B4H10
B5H9
B5H11
B6H10
B10H14
名称
乙硼烷
丁硼烷
戊硼烷-9
戊硼烷-11
已硼烷
癸硼烷
室温下状态
气体
气体
液体
液体
液体
固体
沸点/K
180.5
291
321
336
383
486
熔点/K
107.5
153
226.4
150
210.7
372.6
溶解情况
易溶于乙醚
易溶于苯
易溶于苯
-
易溶于苯
易溶于苯
水解情况
室温下很快
室温下缓慢
363K,三天尚未水解完全
-
363K时16小时尚未水解完全
室温缓慢加热较快
稳定性
373K以下稳定
不稳定
很稳定
室温分解
室温缓慢分解
极稳定
硼烷多数有毒、有气味、不稳定,有些硼烷加热即分解。
硼烷水解即放出H2,它们还是强还原剂,如与卤素反应生成卤化硼。
在空气中激烈地燃烧且放出大量的热。
因此,硼烷曾被考虑用作高能火箭燃料。
如:
B2H6+3O2
B2O3+3H2O △rHθ=-2166kJ.mol-1
B2H6+6X2
2BX3+6HX
组成相当于CH4和SiH4的BH3是否能瞬时存在,至今还是个疑问,制备反应中得到的是BH3的二聚体B2H6。
4BF3.Et2O+3NaBH4
2B2H6↑+3NaBF4+4Et2O
二、乙硼烷的性质
1.分子结构
在B2H6分子中,每个B原子都采用sp3杂化,4条杂化轨道中2条与两个H原子形成σ键,这4个σ键在同一平面。
另两条杂化轨道和另一个硼原子的两条杂化轨道以及另两个氢的1s轨道重叠并分别共用2个电子,形成了垂直于上述平面的两个三中心二电子键,一个在平面之上,另一个在平面之下(见图13-26)。
每个三中心二电子键是由一个氢原子和两个硼原子共用2个电子构成的,又称“硼氢桥键”。
图13-26B2H6的分子结构
这种三中心二电子键是由三个原子(2个B,1个H)轨道组成三个分子轨道—成键、反键、非键轨道(其能级与原来的硼原子的一样),而让2个电子填充在成键轨道上形成的(见图13-27)。
在B2H6分子中共有两种键:
B-H(2c-2e)硼氢键和
(3c-2e)氢桥键。
图13-27(3c-2e)键中分子轨道能级图
2.性质:
乙硼烷受热容易分解,它的热分解产物很复杂,有B4H10、B5H9、B5H11和B10H14等,控制不同条件,可得到不同的主产物。
如:
2B2H6
B4H10+H2
它遇水立即发生水解:
B2H6+6H2O
2H3BO3↓+6H2↑
乙硼烷是缺电子化合物,属路易斯酸,它可以与路易斯碱化合,如:
B2H6+2LiH
2Li[BH4]
B2H6+2CO
2[H3B·CO]
与NH3反应产物复杂,由反应条件决定:
三:
高硼烷的分子结构
在高硼烷中,除了B-H(2c-2e)硼氢键和
(3c-2e)氢桥键这两种键以外,还可能有:
B-B(2c-2e)硼-硼键,
(3c-2e)开口三中心键(硼桥键)和
(或
)(3c-2e)闭合三中心键(闭合硼键)。
所以硼烷分子中常见的键型共有五种。
高硼烷的分子构型为正二十面体,或为不完整的二十面体碎片(去掉一个或几个顶角)所具有的巢状或蛛网状结构(见图13-28)。
图13-28巢状硼烷结构
硼氢配合物
B2H6与LiH反应,将得到一种比B2H6的还原性更强的还原剂硼氢化锂LiBH4。
让过量的NaH与BF3反应,或让NaH与硼酸三甲脂B(OCH3)3反应,可得到硼氢化钠NaBH4。
2LiH+B2H6
2LiBH4
4NaH+BF3
NaBH4+3NaF
4NaH+B(OCH3)3
NaBH4+3NaCH3O
硼氢化物都是白色盐型化合物晶体,能溶于水或乙醇,无毒,化学性质稳定。
由于其分子中有BH4-离子(即H-离子),它们是极强的还原剂。
在还原反应中,它们各有选择性(例如NaBH4只还原醛、酮和酰氯类)且用量少,操作简单,对温度又无特殊要求,在有机合成中副反应少,这样就使得一些复杂的有机合成反应变得快而简单,并且产品质量好。
它在制药、染料和精细化工制品(作为制氢化物的起始原料)的生产中已得到越来越广泛的应用。
LiBH4的燃烧热很高,可作火箭燃料。
卤化硼
硼的四种卤化物BX3均已制得,它们的一些物理性质列于表13-30中.
表13-30卤化硼的一些物理性质
名 称
BF3
BCl3
BBr3
BI3
状态(室温)
气体
液(略加压)
液体
固体
熔点/(K)
146
166
227
316
沸点/(K)
172
285
364
483
它们都是共价化合物,易溶于非极性溶剂,都易于水解.这些化合物都是缺电子化合物,是很强的路易士酸,因此,都易于和具有孤电子对的物质如HF、NH3、醚、醇以及胺类等反应,有的形成加合物.
BCl3遇水强烈地水解:
BCl3(l)+3H2O(l)
H3BO3(s)+3HCl(aq)
氟硼酸
当BF3遇水则形成1:
1或1:
2的加合物。
只有在较小量BF3通入水时,才能得到氟硼酸溶液:
4BF3+3H2O
3BF4-+3H++H3BO3
它是一种强酸,仅以离子状态存在于水溶液中。
铜、锡、铅、镉、钴、铁、镍等金属的氟硼酸盐用于电镀,速度快,镀层质量好,又省电。
硼的氧化物
三氧化二硼B2O3的熔点为72OK,沸点为2523K;易溶于水,形成硼酸:
B2O3+3H2O
2H3BO3
但遇热的水蒸气可生成易挥发的偏硼酸:
B2O3+H2O(g)
2HBO2(g)
由于B-O键能大,即使在高温下也只能被强还原剂镁或铝所还原。
熔融玻璃体B2O3可以溶解多种金属氧化物得到有特征颜色的玻璃,也用此来作定性鉴定。
硼酸
一:
结构
如果说构成二氧化硅、硅酸和硅酸盐的基本结构单元是SiO4四面体,那么,构成三氧化二硼、硼酸和多硼酸的基本结构单元是平面三角形的BO3(见图13-30,a)和四面体的BO4(见图13-32)。
在H3BO3的晶体中,每个硼原子用3个sp2杂化轨道与3个氢氧根中的氧原子以共价键相结合(见图13-30,b)。
每个氧原子除以共价键与一个硼原子和一个氢原子相结合外,还通过氢键同另一H3PO3单元中的氢原子结合而连成片层结构(如图13-30,C),层与层之间则以范德华力相吸引。
硼酸晶体是片状的,有滑腻感,可作润滑剂。
硼酸的这种缔合结构使它在冷水中的溶解度很小(273K时为6.359/100g水);加热时,由于晶体中的部分氢键被破坏,其溶解度增大(373K时为27.6g/100g水)。
图13-30BO3及H3BO3结构示意图
二:
性质
硼酸H3BO3为白色片状晶体,微溶于水,在热水中溶解度明显增大,这是由于受热时,晶体中的氢键部分断裂所致。
H3BO3是一元弱酸,Ka=6×10-10。
它之所以有酸性并不是因为它本身给出质子,而是由于硼是缺电子原子,它加合了来自H2O分子的OH-(其中氧原子有孤电子对)而释出H+离子。
利用H3BO3的这种缺电子性质,加入多羟基化合物(如甘油或甘露醇等),可使硼酸的酸性大为增强:
所生成的配合物的Ka=7.08×10-6,此时溶液可用强碱以酚酞为指示剂进行滴定。
常利用硼酸和甲醇或乙醇在浓H2SO4存在的条件下,生成挥发性硼酸酯燃烧所特有的绿色火焰来鉴别硼酸根。
H3BO3+3CH3OH
B(OCH3)3+3H2O
H3BO3与强碱NaOH中和,得到偏硼酸钠NaBO2,在碱性较弱的条件下则得到四硼酸盐,如硼砂Na2B4O7·10H2O,而得不到单个BO33-离子的盐。
但反过来,在任何一种硼酸盐的溶液中加酸时,总是得到硼酸,因为硼酸的溶解度较小,它容易从溶液中析出。
加热灼烧H3BO3时起下列变化:
H3BO3
HBO2
B2O3
多硼酸盐-硼砂
一:
结构
硼酸同硅酸相似,可缩合为链状或环状的多硼酸xB2O3.yH2O,所不同的是在多硅酸中,只有SiO4四面体这一种结构单元,而在多硼酸中有两种结构单元,一种即前述BO3平面三角形,另一种系硼原子以sp3杂化轨道与氧原子结合而成的BO4四面体。
在多硼酸中最重要的是四硼酸。
实验证明四硼酸根[B4O5(OH)4]2-离子的结构如图13-31所示。
图13-31[B4O5(OH)4]2-离子的立体结构
二:
性质
除IA族金属元素以外,多数金属的硼酸盐不溶于水。
多硼酸盐与硅酸盐一样,加热时容易玻璃化。
最常用的硼酸盐即硼砂。
它是无色半透明的晶体或白色结晶粉末。
在它的晶体中,[B4O5(OH)4]2-离子通过氢键连接成链状结构,链与链之间通过Na+离子键结合,水分子存在于链之间,所以硼砂的分子式按结构应写为Na2B4O5(OH)4.8H2O。
硼砂在干燥空气中容易风化,加热到623~673K时,成为无水盐,继续升温至1151K则熔为玻璃状物。
它风化时首先失去链之间的结晶水,温度升高,则链与键之间的氢键因失水而被破坏,形成牢固的偏硼酸骨架。
硼砂同B2O3一样,在熔融状态能溶解一些金属氧化物,并依金属的不同而显出特征的颜色(硼酸也有此性质)。
例如:
Na2B4O7+CoO
2NaBO2.Co(BO2)2(蓝宝石色)
因此,在分析化学中可以用硼砂来作“硼砂珠试验”,鉴定金属离子。
此性质也被应用于搪瓷和玻璃工业(上釉、着色)和焊接金属(去金属表面的氧化物)。
硼砂还可以代替B2O3用于制特种光学玻璃和人造宝石。
硼酸盐中的B-O-B键不及硅酸盐中的Si-O-Si键牢,所以硼砂较易水解。
它水解时,得到等物质的量的H3BO3和B(OH)4-,
B4O5(OH)42-+5H2O
2H3BO3+2B(OH)4-
这种水溶液具有缓冲作用。
硼砂易于提纯,水溶液又显碱性,所以分析化学上常用它来标定酸的浓度。
硼砂还可以作肥皂和洗衣粉的填料。
硼的其它化合物
一:
过硼酸盐
将硼酸盐与H2O2反应或者让H3BO3与碱金属的过氧化物反应,都可以得到过硼酸盐。
如
H3BO3+Na2O2+HCl+2H2O
NaBO3·4H2O+NaCl
过硼酸钠NaBO3·4H2O是强氧化剂,水解时放出H2O2,用于漂白羊毛、丝、革和象牙等物或加在洗衣粉中作漂白剂。
过硼酸钠的分子结构尚未弄明白,可看作是含H2O2的水合物NaBO2·H2O2·3H2O。
它是无色晶体,加热失水后成为黄色固体。
二:
氮化硼
将硼砂与NH4Cl一同加热,再用盐酸、热水处理、可得到白色固体氮化硼BN。
Na2B4O7+2NH4Cl
2NaCl+B2O3+2BN+4H2O
在高温下用硼和氨或氮作用也可得BN。
BN具有石墨型晶体结构,层内的硼原子和氮原子均采取sp2杂化轨道相互结合。
结构中B-N基团同C-C基团是等电子体。
BN耐腐蚀、热稳定性好,在3272K的高温下仍保持稳定的固体状态。
它的电阻大,导热率大,绝缘性能好。
当前它主要用作润滑材料,耐磨材料,电气和耐热的涂层材料。
在高温高压下,石墨晶形的BN可转化为金刚石型立方晶系的BN。
这种金刚石结构的BN的硬度可与金刚石的硬度相比拟。
金属铝
铝是银白色金属,熔点930K,沸点2700K.具有良好的导电性和延展性,也是光和热的良好反射体.
铝最突出的化学性质是亲氧性,同时它又是典型的两性元素。
铝一接触空气或氧气,其表面就立即被一层致密的氧化膜所覆盖,这层膜可阻止内层的铝被氧化,它也不溶于水,所以铝在空气和水中都很稳定。
铝的亲氧性还可以从氧化铝非常高的生成焓看出来。
4Al+3O2
2Al2O3 △fHθ=-3339kJ·mol-1
由于铝的亲氧性,它能从许多氧化物中夺取氧,故它是冶金上常用的还原剂。
且常被用于冶炼铁,镍,铬,锰,钒等难熔金属,称为铝还原法。
Fe2O3+2Al
Al2O3+2Fe
高纯度的铝(99.950%)不与一般酸作用,只溶于王水。
普通的铝能溶于稀盐酸或稀硫酸,被冷的浓H2SO4或浓、稀HNO3所钝化。
所以常用铝桶装运浓H2SO4、浓HNO3或某些化学试剂。
但是铝能同热的浓H2SO4反应。
2Al+6H2SO4(浓)
Al2(SO4)3+3SO2↑+6H2O
铝比较易溶于强碱中。
2Al+2NaOH+6H2O
2Na[Al(OH)4]+3H2↑
氧化铝
一:
α-Al2O3
自然界存在的刚玉为α-Al2O3,它的晶体属于六方紧密堆积构型,6个氧原子围成一个八面体,在整个晶体中有2/3的八面体孔穴为Al原子所占据。
由于这种紧密堆积结构,加上晶体中Al3+离子与O2-离子之间的吸引力强,晶格能大,所以α-Al2O3的熔点(2288±15K)和硬度(8.8)都很高。
它不溶于水,也不溶于酸或碱,耐腐蚀且电绝缘性好,用作高硬度材料、研磨材料和耐火材料。
天然的或人造刚玉由于含有不同杂质而有多种颜色。
例如,合微量Cr(Ⅲ)的呈红色,称为红宝石;含有Fe(Ⅱ)、Fe(Ⅲ)或Ti(Ⅳ)的称为蓝宝石;含少量Fe3O4的称为刚玉粉。
将任何一种水合氧化铝加热至1273K以上,都可以得到α-Al2O3。
工业上用高温电炉或氢氧焰熔化氢氧化铝以制得人造刚玉。
二:
γ-Al2O3
在温度为723K左右时,将Al(OH)3、偏氢氧化铝AlO(OH)或铝铵矾(NH4)2SO4·Al2(SO4)3·24H2O加热,使其分解,则得到γ-Al2O3。
这种Al2O3不溶于水,但很易吸收水分,易溶于酸。
把它强热至1273K,即可转变α-Al2O3。
γ-Al2O3的粒子小,具有强的吸附能力和催化活性,所以又名活性氧化铝,可用作吸附剂和催化剂。
三:
β-Al2O3
还有一种β-Al2O3,它有离子传导能力(允许Na+通过),以β-铝矾土为电解质制成钠-硫蓄电池。
由于这种蓄电池单位重量的蓄电量大,能进行大电流放电,因而具有广阔的应用前景。
这种电池负极为熔融钠,正极为多硫化钠(Na2Sx),电解质为β-铝矾土(钠离子导体)其电池反应为:
正极 2Na++xS+2e-
Na2Sx
负极 2Na
2Na++2e-
-------------------------------------------------
总反应:
2Na+xS
Na2Sx
这种蓄电池使用温度范围可达620~680K,其蓄电量为铅蓄电池蓄电量的3~5倍。
用β-Al2O3陶瓷做电解食盐水的隔膜生产烧碱,有产品纯度高,公害小的特点。
氢氧化铝
Al2O3的水合物一般都称为氢氧化铝。
它可以由多种方法得到。
加氨水或碱于铝盐溶液中,得一种白色无定形凝胶沉淀。
它的含水量不定,组成也不均匀,统称为水合氧化铝。
无定形水合氧化铝在溶液内静置即逐渐转变为结晶的偏氢氧化铝AlO(OH),温度越高,这种转变越快。
若在铝盐中加弱酸盐碳酸钠或醋酸钠,加热,则有偏氢氧化铝与无定形水合氧化铝同时生成。
只有在铝酸盐溶液中通入CO2,才能得到真正的氢氧化铝白色沉淀,称为正氢氧化铝。
结晶的正氢氧化铝与无定形水合氧化铝不同,它难溶于酸,而且加热到373K也不脱水;在573K下,加热两小时,才能变为AlO(OH)。
氢氧化铝是典型的两性化合物。
新鲜制备的氢氧化铝易溶于酸也易溶于碱:
3H2O+Al3+
Al(OH)3
Al(OH)4-
例如:
Al(OH)3+3HNO3
Al(NO3)3+3H2O
Al(OH)3+KOH
K[Al(OH)4]
铝盐和铝酸盐
一:
铝盐
用金属铝或氧