中考九年级化学的全部化学符号.docx
《中考九年级化学的全部化学符号.docx》由会员分享,可在线阅读,更多相关《中考九年级化学的全部化学符号.docx(17页珍藏版)》请在冰点文库上搜索。
中考九年级化学的全部化学符号
中考九年级化学的全部化学符号
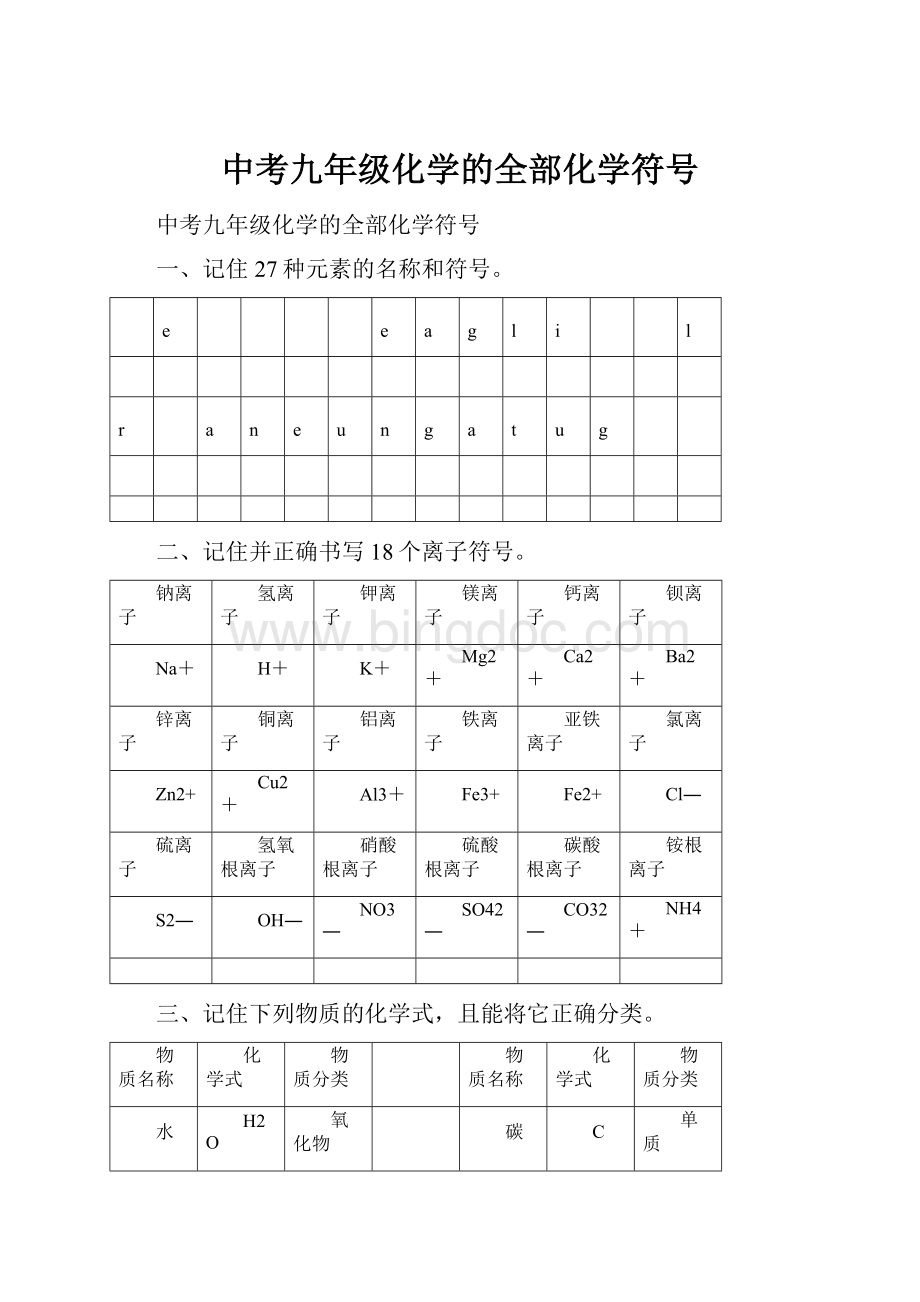
一、记住27种元素的名称和符号。
H
He
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
氢
氦
碳
氮
氧
氟
氖
钠
镁
铝
硅
磷
硫
氯
Ar
K
Ca
Mn
Fe
Cu
Zn
Ag
Ba
Pt
Au
Hg
I
氩
钾
钙
锰
铁
铜
锌
银
钡
铂
金
汞
碘
二、记住并正确书写18个离子符号。
钠离子
氢离子
钾离子
镁离子
钙离子
钡离子
Na+
H+
K+
Mg2+
Ca2+
Ba2+
锌离子
铜离子
铝离子
铁离子
亚铁离子
氯离子
Zn2+
Cu2+
Al3+
Fe3+
Fe2+
Cl―
硫离子
氢氧根离子
硝酸根离子
硫酸根离子
碳酸根离子
铵根离子
S2―
OH―
NO3―
SO42―
CO32―
NH4+
三、记住下列物质的化学式,且能将它正确分类。
物质名称
化学式
物质分类
物质名称
化学式
物质分类
水
H2O
氧化物
碳
C
单质
过氧化氢
H2O2
氧化物
氧气
O2
单质
一氧化碳
CO
氧化物
氮气
N2
单质
二氧化碳
CO2
氧化物
氢气
H2
单质
二氧化硫
SO2
氧化物
氯气
Cl2
单质
三氧化硫
SO3
氧化物
硫
S
单质
五氧化二磷
P2O5
氧化物
磷
P
单质
二氧化氮
NO2
氧化物
铁
Fe
单质
四氧化三铁
Fe3O4
氧化物
铝
Al
单质
氧化铁
Fe2O3
氧化物
镁
Mg
单质
氧化钙
CaO
氧化物
锌
Zn
单质
氧化镁
MgO
氧化物
铜
Cu
单质
氧化铝
Al2O3
氧化物
汞
Hg
单质
二氧化锰
MnO2
氧化物
银
Ag
单质
氧化铜
CuO
氧化物
氢氧化钾
KOH
碱
氧化汞
HgO
氧化物
氢氧化钠
NaOH
碱
氯化氢(水溶液叫盐酸)
HCl
酸
氢氧化钙
Ca(OH)2
碱
碳酸
H2CO3
酸
氢氧化铁
Fe(OH)3
碱
硫酸
H2SO4
酸
氢氧化铜
Cu(OH)2
碱
碳酸钙
CaCO3
盐
硫酸铝
Al2(SO4)3
盐
碳酸氢钠
NaHCO3
盐
硫酸镁
MgSO4
盐
碳酸钠
Na2CO3
盐
硫酸亚铁
FeSO4
盐
碳酸钡
BaCO3
盐
硫酸铁
Fe2(SO4)3
盐
氯化铜
CuCl2
盐
硫酸铜
CuSO4
盐
氯化钠
NaCl
盐
硫酸钠
Na2SO4
盐
氯化钙
CaCl2
盐
亚硫酸钠
Na2SO3
盐
氯化亚铁
FeCl2
盐
硫酸锌
ZnSO4
盐
氯化铁
FeCl3
盐
硫酸钡
BaSO4
盐
氯化锌
ZnCl2
盐
硝酸银
AgNO3
盐
氯化镁
MgCl2
盐
硝酸钡
Ba(NO3)2
盐
氯化银
AgCl
盐
硝酸铜
Cu(NO3)2
盐
硝酸钠
NaNO3
盐
硝酸钾
KNO3
盐
甲烷
CH4
有机物
高锰酸钾
KMnO4
盐
乙醇
C2H5OH
有机物
锰酸钾
K2MnO4
盐
四、记住下列反应的化学方程式。
1.木炭在空气中充分燃烧
C+O2CO2
2.硫在空气中燃烧
S+O2SO2
3.红磷在空气中燃烧
4P+5O22P2O5
4.铁在氧气中燃烧
3Fe+2O2Fe3O4
5.镁带在空气中燃烧
2Mg+O22MgO
6.铝在空气中被氧化
4Al+3O2=2Al2O3
7.铜在空气中加热(现象:
红色固体变黑)
2Cu+O2
2CuO
8.氢气在空气里燃烧
2H2+O22H2O
9.碳在空气中不充分燃烧
2C+O22CO
10.一氧化碳燃烧
2CO+O22CO2
11.甲烷燃烧
CH4+2O2CO2+2H2O
12.乙醇燃烧
C2H5OH+3O22CO2+3H2O
13.实验室用过氧化氢和二氧化锰的混合物制氧气
2H2O22H2O+O2↑
14.实验室用加热氯酸钾和二氧化锰的混合物制氧气
2KClO32KCl+3O2↑
15.实验室用加热高锰酸钾的方法制氧气
2KMnO4
K2MnO4+MnO2+O2↑
16.实验室用大理石(或石灰石)与稀盐酸反应制二氧化碳气体
CaCO3+2HCl=CaCl2+H2O+CO2↑
17.实验室用锌粒与稀硫酸反应来制氢气
Zn+H2SO4=ZnSO4+H2↑
18.水通电分解
2H2O2H2↑+O2↑
19.氢气还原氧化铜
H2+CuO
Cu+H2O
20.碳还原氧化铜
C+2CuO2Cu+CO2↑
21.碳还原氧化铁
3C+2Fe2O34Fe+3CO2↑
22.碳还原二氧化碳
C+CO22CO
23.一氧化碳还原氧化铁(炼铁原理)
3CO+Fe2O32Fe+3CO2
24.一氧化碳还原氧化铜
CO+CuO
Cu+CO2
25.二氧化碳通入澄清的石灰水
CO2+Ca(OH)2=CaCO3↓+H2O
26.二氧化碳与水反应
CO2+H2O=H2CO3
27.碳酸分解
H2CO3=H2O+CO2↑
28.碳酸钙高温分解
CaCO3CaO+CO2↑
29.铁丝伸入硫酸铜溶液中
Fe+CuSO4=FeSO4+Cu
30.金属与盐酸(或稀硫酸)反应
Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑
Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑
31.金属氧化物与盐酸(或稀硫酸)反应
Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2OCuO+H2SO4=CuSO4+H2O
32.碱与酸发生中和反应
NaOH+HCl=NaCl+H2O2NaOH+H2SO4=Na2SO4+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
33.碳酸钠中加入稀盐酸
Na2CO3+2HCl=2NaCl+H2O+CO2↑(CO32―的检验)
34.非金属氧化物与碱反应
CO2+2NaOH=Na2CO3+H2OSO2+2NaOH=Na2SO3+H2O
35.盐与碱反应
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(氢氧化铜是蓝色沉淀)
3NaOH+FeCl3=Fe(OH)3↓+3NaCl(氢氧化铁是红褐色沉淀)
36.盐与盐反应
AgNO3+NaCl=AgCl↓+NaNO3(Cl―的检验)
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3(SO42―的检验)
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3(BaCO3溶于稀硝酸)
二、中考化学推断题
2.下图为A~G(初中常见物质)的转化关系:
根据以上信息回答下列问题:
(1)若A是一种最简单的有机物,则其化学式是________。
(2)若反应①为置换反应,则该反应的化学方程式为_____________________________。
(3)写出反应②的化学方程式___________________________。
(4)反应③可应用于__________________(填一种用途),反应的现象是______________________。
(5)在图示转化反应中,属于复分解反应的是____________(填序号)。
(6)若A为其他的可燃性气体,则A中一定含有的元素是____________,且A_______(选填字母序号)
A只能是纯净物B只能是混合物C既可能是纯净物,也可能是混合物
【答案】CH4
金属除锈红棕色固体逐渐消失,溶液由无色变成黄色③④碳元素和氢元素C
【解析】
【详解】
(1)最简单的有机物是甲烷,化学式是:
CH4;
(2)若反应①为置换反应,则该反应是碳和氧化铁在高温下生成铁和二氧化碳,反应的化学方程式为:
;
(3)反应②是水和氧化钙反应生成氢氧化钙和水,反应的化学方程式为:
;
(4)氧化铁和硫酸反应生成生成硫酸铁和水,反应现象为:
红棕色固体逐渐消失,溶液由无色变成黄色;可用于金属除锈;
(5)氧化铁和硫酸反应生成生成硫酸铁和水,硫酸铁和氢氧化钙反应生成氢氧化铁和硫酸钙,都属于复分解反应;
(6)根据质量守恒定律可知,A中一定含有碳元素和氢元素,既可能是纯净物,也可能是混合物。
【点睛】
在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
3.现有一包固体粉末,可能含有FeCl3、Na2SO4、NaOH、CaCO3、NH4HCO3、Na2CO3中的一种或几种.现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含_____.
(2)另取少量固体溶于水,得到无色澄清溶液,则原固体中一定不含_____.
(3)取
(2)中溶液适量,滴加过量BaC12溶液,出现白色沉淀,过滤得固体A和滤液B.固体A能全部溶于稀硝酸并产生气泡.则原固体中一定含有_____,一定不含_____.
(4)向滤液B中通入CO2,产生白色沉淀,由此判断原固体中还含有NaOH.生成白色沉淀总反应的化学方程式_____.
【答案】NH4HCO3FeCl3、CaCO3Na2CO3Na2SO4BaCl2+CO2+2NaOH=BaCO3↓+2NaCl+H2O
【解析】
【详解】
碳酸氢铵不稳定,受热会分解成氨气、水和二氧化碳,氯化铁在溶液中显黄色,硫酸钠和氯化钡会生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡会生成溶于酸的碳酸钡沉淀,氢氧化钠和二氧化碳反应会生成碳酸钠,因此:
(1)取少量固体加热,无氨味,则原固体中一定不含NH4HCO3;
(2)另取少量固体溶于水,得到无色澄清溶液,则原固体中一定不含FeCl3,CaCO3;
(3)取
(2)中溶液适量,滴加过量BaC12溶液,出现白色沉淀,过滤得固体A和滤液B.固体A能全部溶于稀硝酸并产生气泡.则原固体中一定含有Na2CO3,一定不含Na2SO4;
(4)向滤液B中通入CO2,产生白色沉淀,由此判断原固体中还含有NaOH,生成白色沉淀总反应是氢氧化钠、二氧化碳、氯化钡反应生成碳酸钡沉淀、氯化钠和水,化学方程式为:
BaCl2+2NaOH+CO2=BaCO3↓+2NaCl+H2O。
【点睛】
在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
4.A~G是初中化学常见的物质,B和D能参与光合作用,F可用于改良酸性土壤.它们之间的关系如图所示(“﹣”表示相连两物质之间能发生反应,“→”表示由某一物成转化为另一物质,部分反应物、生成物及反应条件已略去),每个虚线圈中各反应的基本反应类型相同.
(1)写出物质的化学式:
A_______,G__________.
(2)反应F→E的基木反应类型是__________.
(3)反应D﹣F的化学方程式是__________________.
(4)反应G→E的现象是________.
【答案】H2O2Na2CO3复分解反应CO2+Ca(OH)2═CaCO3↓+H2O有白色沉淀产生
【解析】
A~G是初中化学常见的物质,B和D能参与光合作用,F可用于改良酸性土壤,且F能够和D反应,因此F是氢氧化钙,D是二氧化碳,B是水;A能够产生水和C,水也能产生C,因此A可以是过氧化氢,C是氧气;氢氧化钙能够和G反应,氢氧化钙和G都能产生E,E反应产生二氧化碳,因此E可能是碳酸钙;则G可能是碳酸钠,带入验证符合转化关系,因此:
(1)A是过氧化氢,G是碳酸钠;
(2)氢氧化钙可以和碳酸钠反应产生碳酸钙沉淀和氢氧化钠,该反应属于复分解反应;(3)二氧化碳和氢氧化钙反应产生碳酸钙沉淀和水,化学方程式为:
;(4)碳酸钠可以和氢氧化钙反应产生碳酸钙沉淀,因此会观察到有白色沉淀产生。
5.有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH、KCl中的一种或几种,为证明其组成,进行如下实验:
(1)取少量白色粉末,加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液
(2)向实验
(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。
(3)向实验
(1)得到的滤液中通入CO2气体,得到白色沉淀。
根据上述实验现象判断:
①白色固体中一定不含______,一定含有_____________。
②写出(3)中白色沉淀的化学式____________________。
【答案】CuSO4、Na2SO4CaCO3、BaCl2BaCO3
【解析】
【详解】
取少量白色粉末,加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,说明一定不含有硫酸铜可能含有碳酸钙或硫酸钠和氯化钡;向实验
(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。
说明一定含有碳酸钙,硫酸钠和氯化钡不能同时存在;向实验
(1)得到的滤液中通入CO2气体,得到白色沉淀。
说明一定含有氯化钡,一定不含硫酸钠。
①白色固体中一定不含①CuSO4、Na2SO4;一定含有CaCO3、BaCl2。
②(3)中白色沉淀的化学式BaCO3。
考点:
物质的推断及转化
6.实验室现有四种失去标签的白色固体,分别为无水硫酸铜、硝酸钡、氯化钡、氢氧化钠中的一种。
为区分它们进行了下列实验,请回答问题。
(1)步骤Ⅰ:
将这四种白色固体分别编号为A、B、C、D。
步骤Ⅱ:
取少量上述四种白色固体样品分别放入四支试管中,加入足量蒸馏水,振荡,固体全部溶解,且C溶液呈蓝色,则C是_____(写化学式,下同)。
(2)步骤Ⅲ:
取少量A、B、D的溶液分别放入三支试管中,向三种溶液中各加入适量C溶液,装有B溶液的试管中产生蓝色沉淀,该反应的化学方程式为_____。
(3)步骤Ⅳ:
为进一步区分A和D,另有两支试管分别取少量A溶液和D溶液,加入适量_____溶液。
【答案】CuSO4
AgNO3
【解析】
【详解】
(1)C溶液呈蓝色,则C是硫酸铜,故填:
CuSO4。
(2)氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,化学方程式为
,故填:
。
(3)另有两支试管分别取少量A溶液和D溶液,分别为硫酸钡和氯化钡溶液,想要鉴别两者,可加入适量硝酸银溶液即可,有白色沉淀生成的是氯化钡,无变化的是硝酸钡;故填:
AgNO3。
7.某白色固体混合物可能含有Na2CO3、KOH、MgCl2、CaCl2中的一种或几种。
为了确定该混合物的成份,宇琛同学进行了如下实验:
(1)在固体样品中加入足量水搅拌后的操作Ⅰ是_____,该操作必须用到的玻璃仪器有玻璃棒、烧杯和_____,其中玻璃棒的作用是_____;
(2)往白色沉淀B中加入足量稀盐酸,沉淀全部溶解且无气泡产生,则反应的化学方程式为_____;
(3)取无色溶液A少量于试管中,通入CO2,得到无色溶液C和白色沉淀D,该步骤发生的化学反应方程式为_____;
(4)原白色固体中含有的物质是_____。
【答案】过滤漏斗引流Mg(OH)2+2HCl=MgCl2+2H2O2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl(或Ca(OH)2+CO2=CaCO3↓+H2O)KOH、MgCl2、CaCl2
【解析】
【分析】
根据实验可知:
加入足量的水,溶解之后,得到白色沉淀B和无色滤液A,可以推测白色沉淀是两物质反应产生的不溶于水的物质,可能是氢氧化镁或者是碳酸钙;向白色沉淀B中加入足量的稀盐酸,固体溶解得到无色溶液E,若无其他明显的现象,说明该白色沉淀B为氢氧化镁;将无色溶液A分别取样滴入酚酞,溶液变红,说明溶液呈碱性,可能是氢氧化钾或者是碳酸钠使得酚酞变红,另取样通入二氧化碳,得到白色沉淀D和无色溶液C;可知该白色沉淀D为碳酸钙;因此溶液中存在CaCl2,可得无色溶液A中没有Na2CO3;经过综合分析可得:
白色固体混合物含有KOH、MgCl2、CaCl2;而没有Na2CO3;代入验证可得推导正确。
【详解】
(1)在固体样品中加入足量水搅拌后,将固体和液体进行分离,因此操作Ⅰ是过滤,过滤操作必须用到的玻璃仪器有玻璃棒、烧杯和漏斗,其中玻璃棒的作用是引流;固体:
过滤;漏斗;引流
(2)往白色沉淀B中加入足量稀盐酸,沉淀全部溶解且无气泡产生,说明没有碳酸钙,因此只是氢氧化镁与盐酸的反应,其化学方程式为:
Mg(OH)2+2HCl=MgCl2+2H2O;故填:
Mg(OH)2+2HCl=MgCl2+2H2O
(3)取无色溶液A少量于试管中,通入CO2,得到无色溶液C和白色沉淀D,该步骤发生反应原理如下:
先是二氧化碳与氢氧化钾反应生成碳酸钾和水,再碳酸钾与氯化钙反应生成碳酸钙沉淀,发生的化学反应方程式为:
2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl;由于物质在溶液中以离子形式存在,可以形成不同的物质,因此溶液中存在氢氧化钙,也可以是氢氧化钙与二氧化碳反应生成碳酸钙和水,其化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O;故填:
2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl(或Ca(OH)2+CO2=CaCO3↓+H2O)
(4)由分析可得:
原白色固体中含有的物质是KOH、MgCl2、CaCl2。
故填:
KOH、MgCl2、CaCl2
8.已知A、B、C、D、E是初中化学中常见的不同类别的物质。
它们之间的关系如图所示(“→”表示物质间的转化关系,“﹣”表示两端的物质能发生化学反应)。
A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成分之一,其溶液为蓝色,F是由三种元素组成的化合物,请回答下列问题:
(1)写出化学式:
B_____,选择C作为食品干燥剂的原因有_____(答一条即可)。
(2)写出D转化为F的化学方程式_____。
(3)B在生产上的用途有_____,上述反应没有包含的基本反应类型是_____。
【答案】H2SO4价格低廉Na2CO3+Ca(OH)2=2NaOH+CaCO3↓金属除锈分解反应
【解析】
【分析】
A是使用最广泛的金属,A是铁;C是常用的食品干燥剂,C是氧化钙;E是配制波尔多液的主要成分之一,其溶液为蓝色,E是硫酸铜;Fe能和B反应,B在一定的条件下能生成硫酸铜,则B是硫酸;又已知A、B、C、D、E是初中化学中常见的不同类别的物质,氧化钙能和硫酸反应,在一定条件下生成D,D可能是氢氧化钙;氢氧化钙能在一定条件下生成F,F能和硫酸铜反应,则F可能是氢氧化钠。
【详解】
(1)Fe能和B反应,B在一定的条件下能生成硫酸铜,则B是硫酸,B是硫酸,化学式为
,选择C作为食品干燥剂的原因是价格低廉。
(2)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,化学方程式为:
。
(3)硫酸在生产上的用途有除锈;上述反应包括置换反应、化合反应、复分解反应,没有分解反应。
【点睛】
A是使用最广泛的金属,A是铁;C是常用的食品干燥剂,C是氧化钙;E是配制波尔多液的主要成分之一,其溶液为蓝色,E是硫酸铜;Fe能和B反应,B在一定的条件下能生成硫酸铜,则B是硫酸。
【参考答案】***试卷处理标记,请不要删除
一、选择题
二、中考化学推断题