铬铁的化学分析方法.docx
《铬铁的化学分析方法.docx》由会员分享,可在线阅读,更多相关《铬铁的化学分析方法.docx(13页珍藏版)》请在冰点文库上搜索。
铬铁的化学分析方法
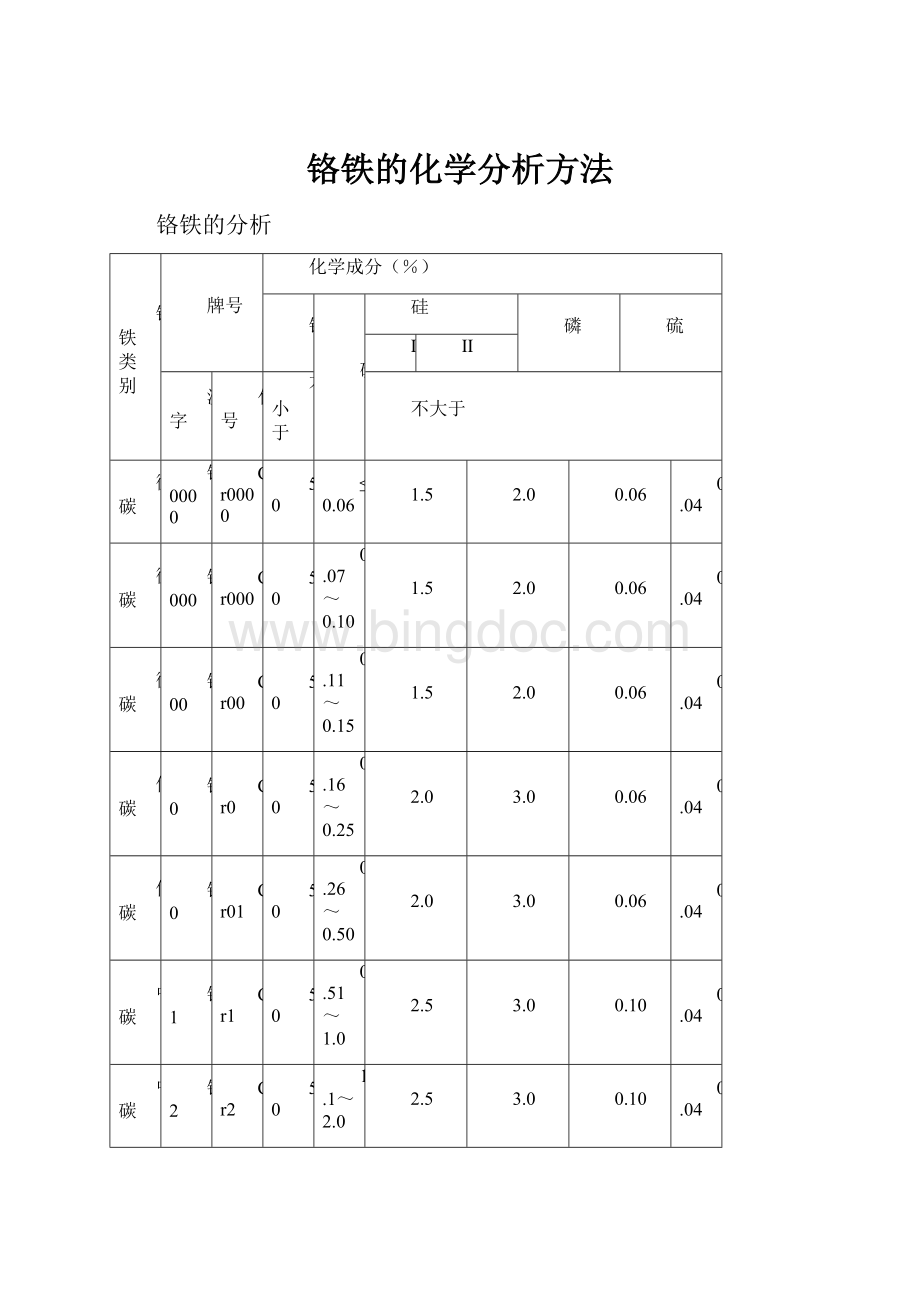
铬铁的分析
铬铁类别
牌号
化学成分(%)
铬
碳
硅
磷
硫
Ⅰ
Ⅱ
汉字
代号
不小于
不大于
微碳
铬0000
Cr0000
50
≤0.06
1.5
2.0
0.06
0.04
微碳
铬000
Cr000
50
0.07~0.10
1.5
2.0
0.06
0.04
微碳
铬00
Cr00
50
0.11~0.15
1.5
2.0
0.06
0.04
低碳
铬0
Cr0
50
0.16~0.25
2.0
3.0
0.06
0.04
低碳
铬0
Cr01
50
0.26~0.50
2.0
3.0
0.06
0.04
中碳
铬1
Cr1
50
0.51~1.0
2.5
3.0
0.10
0.04
中碳
铬2
Cr2
50
1.1~2.0
2.5
3.0
0.10
0.04
中碳
铬3
Cr3
50
2.1~4.0
2.5
3.0
0.10
0.04
碳素
铬4
Cr4
50
4.1~6.5
3.0
5.0
0.07
0.04
碳素
铬5
Cr5
50
6.6~9.0
3.0
5.0
0.07
0.07
高碳铬铁中Cr的测定(熔融法)
一、方法要点:
铬铁与过氧化钠共熔时,Cr已被氧化为高价,调至酸性后即可用硫酸亚铁铵滴定。
二、试剂:
1、过氧化钠:
固体
2、硫酸:
1+1
3、硫磷混酸:
加磷酸80ml于760ml水中,小心加入硫酸160ml。
冷却后混匀。
(共1000ml)
4、硫酸亚铁铵标液:
0.2N.称硫酸亚铁铵80g溶于5+95硫酸一升中。
5、N-苯基邻氨基苯甲酸指示剂:
2%.称0.2g溶于0.2%碳酸钠溶液100ml
三、分析方法:
称样0.2000g置于预先盛有4~5g过氧化钠的瓷坩埚中,搅拌均匀,上面覆盖2g过氧化钠。
先在电炉上加热熔融(黑色液体),再移入马弗炉650℃灼烧10分钟(最好加盖)。
取出冷却,置于盛有100ml热水的500ml烧杯中,用热水洗净坩埚,加热煮沸3~5分钟,冷却,用1+1硫酸中和至溶液从纯黄色变为橙色,继续加至清亮。
加硫磷混酸30ml,用0.2N硫酸亚铁铵标液滴定,接近终点时加指示剂3滴,继续滴定至由樱桃红色变为亮绿色为终点。
四、计算:
Cr%=【(NV)标液×0.01733×100】/G
五、注:
1、低碳铬铁用此法,试样熔解不好。
2、熔融温度不可超过650℃,否则逸出。
3、此方法也适用于氮化铬。
高碳铬铁中Cr的测定(酸溶法)
高碳铬铁由于碳化铬的性质特别稳定,所以不易溶解。
为了分解试样,一般采用过氧化钠熔融分解试样的方法。
近来也有采用焦硫酸钾、高氯酸、磷酸、硫酸混合湿熔体系分解试样的方法。
但这些方法都是用“熔”而非用“溶”的方法分解试样,因而在操作上有一定难度。
本文采用盐酸、磷酸、硫酸、硝酸进行高碳铬铁的湿法溶解。
一、分析步骤:
称取试样0.1000克置于500ml烧杯中,加入盐酸15ml温热浸泡30分钟,加入磷酸15ml,逐渐升温加热,蒸发至溶液液面平静,有轻微磷酸烟冒出后30秒。
取下放置片刻,加入硫酸10ml,加热蒸发至微冒三氧化硫白烟,滴加硝酸1~2ml氧化。
待氮氧化物黄烟消失后,继续蒸发冒三氧化硫白烟2分钟。
取下放置至温热,加入热水130ml,摇匀,加40g·L-1硫酸锰溶液2滴,25g·L-1硝酸银溶液10ml,加热煮沸。
加入250g·L-1过硫酸铵溶液20ml,煮沸氧化,待溶液冒大泡3~5分钟后,取下摇动,加入50g·L-1氯化纳溶液10ml,低温微沸15分钟,使氯化银沉淀凝聚下沉,溶液清澈。
取下流水冷却至室温。
用硫酸亚铁铵标液(0.1mol·L-1)滴定至浅黄绿色,加入2g·L-1N—苯代邻氨基苯甲酸溶液2滴,摇匀,继续滴定至亮绿色为终点。
二、注:
1、本法的独特之处在于采用盐酸温热浸泡。
在对比试验中,不经盐酸浸泡的试样很难溶解,而浸泡后的试样能完全溶解。
2、铬的适宜氧化酸度为【H+】=2.0~2.5mol·L-1.
本法加入硫酸10ml,并将氧化体积控制在180ml左右。
磷酸用量在8~20ml对测定结果无影响。
因容器较大,用量太少易使磷酸蒸发过量,形成焦磷酸盐使结果偏低,采用15ml。
3、一个需要探讨的问题是,当采用同样三个高碳铬铁标准样品绘制工作曲线时,用本法绘制的曲线斜率比用过氧化钠熔融法绘制的曲线斜率略大。
摘自《理化检验》2002.2
低碳铬铁中Cr的测定
——(过硫酸铵氧化、亚铁容量法)
一、试剂:
1、硫酸:
1+4
2、硝酸银:
1%
3、过硫酸铵:
30%
4、盐酸:
1+1
5、苯代邻位氨基苯甲酸:
0.2%。
称指示剂0.2g,碳酸钠0.2g,加税20ml,加热溶解,稀释至100ml.
6、硫酸亚铁铵:
0.1N.称硫酸亚铁铵40g溶于5+95硫酸一升中。
二、分析方法:
称样0.1g于500ml烧杯中,加(1+4)硫酸50ml,加热待试样全溶后,滴加硝酸(1+1)至碳化物分解完全,煮沸驱氮。
加热水100ml,硝酸银6ml,过硫酸铵30ml,硫酸锰3滴,煮沸5分钟。
加盐酸(1+1)5ml,继续煮2分钟至溶液清亮,取下冷却。
加浓磷酸10ml,用0.1N硫酸亚铁铵滴至淡黄色,加指示剂3滴,继续滴至亮绿色为终点。
三、计算:
Cr%=【(NV)标液×0.01733×100】/G
四、注:
1、加盖表面皿
2、指示剂加入量应与标定亚铁时相同
3、注意减钒
4、有些试样直接用浓磷酸溶解较容易
5、氮化铬用硫酸(1+1)溶时不时添加水,最好不要冒硫酸烟以防煮时溶液褪色。
加过硫酸铵煮时必须出现锰的紫红色,否则铬没有全部被氧化,必须再添加过硫酸铵5~10ml.
6、低碳铬铁也可用高氯酸冒烟氧化法。
称0.1g试样,加高氯酸10ml,氢氟酸少许,低温溶解氧化,再高温冒高氯酸烟出瓶口.立即取下,冷却,加硫磷混酸30ml,用硫酸亚铁铵滴定。
中碳铬铁中Cr的测定
———(过硫酸铵氧化、亚铁容量法)
一、方法要点:
试样以硫磷混酸溶解,硝酸银为催化剂,加过硫酸铵将三价铬氧化成六价铬,同时锰也被氧化成高锰酸。
加氯化钠形成氯化银,煮沸破坏高锰酸,使锰变为低价锰,铬仍为六价铬。
用硫酸亚铁铵标液滴定,但钒也被滴定。
二、试剂:
1、硫磷混酸:
将80ml磷酸(d=1.7)注入760ml水中,再将160mlH2SO4(d=1.84)徐徐加入。
2、氯化钠:
5%
3、硝酸银:
1%
4、过硫酸铵:
30%
5、苯代邻位氨基苯甲酸:
0.2%。
称指示剂0.2g,碳酸钠0.2g,加水20ml,加热溶解,稀释至100ml.
6、硫酸亚铁铵:
0.1N.称硫酸亚铁铵40g溶于5+95硫酸一升中。
三、分析方法:
称取试样0.2000g置于500ml三角瓶中,加硫磷混酸50ml,加热使试样溶解。
滴加硝酸氧化至滴入时不再发生气泡为止。
煮沸以除去氮氧化物,稀释至体积250ml,煮沸后加入1%的硝酸银溶液10ml,20%的过硫酸铵溶液20ml,加热煮沸至溶液呈红色,继续煮沸5分钟,加5%氯化钠溶液10ml,煮沸至红色消失,继续煮沸5~10min。
(此时溶液体积不应小于150ml)。
用流水冷却,以0.1N硫酸亚铁按标准溶液滴定。
接近终点时,加指示剂5滴,继续滴定由樱桃红色转变为亮绿色为止。
四、注:
1、试样未溶解完全以前,不要加入硝酸,以免因铬之钝化使试样不能完全溶解。
2、过量的过硫酸铵必须煮沸,使之充分分解。
3、硝酸银加入量以每10mg铬加2.5ml的(1%)硝酸银。
4、加入氯化钠后,瓶内要放5~6粒玻璃球,以防爆沸溶液溅出(也可用滤纸片)。
5、此方法也可用于低合金铸铁中铬的分析。
五、允许误差:
Cr%
误差范围
Cr%
误差范围
≤0.0
0.0035
5.0~10.0
0.10
0.05~0.10
0.005
10.0~14.0
0.12
0.10~0.50
0.015
14.0~18.0
0.15
0.50~1.0
0.030
18.0~24.0
0.17
1.0~5.0
0.050
铬铁中铬的测定
——高锰酸钾氧化、亚铁容量法
一、方法要点:
试样用盐酸溶解,以硫磷混酸冒烟驱除盐酸,然后用高锰酸钾将生成的三价铬氧化为高价,过量的高锰酸用氯化铵来破坏,最后用以苯代邻氨基苯甲酸作指示剂,用硫酸亚铁铵滴定。
二、试剂:
盐酸:
1+1
硫磷混酸:
60ml硫酸40ml磷酸相混合
高锰酸钾溶液:
5%
氯化铵溶液:
20%
指示剂溶液:
指示剂0.2克与碳酸钠0.2克溶于100ml热水中
硫酸亚铁铵标液:
0.1N
三、分析步骤:
称取试样0.1000g置于300ml三角瓶中,加入盐酸(1+1)10ml,加热待试样全溶后,加入硫磷混合酸12ml,继续加热至微冒硫酸白烟,以驱除盐酸,离火稍冷后加水50ml,高锰酸钾8ml,再加热至有棕色二氧化锰沉淀产生,加入氯化铵溶液30ml,继续加热至二氧化锰沉淀及红色高锰酸被还原(此时溶液呈桔黄色),再煮沸1分钟,离火流水冷却后,即用硫酸亚铁铵标准溶液滴定至试液呈淡黄色,然后加入指示剂3滴,继续滴定至试液由樱桃红色转变为亮绿色即为终点。
四、注意事项:
1、如含硅较高试样(硅铬合金)溶样时,可滴加氢氟酸,然后经硫磷混合酸冒烟驱氟。
一般微碳铬铁试样,可直接用15毫升硫磷混酸加5毫升水溶解,而不需冒烟处理。
2、冒烟时间不能太长,否则生成的硫酸盐不能溶解,使结果偏低。
3、硫磷混合酸不宜多加,否则在氯化铵还原锰时,部分铬也被还原,使结果偏低。
4、加入高锰酸钾溶液后,经加热二氧化锰沉淀一经生成,证明铬已全部氧化完全。
5、用氯化铵还原锰时,如虽经煮沸仍有部分锰未被还原,此时可再补加数滴氯化铵,否则由于锰未全部还原,使结果偏高。
铬铁中锰的测定
——高锰酸比色法
一、方法要点:
试样用高氯酸、盐酸溶解并冒烟后,铬已成高价状态,在一定的酸度中,在硝酸银存在下,用过硫酸铵将锰氧化为红色高锰酸,借此作为锰的比色测定。
高价铬的干扰用试液空白来抵消。
二、试剂:
盐酸:
1+1
混合酸:
称硝酸银2克于800ml水中,加硝酸100ml,磷酸50ml,硫酸50ml混匀。
过硫酸铵溶液:
30%
EDTA溶液:
5%
三、分析步骤:
称取试样50毫克于125ml三角瓶中,加入高氯酸3ml,盐酸(1+1)2ml,加热待试样全溶后,继续蒸发至高氯酸白烟冒出瓶口,稍冷,加入混合酸5ml,水5ml,过硫酸铵5ml,加热煮沸至红色高锰酸出现后再持续20秒,流水冷却,加水35ml摇匀,将此显色液倾入3cm比色皿中,于另一比色皿中加入EDTA一滴,然后倾入显色液,使高锰酸色泽褪色后以此为空白比色,测吸光度。
四、注意事项:
1、红色高锰酸生成后,应避免长时间煮沸,以防止其分解而使结果偏低。
2、加入EDTA后,高锰酸的褪色速度与温度有关,温度高褪色快,否则较
慢。
3、加入EDTA后,要在5分钟内比色完毕。
若放置时间过长将导致EDTA把铬络合,使结果偏高。
4、大量铬也可用盐酸高温时驱除,这样比色时可用水为空白
5、硅高时可加氢氟酸,再用高氯酸冒烟除氟。
铬铁中锰的测定
——过硫酸铵容量法:
一、试剂:
硫酸:
1+11+3碳酸钠溶液:
25%
过硫酸铵溶液:
10%氯化钠溶液:
1%
硝酸银溶液:
1.7%
氧化锌悬浮液:
氧化锌不能含有机物质,可按分析步骤检查其含锰量。
如氧化锌中有碳酸盐时,应先于700~800℃灼烧后使用。
硫磷混酸:
160毫升硫酸于760毫升水中,加磷酸80毫升。
亚砷酸钠—亚硝酸钠标准溶液:
0.05N
二、分析步骤:
称取试样1g置于500ml烧杯中,加硫酸(1+3)20ml,加热至试样全部溶解。
滴加硝酸氧化,煮沸2~3分钟以除去氮氧化物,徐徐加入25%的碳酸钠溶液至有少量铬和铁的沉淀析出。
然后滴加浓硝酸以溶解沉淀,继续加热,分次加入氧化锌悬浮液至瓶底有少量过剩的氧化锌为止。
然后将溶液加热至沸,此时如杯底无白粒残留,应再加入氧化锌少许,冷却至室温,转移到500ml容量瓶中,加水稀释到刻度,摇匀,用干滤纸将溶液过滤于干烧杯中。
吸取试液100ml置于250ml烧杯中,用硫酸(1+1)溶液酸化,加热蒸发至40ml,加硫磷混酸25ml,1.7%硝酸银)5ml,过硫酸铵溶液20ml。
加热微沸30~45秒,取下并静置2~3分钟,流水冷却至10~25℃,加1%氯化钠5ml,立即用0.05N亚砷酸钠—亚硝酸钠标准溶液滴定,当溶液呈淡红色时,每两滴相隔不得少于5~10秒,直到红色消失为终点。
铬铁中磷的测定
一、方法要点:
试样用高氯酸、盐酸溶解,在高氯酸冒烟的温度下,磷能定量地氧化成正磷酸,铬也同时被氧化成高价。
加入盐酸使大部分高价铬成氯化铬酰挥发,少量高价铬用亚硫酸钠还原成三价,然后用硝酸调节酸度,加入钼酸铵与磷生成黄色磷钼络离子,用氯化亚锡将磷钼络离子还原成磷钼蓝,借此作为磷的比色测定。
二、试剂:
钼酸铵—酒石酸钾钠—尿素溶液:
18%钼酸铵与18%酒石酸钾钠各50毫升相混匀,加入尿素2克。
氟化钠—氯化亚锡溶液:
称取氟化钠12克,氯化亚锡1克溶于500毫升水中。
三、分析步骤:
称取试样50毫克于150ml三角瓶中,加入高氯酸5ml,盐酸(1+1)10~15滴,加热待试样全溶后,继续蒸发至高氯酸白烟冒出瓶口30秒钟,此时溶液呈橙红色,趁热加入浓盐酸2ml,使铬成红棕色的氯化铬酰挥发,再加热使铬氧化,再加浓盐酸2ml,继续加热至冒烟近干,离火稍冷,加入硝酸(1+2)5ml,滴加亚硫酸钠溶液(10%)10滴以还原部分高价铬,再加热煮沸30秒,驱除氧化氮,离火迅速加入钼酸铵—酒石酸钾钠—尿素溶液5ml,氟化钠—氯化亚锡溶液20ml,水65ml,流水冲冷,以水作比较进行比色。
铬铁中硅的测定
一、分析步骤:
称取试样0.1g于100ml烧杯中,加硫酸(1+1)5ml,加热,在溶解过程中需经常加水,使其体积不被过度蒸发,以免硅脱水。
待试样全溶后,再加水10ml,过硫酸铵溶液(30%)2~3ml,煮沸至大气泡产生,离火稍冷后将试样移入塑料杯中,于预热至60~70℃的水浴中放置1分钟,然后边用塑料棒搅拌边滴加氢氟酸8~10滴,2分钟后加入硼酸液(5%)20ml,继续搅拌3分钟,将此液移入100ml量瓶中,用水稀释至刻度。
吸取10ml试液两份分别于150ml干燥的三角瓶中。
显色液:
加水20ml,钼酸铵5ml,于沸水浴中放30秒,流水冲冷后加入草酸液(5%)10ml,立即加硫酸亚铁铵(6%)5ml。
空白液:
加水20ml,草酸液(5%)10ml,钼酸铵5ml,硫酸亚铁铵(6%)5ml。
二、注意事项:
1、滴加氢氟酸,温度不得超过70℃,否则硅易生成四氟化硅挥发掉,使结果偏低。
2、加入硼酸后,搅拌时间不宜过短,否则氢氟酸不能完全与硼酸络合,使结果受到影响。
3、加入草酸后应立即加硫酸亚铁铵。
高碳铬铁中铬、硅、磷、锰的系统分析
Ⅰ试液溶液的制备
称取试样0.5000g于已盛有4~5g过氧化钠的铁坩埚中,用铁丝仔细搅匀后,在表面再铺1g过氧化钠,加盖,于酒精喷灯灯焰上小心加热熔融,并不时转动坩锅使熔融完全,再在灯焰上保持1~2分钟后离火,转动坩锅使熔融物分布均匀。
稍冷将坩锅与熔块一起置于400ml烧杯中,加入近沸热水80ml,待作用完毕后,用塑料棒将坩锅取出,并用热水洗净坩埚,然后将此液倾入已盛有100ml加热近沸的硫硝混酸(硫酸100ml,硝酸20ml,用水稀释至1升)中,用热水洗净塑料烧杯,再将试液加热煮沸1分钟,此时溶液清亮,离火加入尿素1克,滴加亚硝酸钠液(2%)至锰还原,流水冲冷,最后将试液移入250ml容量瓶中,用水稀释至刻度。
注意事项:
1、铁坩锅在使用前,应先在酒精喷灯灯焰上加热至发红,并立即抛入冷水中,使氧化铁皮脱掉,以免在试样熔融后浸出时产生大量的氧化铁皮。
2、熔块浸出时,一定用塑料烧杯,不能用玻璃烧杯,否则强碱浸蚀玻璃后对硅的测定引入干扰。
3、过氧化钠不能多加,以免在其分解时产生大量过氧化氢,使铬还原,结果偏低。
4、熔块需用热水浸出后再倾入加热近沸的硫硝混酸中酸化,如用冷水浸出并倾入冷硫硝混酸中酸化,则铬的结果偏低。
5、如有部分氧化铁皮用酸溶解不掉时,对测定无妨,移液时使用上层澄清液操作即可。
Ⅱ铬的测定
一、方法要点:
在碱性强氧化剂存在下,在熔融过程中,铬能从三价定量地氧化至六价,成为可溶性铬酸盐。
经酸化后生成的高价铬直接用硫酸亚铁铵还原
二、分析方法:
吸取试样溶液50ml于400ml烧杯中,加入硫磷混酸(160+80+760)25ml,水150ml,指示剂3滴,立即用硫酸亚铁铵标液滴定至溶液转为亮绿色为终点。
三、讨论:
1、磷酸的存在与铁生成磷酸铁的无色络合物,使滴定终点清晰。
2、由于试样在熔融后,滴加了亚硝酸钠,故锰对测定不干扰。
Ⅲ硅的测定
一、方法要点:
在微酸性溶液中,加入钼酸铵使形成硅钼络离子,然后用硫酸亚铁铵还原成硅钼蓝,借此作为硅的比色测定。
(显色时由于试液中六价铬的量不大于10毫克,故对硅钼络离子的形成无妨)。
二、分析方法:
吸取试液溶液5ml两份分别于150ml干燥的三角瓶中。
显色液:
加钼酸铵(5%)5ml,硫酸(1+99)5ml,于沸水浴中放30秒,流水冲冷后加入草酸液(5%)10ml,立即加硫酸亚铁铵(6%)10ml,水15ml,摇匀。
空白液:
加硫酸(1+99)5ml,草酸液(5%)10ml,钼酸铵5ml,硫酸亚铁铵(6%)5ml,水15ml,摇匀。
Ⅳ磷的测定
一、方法要点:
试样经强氧化剂熔融后,磷已成正磷酸状态,不需要再加任何氧化剂补充氧化,六价铬用亚硫酸钠还原成三价,其色泽用试液空白来抵消。
用硝酸调节酸度,然后加入钼酸铵与磷生成黄色磷钼络离子,用氯化亚锡将磷钼络离子还原成磷钼蓝,借此作为磷的比色测定。
二、分析方法:
吸取试液溶液25ml两份分别于150ml干燥的三角瓶中。
显色液:
加入硝酸(1+2)5ml,亚硫酸钠(10%)2ml,加热煮沸45秒离火,立即加入钼酸铵—酒石酸钾钠—尿素溶液5ml,氟化钠—氯化亚锡溶液20ml,水45ml。
空白液:
加入硝酸(1+2)5ml,亚硫酸钠(10%)2ml,摇至高价铬色泽褪去,加入氟化钠—氯化亚锡溶液20ml,水50ml。
Ⅴ锰的测定
一、方法要点:
在强碱性氧化剂熔融过程中,锰也从二价氧化成六价,成为可溶性的锰酸盐。
由于在酸化时没有催化剂和磷酸的存在,因此部分锰被转化为二氧化锰,使结果偏低。
故在制备试样溶液时,加入亚硝酸钠使锰全部还原为二价,然后在有催化剂硝酸银存在下,用过硫酸铵再将锰全部氧化为高价,高价铬的干扰用空白来抵消。
磷酸的存在能使铁生成磷酸铁的无色络合物,从而避免黄色高价铁的影响,同时有磷酸的存在,可以防止在氧化过程中产生二氧化锰沉淀,另一方面还可增加高锰酸色泽的稳定。
二、分析方法:
吸取试液溶液25ml于125ml干燥的三角瓶中,加入混酸【800+100(硝)+50(磷)+50(硫)+2克硝酸银】5ml,过硫酸铵溶液5ml,加热煮沸至红色高锰酸出现后再持续15秒,流水冲冷,加水15ml摇匀。
空白液加EDTA液即可(一滴)。