13陌生情景中化学方程式的书写.docx
《13陌生情景中化学方程式的书写.docx》由会员分享,可在线阅读,更多相关《13陌生情景中化学方程式的书写.docx(16页珍藏版)》请在冰点文库上搜索。
13陌生情景中化学方程式的书写
陌生情景中化学方程式(或离子方程式)的书写
问题:
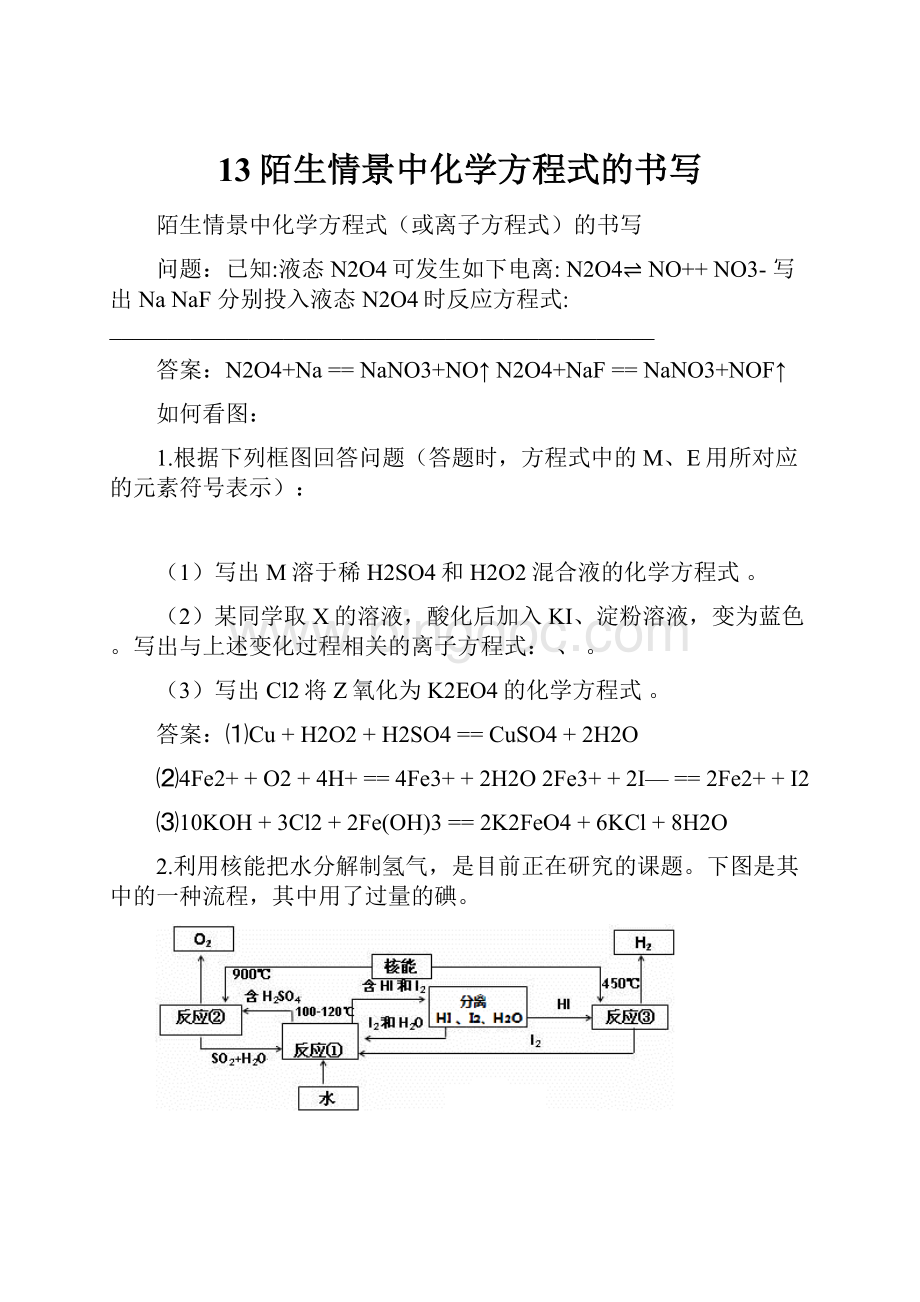
已知:
液态N2O4可发生如下电离:
N2O4⇌NO++NO3-写出NaNaF分别投入液态N2O4时反应方程式:
_______________________________________________
答案:
N2O4+Na==NaNO3+NO↑N2O4+NaF==NaNO3+NOF↑
如何看图:
1.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式:
、。
(3)写出Cl2将Z氧化为K2EO4的化学方程式。
答案:
⑴Cu+H2O2+H2SO4==CuSO4+2H2O
⑵4Fe2++O2+4H+==4Fe3++2H2O2Fe3++2I—==2Fe2++I2
⑶10KOH+3Cl2+2Fe(OH)3==2K2FeO4+6KCl+8H2O
2.利用核能把水分解制氢气,是目前正在研究的课题。
下图是其中的一种流程,其中用了过量的碘。
完成下列反应的化学方程式:
反应①______________;反应②______________________。
此法制取氢气的最大优点是_____________________________。
答案:
反应①SO2+O2+2H2O
2HI+H2SO4
反应②2H2SO4
2SO2↑+O2↑+2H2O SO2和I2 可循环使用,无污染
一、分类及书写要点
题型1氧化还原反应型的化学方程式和离子方程式的书写
第1步:
找氧化剂、还原剂,氧化产物、还原产物;
根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
注意:
不属于“氧化剂、还原剂、氧化产物、还原产物”的物质这一步暂不写在方程式中。
氧化剂、还原剂,氧化产物、还原产物判定
(1)已有知识
(2)试题给定(3)结合试题信息判定(4)熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物
氧化剂
Cl2
O2
H2SO4(浓)
HNO3
KMnO4(H+)、MnO2
Fe3+
KClO3
ClO-
H2O2
还原产物
Cl-
O2-
SO2
NO,NO2
Mn2+
Fe2+
Cl-
H2O
还原剂
I-
S2-(H2S)
CO、C
Fe2+
NH3
SO2、SO
H2O2
氧化产物
I2
S
CO2
Fe3+
NO、N2
SO42-
O2
第2步:
电荷守恒
判定溶液的酸碱性;根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
“补缺”的技巧
(1)可能出现的情况:
H+→H2O(酸性)、OH-→H2O(碱性)、
H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)
(2)绝不可能出现的情况:
H+→OH-或者OH-→H+
第3步:
根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
1.铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式:
答案:
⑴Cu+H2O2+2H+==Cu2++2H2O
2.将20mL0.5mol·L-1K2SO3溶液逐滴加入到20mL0.2mol·L-1KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。
写出反应的离子方程式:
________________________________
答案:
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+2H2O
3.二氧化硫通入硝酸钡溶液离子方程式
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+4H++2NO↑
4.MnO2与FeCl3·6H2O共热可发生反应,产物中Fe2O3与MnCl2物质的量之比为1:
1,则反应为:
_______________________________________。
MnO2+2FeCl3•6H2O
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
4.已知:
CuO易溶于浓氨水
Cu2O
[Cu(NH3)4]+(无色)
[Cu(NH3)4]2+(蓝色),则Cu2O在浓氨水中溶解得蓝色溶液的离子方程式为________________________;
2Cu2O+16NH3•H2O+O2=4[Cu(NH3)4]2++8OH-+12H2O
5.(2008·全国Ⅰ,26.有删改)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:
软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。
试回答:
(1)软锰矿制备K2MnO4的化学方程式;
(2)K2MnO4制备KMnO4的离子方程式是;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是。
(1)3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O.
(2)3MnO42-+4H+=MnO2↓+2MnO4-+2H2O
(4)2KMnO4+8H2SO4+5Na2C2O4
2MnSO4+K2SO4+10CO2↑+5Na2SO4+8H2O
6.(2013全国
27.节选)锂离子电池的应用很广,其正极材料可再生利用,某锂离子电池正极材料有钴酸锂(LiCoO2)导电剂乙炔黑和铝箔等。
充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。
现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(1)LiCoO2中,Co元素的化合价为。
(2)写出“正极碱浸”中发生反应的离子方程式。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式;可用盐酸代替H2SO4和H2O2的混合液,但缺点是。
答案:
(1)+3
(2)2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
(3)2LiCoO2+3H2SO4+H2O2
Li2SO4+2CoSO4+O2↑+4H2O
2H2O2
2H2O+O2↑;有氯气生成,污染较大
7.(2013全国)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
提示:
在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为
_________________________________________________________。
答案:
Fe2+和Mn2+(2分)
MnO4-+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+(2分)
3Mn2++2MnO4-+2H2O===5MnO2↓+4H+(2分)
8.(2015全国)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 2:
1 .
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
2电解时发生反应的化学方程式为 NH4Cl+2HCl
3H2↑+NCl3.
②溶液X中大量存在的阴离子有____________________
答案:
Cl—、OH—.(此步反应方程式为:
NCl3+6NaClO2+3H2O=6ClO2+NH3+3NaOH+3NaCl)
9.(2013•福建)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
氯化钠电解法是一种可靠的工业生产ClO2方法。
该法工艺过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
生产过程如图:
2NaClO3+4HCl==2ClO2↑+Cl2↑+2NaCl+2H2O
10.(2013江苏)氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(2)加入H2O2氧化时,发生反应的化学方程式为__2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O
11.(2014南京模拟)次氯酸盐氧化法。
工艺流程如图所示。
工业上经常用次氯酸盐氧化FeCl3制取高铁酸盐。
完成“氧化”过程中反应的离子方程式:
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
12.(2014·北京高考26改编)NH3经一系列反应可以得到HNO3和NH4NO3。
(1)请写出N2O4与O2、H2O化合的化学方程式_______________。
(2)用电解NO的方法可以制备NH4NO3,其工作原理如图所示。
为使电解产物全部转化为NH4NO3,需补充A。
A是____ ,请结合电解的化学方程式说明理由____________ _。
请写出阴、阳两极的电极方程式
答案:
(1)2N2O4+O2+2H2O==4HNO3
(2)NH3 由反应8NO+7H2O
3NH4NO3+2HNO3知电解产生的HNO3多。
阳极:
NO-3e-+2H2O==NO+4H+
阴极:
NO+5e-+6H+==NH4++H2O
13.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为______
____溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
阳极的电极反应式为_____________。
电解后,__________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000mol·L−1的碘标准液滴定至终点,消耗10.00mL。
滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。
【答案】
(1).2NaHSO3=Na2S2O5+H2O
(2).NaHSO3(3).得到NaHSO3过饱和溶液(4).2H2O-4e-=4H++O2↑(5).a(6).S2O52-+2I2+3H2O=2SO42-+4I-+6H+(7).0.128
题型2非氧化还原型方程式和离子方程式的书写
非氧化还原型方程式和离子方程式的书写以复分解反应为要,其形式为相互交换成份,交换原则是正找负、负找正,进行等价交换,特别注意复分解反应的动力是生成难溶、难电离或挥发生的物质。
1.(2013全国)
写出“沉钴”过程中发生反应的化学方程式CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+H2O+CO2↑
2.制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
TiCl4水解生成TiO2·xH2O的化学方程式为
TiCl4+(x+2)H2O
TiO2·xH2O↓+4HCl
3.化合物SOCl2是一种液态化合物,沸点为77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有大量白雾,并有刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于稀HNO3的凝乳状白色沉淀产生(提示:
H2SO3是一种中强酸,HSO3-的酸性强于HCO3-的酸性).根据上述实验,写出以下反应的化学方程式:
(1)SOCl2和水反应SOCl2+H2O=SO2↑+2HCl↑
(2)SOCl2和足量氢氧化钠溶液反应__SOCl2+4NaOH=Na2SO3+2H2O+2NaCl
(3)SOCl2和足量碳酸钠溶液反应SOCl2+4Na2CO3=Na2SO3+2NaCl+4NaHCO3
4.SiCl4溶解在NaOH溶液中生成水玻璃的化学方程式:
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
5.(2015全国I)硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式
Mg2B2O5·H2O+2H2SO4
2MgSO4+2H3BO3
(2)“净化除杂”需先加H2O2溶液,作用是将Fe2+氧化为Fe3+;然后在调节溶液的pH约为5,目的是使Al3+与Fe3+形成氢氧化物沉淀而除去。
(3)“粗硼酸”中的主要杂质是(七水)硫酸镁(填名称)。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
。
(5)单质硼可用于生成具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程
2H3BO3
B2O3+3H2OB2O3+3Mg
3MgO+2B
6.(2015浙江)化合物甲和NaAlH4都是重要的还原剂。
一定条件下金属钠和H2反应生成甲。
甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。
将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式___NaH__。
(2)甲与AlCl3反应得到NaAlH4的化学方程式4NaH+AlCl3==NaAlH4+3NaCl____
(3)NaAlH4与水发生氧化还原反应的化学方程式NaAlH4+2H2O==NaAlO2+4H2↑
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式3NaH+Fe2O3==2Fe+3NaOH
题型3氧化还原加复分解式
此类反应在发生氧化还原的同时,还伴随有成份的相互交换
1.铬铁矿主要成分为FeO•Cr2O3,还含有杂质Al2O3.一般铬铁矿中Cr2O3质量分数约为40%.由铬铁矿制备重铬酸钾的方法如下:
写出焙烧过程方程式:
____________________________________________________
14FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
2Na2CO3+Al2O3=2NaAlO2+CO2↑;
写出操作Ⅲ方程式:
Cr2O72-+H2O⇌2CrO42-+2H+
2.将氯气和空气(不参与反应)以体积比约1:
3混合通入含水8%的碳酸钠中制备Cl2O
写出反应方程式:
_________________________________________________
2Cl2+Na2CO3═Cl2O+2NaCl+CO2或2Cl2 +2Na2CO3+H2O═Cl2O+2NaHCO3+2NaCl
3.[2017·全国卷Ⅰ,27.(6)]
写出“高温煅烧②”中由制备的化学方程式____________。
2FePO4+Li2CO3+H2C2O4
2LiFePO4+H2O↑+3CO2↑
二、练习:
1.(2014·江苏高考16改编)烟气脱硫能有效减少二氧化硫的排放。
实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。
粉煤灰用硫酸溶液酸浸后过滤,在滤液中加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。
若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是 (用离子方程式表示)。
答案:
3CaCO3+2Al3++3SO42-+3H2O==2Al(OH)3+3CaSO4+3CO2↑
2.(2014·广东高考32改编)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺流程(略)。
(1)该初级石墨与氯气高温反应后,其中氧化物杂质均转变为相应的氯化物,由氯化物中的某物质得到水玻璃的化学反应方程式为______________ 。
(2)上述金属氯化物加入过量的NaOH溶液充分反应后所得的溶液中加入乙酸乙酯并加热,可生成白色沉淀,请写出生成沉淀的离子方程式__________。
答案:
(1)SiCl4+6NaOH==Na2SiO3+4NaCl+3H2O
(2)AlO2-+CH3COOH+H2O==Al(OH)3↓+CH3COO-
3.(2014·安徽高考27改编)LiPF6锂离子电池中广泛应用的电解质。
某工厂用LiF、PCl5原料,低温反应制备LiPF6。
该流程需在无水条件下进行,是由于PF5易水解,其产物为两种酸。
请写出PF5水解的化学方程式:
____ _。
答案:
PF5+4H2O==H3PO4+5HF
4.(2014·安徽高考25改编)
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。
在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是___________________。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。
写出该反应的离子方程式_________________ 。
答案:
(1)4CuCl(s)+O2(g)==2CuCl2(s)+2CuO(s)△H=﹣176.6kJ·mol-1
(2)2ClO2-+Cl2==ClO2+2Cl-
5.(2014·海南高考13改编)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为___________________________。
答案:
2NaOH+(CN)2==NaCN+NaCNO+H2O
6.(2014·天津高考9节选)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________。
答案:
S2O32-+4Cl2+5H2O==2SO42-+8Cl-+10H+
7.(2014·天津高考7节选)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。
写出该反应的化学方程式_______________________________。
答案:
4KClO3
KCl+3KClO4
8.(2014·天津高考10节选)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。
一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式____________________________。
答案:
2NH4HS+O2==2S↓+2NH3·H2O
9.(2014·四川高考8改编)X、Y、R为前四周期元素,且原子序数依次增大。
XY2是红棕色气体;X与氢元素可形成XH3;R2+离子的3d轨道中有9个电子。
请回答下列问题:
将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是 。
答案:
2Cu+8NH3·H2O+O2==2[Cu(NH3)4]2++4OH-+6H2O
10.[2016·江苏,20(3)]一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)
,其离子方程式为_______________________________。
(2)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
回答下列问题:
①H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
______________________。
②加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为CrO42-,写出该反应的离子方程式_________________________________________。
③写出上述流程中用SO2进行还原时发生反应的离子方程式:
_______________________。
(3)酸性环境中,纳米Fe/Ni去除NO
分两步,将步骤ⅱ补充完整:
ⅰ.NO3-+Fe+2H+===NO-+Fe2++H2O;
ⅱ.
________+
________+
H+===
Fe2++
________+
________。
(1) 2Fe2++BH
+4OH-===2Fe+B(OH)
+2H2↑
(2)①2Cr3++3H2O2+H2O===Cr2O
+8H+
②Cr2O
+2OH-===2CrO
+H2O
③2CrO
+3SO2+12H2O===2Cr(OH)(H2O)5SO4↓+SO
+2OH-
(3)1 NO
3 Fe 8 3 1 NH
2 H2O