硅的基本性质Word文档格式.docx
《硅的基本性质Word文档格式.docx》由会员分享,可在线阅读,更多相关《硅的基本性质Word文档格式.docx(64页珍藏版)》请在冰点文库上搜索。
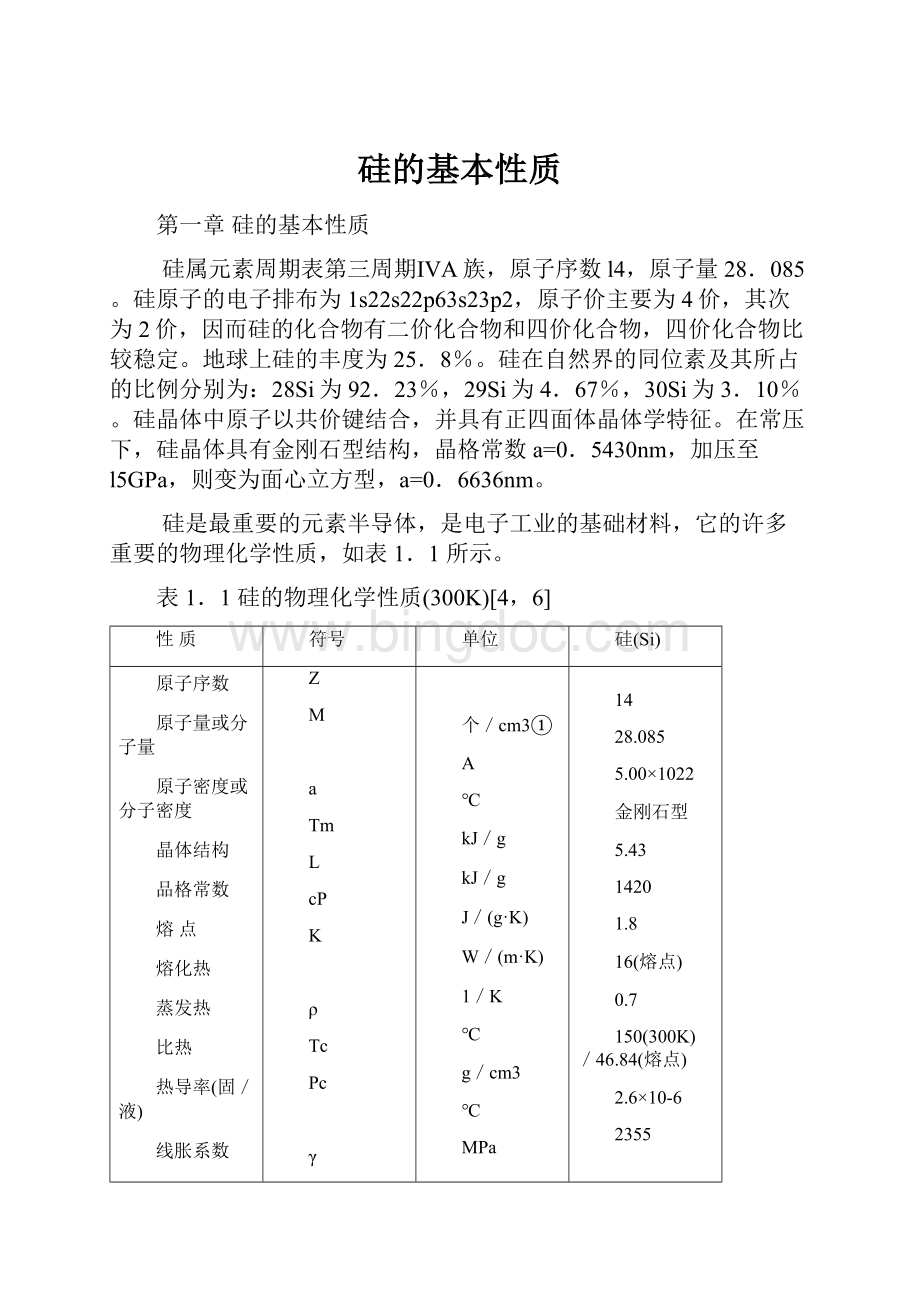
℃
kJ/g
J/(g·
K)
W/(m·
1/K
g/cm3
MPa
N/cm
mN/m
m2/N
14
28.085
5.00×
1022
金刚石型
5.43
1420
1.8
16(熔点)
0.7
150(300K)/46.84(熔点)
2.6×
10-6
2355
2.329/2.533
4886
53.6
6.5/950
C11:
16.704×
106
C12:
6.523×
C44:
7.957×
736(熔点)
脆性
3.87
0.98×
l0-11
①本书中关于分子、原子、离子密度、浓度的单位简写为cm-3或cm-2。
续表
磁化率
德拜温度
介电常数
本征载流子浓度
本征电阻率
电子迁移率
空穴迁移率
电子有效质量
空穴有效质量
电子扩散系数
空穴扩散系数
禁带宽度(25℃)
导带有效态密度
价带有效态密度
器件最高工作温度
χ
θD
ε0
ni
ρi
μn
μp
mn﹡
mp﹡
Dn
Dp
Eg(△We)
Nc
Nv
厘米-克-秒电磁制
个/cm3
Ω·
cm
cm2/(V·
s)
g
cm2/s
eV
cm-3
-0.13×
650
11.9
1.5×
1010
2.3×
l05
1350
480
mn﹡‖=0.92m0
mn﹡⊥=0.19m0(1.26K)
mh﹡p=0.59m0
ml﹡p=0.16m0(4K)
34.6
12.3
1.11
2.8×
1019
1.04×
250
1.1硅的基本物理和化学性质
1.1.1硅的电学性质
半导体材料的电学性质有两个十分突出的特点,一是导电性介于导体和绝缘体之间,其电阻率约在10-4~1010Ω·
cm范围内;
二是电导率和导电型号对杂质和外界因素(光、热、磁等)高度敏感。
无缺陷半导体的导电性很差,称为本征半导体。
当掺入极微量的电活性杂质,其电导率将会显著增加,例如,向硅中掺入亿分之一的硼,其电阻率就降为原来的千分之一。
当硅中掺杂以施主杂质(v族元素:
磷、砷、锑等)为主时,以电子导电为主,成为N型硅;
当硅中掺杂以受主杂质(Ⅲ族元素:
硼、铝、镓等)为主时,以空穴导电为主,成为P型硅。
硅中P型和N型之间的界面形成PN结,它是半导体器件的基本结构和工作基础。
硅和锗作为元素半导体,没有化合物半导体那样的化学计量比问题和多组元提纯的复杂性,因此在工艺上比较容易获得高纯度和高完整性的Si、Ge单晶。
硅的禁带宽度比锗大,所以相对于锗器件而言硅器件的结漏电流比较小,工作温度比较高(250℃)(锗器件只能在150℃以下工作)。
此外,地球上硅的存量十分丰富,比锗的丰度(4×
10-4%)多得多。
所以,硅材料的原料供给可以说是取之不尽的。
60年代开始人们对硅作了大量的研究开发,在电子工业中,硅逐渐取代了锗,占据了主要的地位。
自1958年发明半导体集成电路以来,硅的需求量逐年增大,质量也相应提高。
现在,半导体硅已成为生产规模最大、单晶直径最大、生产工艺最完善的半导体材料,它是固态电子学及相关的信息技术的重要基础。
但硅也存在不足之处,硅的电子迁移率比锗小,尤其比GaAs小。
所以,简单的硅器件在高频下工作时其性能不如锗或GaAs高频器件。
此外,GaAs等化合物半导体是直接禁带材料,光发射效率高,是光电子器件的重要材料,而硅是间接禁带材料,由于光发射效率很低,硅不能作为可见光器件材料。
如果现在正在进行的量子效应和硅基复合材料等硅能带工程研究成功,加上已经十分成熟的硅集成技术和低廉价格的优势,那么硅将成为重要的光电子材料,并实现光电器件的集成化。
1.1.2硅的化学性质
硅在自然界以氧化物为主的化合物状态存在。
硅晶体在常温下化学性质十分稳定,但在高温下,硅几乎与所有物质发生化学反应。
硅容易同氧、氮等物质发生作用,它可以在400℃与氧、在1000℃与氮进行反应。
在直拉法制备硅单晶时,要使用超纯石英坩埚(SiO2)。
石英坩埚与硅熔体反应:
反应产物SiO一部分从硅熔体中蒸发出来,另外一部分溶解在熔硅中,从而增加了熔硅中氧的浓度,是硅中氧的主要来源。
在拉制单晶时,单晶炉内须采用真空环境或充以低压高纯惰性气体,这种工艺可以有效防止外界沾污,并且随着Si0蒸发量的增大而降低熔硅中氧的含量,同时,在炉腔壁上减缓SiO沉积,以避免SiO粉末影响无位错单晶生长。
硅的一些重要的化学反应式如下:
(1.2)式前两个反应是硅平面工艺中在硅表面生成氧化层的热氧化反应,后两个反应常用来制造高纯硅的基本材料——SiCl4和SiHCl3。
二氧化硅十分稳定,这一特点使得SiO2膜在器件工艺中起着极为重要的作用。
PN结受到SiO2膜的保护提高了器件的可靠性。
在平面工艺中,SiO2膜是MOSFET器件结构的组成部分;
在扩散工艺中成为有效的掩蔽层。
由于SiO2膜容易热氧化生成以及可以通过化学腐蚀选择性去除,因此,能够使用光刻方法实现器件小型化,使精细结构变成现实。
硅对多数酸是稳定的。
硅不溶于HCl、H2SO4、HNO3、HF及王水。
但硅却很容易被HF—HNO3混合液所溶解。
因而,通常使用此类混合酸作为硅的腐蚀液,反应式为
HNO3在反应中起氧化剂作用,没有氧化剂存在,HF就不易与硅发生反应。
HF加少量铬酸酐CrO3的溶液是硅单晶缺陷的择优腐蚀显示剂。
硅和稀碱溶液作用也能显示硅中缺陷。
硅和NaOH或KOH能直接作用生成相应的硅酸盐而溶于水中:
硅与金属作用能生成多种硅化物。
TiSi2,WSi2,MoSi2等硅化物具有良好的导电、耐高温、抗电迁移等特性,可以用于制备集成电路内部的引线、电阻等元件。
1.1.3硅的光学和力学性质
1.硅的光学性质
硅在室温下的禁带宽度为1.1leV,光吸收处于红外波段。
人们利用超纯硅对1~7μm红外光透过率高达90%~95%这一特点制作红外聚焦透镜。
硅的自由载流子吸收比锗小,所以其热失控现象较锗好。
硅单晶在红外波段的折射率为3.5左右,其两个表面的反射损耗略小于锗(大于45%),通常在近红外波段镀SiO2或Al2O3,在中红外波段镀ZnS或碱卤化合物膜层作为增透膜。
硅是制作微电子器件和集成电路的主要半导体材料,但作为光电子材料有两个缺点:
它是间接带隙材料,不能做激光器和发光管;
其次它没有线性电光效应,不能做调制器和开关。
但用分子束外延(MBE)、金属有机化学气相沉积(MOCVD)等技术在硅衬底上生长的SiGe/Si应变超晶格量子阱材料,可形成准直接带隙材料,并具有线性电光效应。
此外,在硅衬底上异质外延GaAs或InP单晶薄膜,可构成复合发光材料。
2.硅的力学和热学性质
室温下硅无延展性,属脆性材料。
但当温度高于700℃时硅具有热塑性,在应力作用下会呈现塑性形变。
硅的抗拉应力远大于抗剪应力,所以硅片容易碎裂。
硅片在加工过程中有时会产生弯曲,影响光刻精度。
所以,硅片的机械强度问题变得很重要。
抗弯强度是指试样破碎时的最大弯曲应力,表征材料的抗破碎能力。
测定抗弯强度可以采用“三点弯”方法测定,也有人采用“圆筒支中心集中载荷法”测定和“圆片冲击法”测定。
可以使用显微硬度计研究硅单晶硬度特性,一般认为目前大体上有下列研究结果:
①硅单晶体内残留应力和表面加工损伤对其机械性能有很大影响,表面损伤越严重,机械性能越差。
但热处理后形成的二氧化硅层对损伤能起到愈合“伤口”的作用,可提高材料强度。
②硅中塑性形变是位错滑移的结果,位错滑移面为{111}面。
晶体中原生位错和工艺诱生位错及它们的移动对机械性能起着至关重要的作用。
在室温下,硅的塑性变形不是热激发机制,而是由于劈开产生晶格失配位错造成的。
⑧杂质对硅单晶的机械性能有着重要影响,特别是氧、氮等轻元素的原子或通过形成氧团及硅氧氮络合物等结构对位错起到“钉扎”作用,从而改变材料的机械性能使硅片强度增加。
硅在熔化时体积缩小,反过来,从液态凝固时体积膨胀。
正是由于这个因素,在拉制硅单晶结束后,剩余硅熔体凝固会导致石英坩埚破裂。
熔硅有较大的表面张力(736mN/m)和较小的密度(2.533g/cm3)。
这两个特点,使得棒状硅晶体可以采用悬浮区熔技术生长,既可避免石英坩埚沾污,又可多次区熔提纯和拉制低氧高纯区熔单晶。
相比之下,锗的表面张力很小(150mN/m),密度较大(5.323g/cm3),所以,通常只能采用水平区熔法。
硅的热学和力学参数见表1.1。
1.1.4硅的相图
相图是一个多组元系统的平衡状态图。
通过相图,可以直观地了解到材料的元素组成、化合物形成条件及熔化温度、合金的熔化和凝固温度的范围、固熔体的溶解度、体系可能存在的相、各种相的组成、相对数量、平衡分凝系数等,所以硅的相图十分重要。
在半导体硅的制备中,从多晶硅熔化成熔硅再拉制成硅单晶的过程属于相变过程,涉及到硅中杂质分凝,以及硅中杂质固溶度等问题。
在外延工艺中,通常采用气相外延,或液相外延。
为了生长出优质外延层,需要相图知识的帮助。
同样,在器件制造工艺过程中,也常常遇到物质在不同相之间的平衡和相互转变的问题。
关于相图的理论阐述见第三章,在这里仅列出几种在半导体硅材料制备和器件制造工艺中比较重要的硅相图。
图l.1为铝一硅相图,图l.2为金一硅相图,而图1.3为锑一硅
相图。
1.2硅的晶体结构与表面结构
半导体材料的性能与它们的结构及成分密切相关。
研究半导体材料的结构主要有两个途径,一是能带论,它是从晶体结构的长程周期性来研究材料的电子能态结构;
二是化学键理论,它是从物质的化学组成,晶体结构等短程序来研究材料的原子结构。
这两种理论是研究半导体材料的主要理论。
1.2.1化学键
化学键是指晶体或分子中两个或多个原子(或离子)之间的相互作用力。
依赖这种作用,原子、离子或分子相互结合组成各种物质。
化学键有各种不同类型,即离子键、共价键、金属键、范德瓦尔斯键和氢键等。
它们的构造及特性列于表l.2。
表1.2化学键的构造及其物理性质[7]
名称
键的结构
键的强度
力学性质
热学性质
电学性质
光学性质
离子键
带电离子间静
电吸引,无方向性,
无饱和性,正、负离
子间具有较大的配
位数
中强、强,
取决于离子的
电荷和离子间
的距离
可具有各
种硬度和中、
小压缩率
熔点高,
膨胀系数小,
可具有中、小
热延展性,熔
融态是离子
中等绝缘
体,熔融态导
电
光吸收和
折射基本上与
单个离子相同
共价键
两个原子共有
电子对,有方向性
和饱和性,原子具
有较低的配位数
取决于原子的
电子组态和原
子间距
各种硬
度,中、小压缩
率
中、小热延展
性,熔体内为
分子
固态是绝
缘体或半导体
具有高折
射率,溶液和
晶体对光的吸
收各不相同
金属键
自由电子形成
“电子气”弥散在晶
体的阳离子之间,
无方向性,无饱和
性,配位数高
可具有不
同的强度,取
决于键的电子
数和原子间距
度,常发生滑
移
熔点不
同,中、小热延
展性
导体
不透明,
反射率大,有
金属光泽,物
性与熔体的相
近
范德瓦
尔斯键
由于分子并置
引起感应偶极而产
生的力,无方向性,
分子内多为共价键
弱,键力
随原子或分子
的大小而变化
硬度极
小,压缩率大
熔点低,
热延展性大,
膨胀系数大,
熔体内为分子
绝缘体,
熔体不导电
其性质为
各分子叠加性
质,与汽态或
溶液性质相近
氢键
系H+离子介
于两个高电负性离
子间产生的力,有
方向性与饱和性
弱
硬度小
熔点低
溶液导电
改变光谱
特性
在半导体材料的化学键中,占优势的是共价键(有时也含有一定的离子键成分)。
硅晶体中的化学键是典型的共价键。
共价键是通过价电子的共有化形成的,每个原子都与周围的原子形成四个等同的共价键。
而硅原子的电子构型是ls2、2s2、2p6、3s2、3p1x、3ply,只有两个未成对的价电子,根据自旋方向相反的价键电子才能配对生成共价键的理论,则每个硅原子只能和最近邻原子形成两个共价键,但实际上却是四个共价键。
为此,鲍林(L.Pauling)和斯莱脱(Slater)等人提出了杂化轨道理论。
该理论认为:
在组成晶体或分子时,原子本身的势场受到周围原子的影响而产生微扰,使硅原子
的3s轨道与3p轨道简并化,即能量等同化,并线性组合成新的轨道函数。
这些简并态的任何线性组合也是这一体系的允许状态。
杂化成的轨道函数很多,但通过正交归一化条件,只有四个轨道才能确立。
以金刚石(碳晶体)为例,碳的电子构型为ls2、2s2、2p2,其中,2s轨道和2p轨道产生简并,由原来的轨道波函数线性组合成新的轨道函数:
作为近似,只考虑角函数部分,则
这样得到新的轨道函数ψi称为sp3杂化轨道。
由于化学键的稳定性与成键原子间电子云的重叠程度有关,所以把轨道函数中的角函数部分的最大值定义为成键能力,并将ψ2s的成键能力定为1,因此,ψ2p的成键能力都是
。
杂化轨道理论将表明,由s、p轨道组成的杂化轨道具有远大于s和p轨道的平均成键能力。
杂化轨道除了方向差别外,电子云分布完全相同,所以杂化轨道也称为等性轨道。
对sp3杂化轨道ψ2s具有球对称性,对四个杂化后的等性轨道ψi作出相同的贡献,即ai2=1/4。
‘±
根据ψ2px、ψ2py、ψ2pz的对称性,可以把杂化轨道ψ1写成
由于ai=1/2,从归一化条件可得出
所以
由波函数的正交归一化条件,可知ψi的系数以ai、bi、ci、di之间存在以下关系,
则求出四个杂化轨道ψi的具体形式为:
sp3杂化时坐标系(O点在立方体中心)如图l.4所示。
沿(111)方向有cosθ=1/
,sinθ=
/
,cosφ=sinφ=1/
,所以ψ2px、ψ2py、ψ2pz均为正值。
则ψ1在(111)方向上成键能力为
因而超过了ψ2s(=1)及ψ2p(=1.7321)的成键能力。
可以证明,ψ1在(
1),(1
),(
1
)方向上与ψ1(111)有相同的成键能力。
这表明,共价键不仅有饱和性,即共价键具有确定的数目,比如sp3杂化形成4个共价键,此外还有方向性,即原子只能在特定方向上形成共价键。
硅原子的四个sp3杂化轨道是等同的,各含有l/4s和3/4p成分。
它们两两之间的夹角为109°
28’。
所以,它们的对称轴必须指向正四面体的四个顶角,如图l.5所示。
共价键的强弱取决于成键原子间电子云重叠程度。
重叠愈多,共价键愈强。
因此,硅原子结合时的4个共价键取四面体顶角方向,如图1.6所示。
其中圆球表示硅原子,圆球间的棒表示共价键。
它们两两之间的夹角都是109°
这就决定了硅晶体必为金刚石型结构。
金刚石型结构的基本特点是每个原子有4个最近邻原子,它们都处于正四面体顶角方向上,如图l.7所示。
正是由于硅原予sp3杂化,4个价电予分别占据四个杂化轨道,虽然3s能级上的电子激发到3p能级上需要一定的能量,但形成2个共价键所放出的能量更多,结果体系更趋稳定。
硅原子杂化轨道中4个未配对的价电子,分别与最近邻原子中的1个价电子配成自旋方向相反的电子对,形成4个共价键。
因此,硅晶体中的任一原子能够形成的共价键数目最多为4。
在温度为0K时硅晶体中,所有价电子均束缚在共价键上,没有自由电子,不能导电。
只有当电子受激发脱离了共价键后,成了自由电子,同时产生一个空穴,而电子和空穴成为自由载流子,在外电场作用下运动,才产生电流。
硅晶体的半导体性质可以用共价键结构做定性解释。
化学键理论比较直观,是能带理论的一种补充。
1.2.2硅的晶体结构
不同的半导体材料有不同的晶体结构。
常见的元素半导体和二元化合物半导体的晶体结构,主要有金刚石型、闪锌矿型和纤锌矿型,还有少量的氯化钠型,见图1.8~图l.11。
一些重要的半导体材料的晶体结构见表l.3。
表1.3重要半导体材料的晶体结构[4]
晶体结构
晶系
空间群
主要半导体材料
金刚石型
立方
OT4——Fd3m
C(金刚石),Si,Ge,灰-Sn
闪锌矿型
T2d——F43m
BN﹡,BP,AlP,GaP,lnP,BAs,AlAs,
GaAs,InAs,BSb,AlSb,GaSh,lnSb,
ZnO﹡,ZnS﹡,CdS﹡,HgS﹡,ZnSe,CdSe﹡
HgSe,ZnTe
CdTe,HgTe,SiC
纤锌矿型
六方
C46v——P6mc
BN﹡,AlN,GaN,InN
ZnO﹡,ZnS﹡,CdS﹡,HgS﹡,CdSe﹡
氯化钠型
O5k——Fm3m
CdO,PbS,PbSe,PbTe
*具有两种不同结构类型
金刚石型、闪锌矿型和氯化钠型结构均可看成是由两套面心立方格子套构而成。
不同的是,前两者两套格子沿对角线方向平移l/4对角线套构,而氯化钠型则是沿[l00]方向,平移1/2套构;
金刚石型由同种元素的两套面心立方晶格套构而成,而闪锌矿型结构则由两种不同元素原子分别组成的两套面心立方晶格套构而成。
其构成情况见图l.12所示。
由于晶体结构的周期性,可以选取某种单元结构,通过平移得到整个晶格。
固体物理学选取最小的平行六面体重复单元,称为原胞。
原胞反映晶格的周期性。
晶体学则选取比较大的单元,不仅在顶角,在面心和体心也可以有格点,这样的单元称为晶胞。
晶胞不仅反映了晶格的周期性,也反映了晶格的对称性,表征晶格的类型。
硅晶胞是立方晶系,可用直角坐标系x,y,z轴来确定晶体中晶向和晶面的方位,并以晶格常数a为坐标的单位长度。
8个顶点和6个面心都有原子,另外在立方体内还有4个硅原子,各占据空间对角线上距相应顶点1/4处,所以晶胞中含有的原子数为8,它们的坐标分别为:
(0,0,0),(1/2,1/2,0),(1/2,0,1/2),(0,1/2,1/2),(1/4,1/4,1/4),(3/4,3/4,
1/4),(3/4,1/4,3/4),(1/4,3/4,3/4)。
硅的晶格常数a=5.4395Å
硅晶体中的原子密度为:
na=8/(5.4395Å
)3≈5×
1022cm-3
相邻两原子间的间距为
a/4=2.35167Å
,四面体共价半径为1.17584Å
图1.13表示出整个硅晶体结构。
在[111]方向,从下向上原子层的排列是γaαbβcγ,最上层
的γ层原子和最下层的γ层原子完全重合,显示晶体结构的周期性。
硅晶体中有一些重要的晶面和晶向,它们示于图1.14。
晶面用符号(hkl)表示。
其中hkl称为密勒指数,也称为晶面指数。
它是这样确定的:
选取一个不通过原点的晶面,该晶面在z,y,z三个晶轴上的截距的倒数的互质数h,k,l,即为密勒指数。
由于金刚石结构的对称性,每一类型的晶面组有着相同的面间距、面密度和质点分布,称为等同晶面,用符号{hkl}表示。
{100}含有6个等同晶面,(110}含有l2个晶面,{111)含有8个晶面。
分
别为
晶向是指晶列组的方向。
它用晶向指数表示。
确定晶向指数的方法是:
选一格点为原点O,令坐标轴与晶轴重合。
选择或平移操作通过原点O的晶列。
任取晶列上一点A作矢量OA,表示为
用r,s,t的最大公约数统除,使之成为互质的整数m,n,p。
用方括号[mnp]表示,称为晶向指数。
在一种晶体中,有些晶列组是不同的,但它们有相同的结点间距和质点分布。
这些晶列组称为等同晶列组,其方向用<
mnp>
标记。
硅晶体中重要的晶向和等同晶向有
及与它们相反的晶向。
对于立方晶系,两个晶面(h1k1l1)和(h2k2l2)之间的夹角θ可以由下式计算:
表1.4列出了立方晶体晶面(晶向)间的夹角。
表I.4立方晶体晶面(晶向)间的夹角‘[9]
硅晶体中几个主要晶面的面间距、面密度和键密度列于表1.5,其中a=5.4395Å
硅晶体中{111}面是双原子层面。
如果将硅晶体结构投影到(1
0)面上,见图1.15,图中虚线是(111)面与(1
0)面的交线。
(111)面之间大的距离为
a/4=2.35,小的距离为
a/12=0.78Å
表1.5硅晶体中主要晶面的面间距、面密度和键密度[9]
从表l.5可见,{111}面间距最大,键密度最小;
{100}面间距最小,键密度最大;
{110}面居中。
所以,硅晶体中{111}面和{110}面是主要解理面和次要解理面。
1.2.3硅晶体的对称性
晶体的主要特征是其原子的配置具有周期性,同时还具有一定的对称性。
这种宏观及微观对称性决定了晶体外部多面体形状的对称性和物理化学性质上的对称性。
描述晶体的对称性,可归结为研究晶体具有哪些对称元素。
所谓对称元素是指晶体以点、轴、面为中心,以及平移与这些中心的组合,经过一定的对称操作能够恢复原状。
这些点、轴、面等即为对称元素。
对称操作实际上是一种线
性变换。
这种变换有反演(中心反映、倒反、反伸)、反映(镜象,面反映)、旋转、旋转加反演(象转,倒转),以及旋转加反映。
在晶体的微观对称性中,有平移还有旋转加平移、滑移加反映等操作。
图1.16表示硅晶体的旋转轴。
旋转对称操作中使晶体旋转重合的最