届高考化学复习课时规范训练8附答案Word下载.docx
《届高考化学复习课时规范训练8附答案Word下载.docx》由会员分享,可在线阅读,更多相关《届高考化学复习课时规范训练8附答案Word下载.docx(15页珍藏版)》请在冰点文库上搜索。
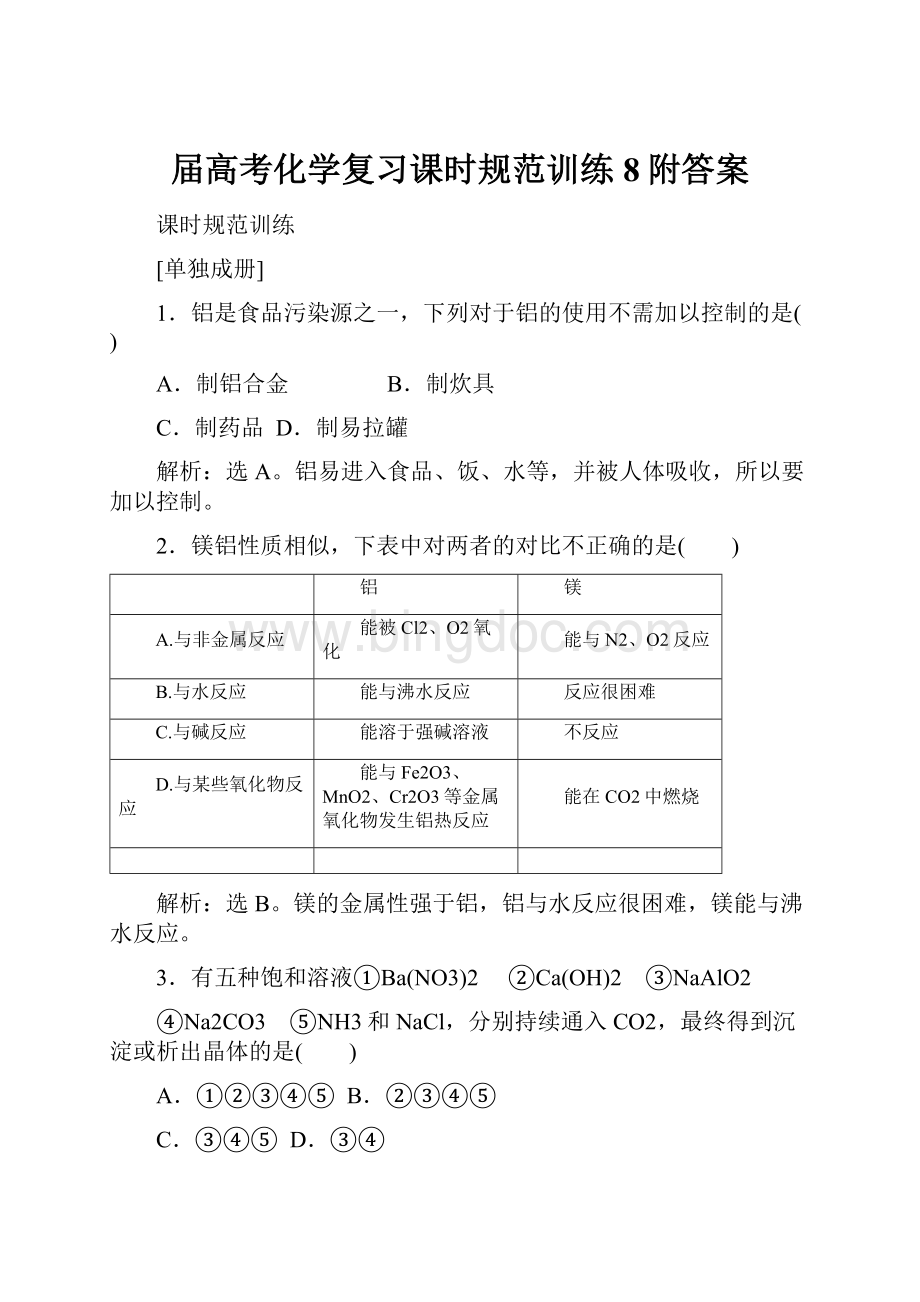
A.①②③④⑤B.②③④⑤
C.③④⑤D.③④
选C。
①CO2和Ba(NO3)2不反应。
②CO2先和Ca(OH)2反应生成CaCO3,最终生成Ca(HCO3)2,③CO2和NaAlO2反应生成Al(OH)3沉淀,④CO2+H2O+Na2CO3===2NaHCO3↓,⑤CO2+NH3+NaCl+H2O===NH4Cl+NaHCO3↓。
4.某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如下图所示:
下列说法不正确的是( )
A.x为NaOH溶液,y为盐酸
B.a→b发生的反应为:
AlO
+H++H2O===Al(OH)3↓
C.b→c→Al的反应条件分别为:
加热、电解
D.a、b、c既能与酸又能与碱反应
选D。
若x为NaOH溶液,则a为NaAlO2;
y为适量盐酸,b为Al(OH)3;
c为Al2O3,故A正确;
NaAlO2与适量的盐酸反应生成Al(OH)3的方程式为AlO
+H++H2O===Al(OH)3↓,故B正确;
Al(OH)3→Al2O3→Al的反应条件分别为:
加热、电解,故C正确;
NaAlO2不能与碱反应,故D错误。
5.如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )
A.OA段的反应离子方程式为:
2Al3++3SO
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B.AB段的离子方程式只有:
Al(OH)3+OH-===AlO
+2H2O
C.A点的沉淀为Al(OH)3和BaSO4的混合物
D.B点溶液为KAlO2溶液
向明矾溶液里滴加氢氧化钡溶液,开始到生成沉淀的物质的量最大时:
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓;
继续加氢氧化钡,当硫酸根离子恰好沉淀完全时,发生KAl(SO4)2+2Ba(OH)2===2BaSO4↓+KAlO2+2H2O。
A.OA段生成沉淀的物质的量最大,反应离子方程式为2Al3++3SO
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓,故A正确;
B.AB段氢氧化铝溶解,钡离子与硫酸根离子生成沉淀,则离子方程式为SO
+Ba2++2Al(OH)3+2OH-===2AlO
+BaSO4↓+4H2O,故B错误;
C.OA段生成沉淀的物质的量最大,沉淀为Al(OH)3和BaSO4的混合物,故C正确;
D.AB段氢氧化铝溶解,B点溶液为KAlO2溶液,故D正确。
6.某溶液中可能含有H+、NH
、Mg2+、Al3+、Fe3+、CO
、SO
、NO
中的几种。
①若加入锌粒,产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。
则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO
,可能含有SO
和NO
C.溶液中n(NH
)=0.2mol
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
根据①,一定有H+,一定没有CO
。
根据②,一定有NH
、Mg2+、Al3+,一定没有Fe3+。
n(NH
)=(0.7-0.5)mol=0.2mol,n(H+)=0.1mol,n(Al3+)=0.1mol,n(Mg2+)=
=0.05mol,所以n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1。
7.有一块镁铝合金,其中镁与铝的质量比是8∶9,加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
镁与铝的质量比是8∶9,则物质的量之比是1∶1,NaOH溶液过量后Al(OH)3完全溶解,只有Mg(OH)2,B错;
等物质的量的Mg(OH)2与Al(OH)3的质量之比是58∶78,即剩余的Mg(OH)2的质量小于沉淀最大质量的
,排除C、D,故选A。
8.3g镁铝合金与100mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4g,则原硫酸的物质的量浓度为( )
A.1mol·
L-1B.1.5mol·
L-1
C.2mol·
L-1D.2.5mol·
由镁铝合金到无水硫酸盐,固体增加的质量为SO
的质量,则n(H2SO4)=
mol=0.15mol,故c(H2SO4)=
=1.5mol·
L-1,B对。
9.已知:
2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3,向含2molNaOH、1molBa(OH)2、2molNaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )
选项
A
B
C
D
n(CO2)/mol
2
3
4
5
n(沉淀)/mol
反应的顺序依次为
Ba(OH)2+CO2===BaCO3↓+H2O
1mol1mol1mol
2NaOH+CO2===Na2CO3+H2O
2mol1mol1mol
2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3
2mol1mol2mol1mol
CO
+CO2+H2O===2HCO
2mol2mol4mol
BaCO3+CO2+H2O===Ba(HCO3)2
1mol1mol
结合选项,当通入2molCO2时,应生成1molBaCO3沉淀;
当通入3~5molCO2时,应生成3mol沉淀;
当通入6molCO2时,还剩2molAl(OH)3沉淀。
10.如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。
根据图示判断,下列结论中不正确的是( )
A.N点时溶液中的溶质只有NaCl
B.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
C.c(NaOH)=c(HCl)
D.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1
A.在MgCl2和AlCl3的混合溶液中加入NaOH溶液,首先发生反应:
Mg2++2OH-===Mg(OH)2↓、Al3++3OH-===Al(OH)3↓,至N点时Mg2+、Al3+恰好完全沉淀,溶液中的溶质只有NaCl,故A正确;
B.接着Al(OH)3开始溶解:
+2H2O,至x=6时(M点)Al(OH)3恰好完全溶解,x在6~8之间时沉淀量不变,说明M点时仍在加入NaOH溶液,故B错误;
C.x=8时(P点),又产生沉淀:
+H++H2O===Al(OH)3↓,说明加入的盐酸与NaOH反应后有剩余,至x=9时(F点),AlO
恰好完全转化为Al(OH)3沉淀,用去盐酸1mL,又知在NM段,溶解Al(OH)3需要1mLNaOH溶液,故c(NaOH)=c(HCl),故C正确;
D.因为沉淀Al3+需要消耗3mLNaOH溶液,则沉淀Mg2+所消耗的NaOH溶液为2mL,因此c(MgCl2)∶c(AlCl3)=1∶1,故D正确。
11.下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。
该溶液的成分可能是( )
A.NH4Al(SO4)2 B.KAl(SO4)2
C.Al2(SO4)3D.NaAlO2
A.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO
+2H2O可知沉淀中Al(OH)3为2mol,故NH4Al(SO4)2为2mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+)∶n(OH-)=2mol∶6mol=1∶3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,接着还会有硫酸钡生成,沉淀最大量为6mol,故A错误;
B.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO
+2H2O可知沉淀中Al(OH)3为2mol,故KAl(SO4)2为2mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+)∶n(OH-)=2mol∶6mol=1∶3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,继续加Ba(OH)2还会有1molBaSO4生成,故B错误;
C.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO
+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+)∶n(OH-)=2mol∶6mol=1∶3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,故C正确;
D.偏铝酸钠与氢氧化钡不反应,不能产生沉淀,故D错误。
12.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
试剂X只能是氢氧化钠溶液,不能是盐酸;
反应①过滤后所得沉淀为Fe2O3;
电解氧化铝制铝的反应是氧化还原反应。
13.铝及其化合物用途广泛,研究其性质具有重要意义。
(1)铝离子的结构示意图为。
(2)美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺,过程如图1所示:
图1
图2
①铝镓合金与水反应的化学方程式为。
②该工艺过程中,能量的转化形式分别有(填“什么能转变为什么能”)。
③该工艺过程总反应的实质是。
(3)室温下,往0.2mol/LAl2(SO4)3溶液中逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图2所示。
解释c→d过程中pH增大且幅度较大的原因(请结合必要的化学用语)
。
(1)铝原子核外有13个电子,核外有三个电子层,最外层3个电子,铝离子是铝原子失去最外层电子形成的,铝离子结构示意图为
;
(2)①铝镓合金与水的反应中生成物是氧化铝、氢气和镓,相当于镓未参加反应,所以实际上发生的反应是2Al+3H2O(熔融)
Al2O3+3H2↑;
②流程图中分析可知,该工艺中能量的转化形式有:
太阳能转化为电能,2Al2O3
4Al+3O2↑,电能转化为化学能,2Al+3H2O(熔融)
Al2O3+3H2↑,化学能转化为热能,所以有三种形式的能量转化;
③该工艺中发生的反应有:
2Al+3H2O
Al2O3+3H2↑①,2Al2O3(熔融)
4Al+3O2②,将方程式①×
2+②得方程式2H2O
2H2↑+O2↑,所以反应的实质是水的分解反应;
(3)硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2OAl(OH)3+3H+,a~b段,加入NaOH溶液,消耗氢离子,发生反应:
H++OH-===H2O,b~c段溶液的pH变化不大,主要发生反应:
Al3++3OH-===Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀;
c~d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,反应为:
Al(OH)3+NaOH===NaAlO2+2H2O,体系是Al(OH)3和NaAlO2的混合物,随着NaAlO2浓度的增大碱性较强,pH增大。
答案:
(1)
(2)①2Al+3H2O
Al2O3+3H2↑ ②太阳能转变为电能,电能转化为化学能,化学能转变为热能
③2H2O
2H2↑+O2↑(文字表述也可以)
(3)Al(OH)3+NaOH===NaAlO2+2H2O;
c点开始主要是Al(OH)3溶于NaOH,生成物显碱性的NaAlO2,体系是Al(OH)3和NaAlO2的混合物,随着NaAlO2浓度的增大,pH增大,该过程类似于酸碱中和,因此pH有突跃
14.无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
已知:
AlCl3、FeCl3分别在183℃、315℃时升华
(1)Cl2的电子式。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为;
炉气中残余的少量Cl2,可用NaOH溶液吸收,其离子方程式为。
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。
请选择合适的温度范围。
a.低于183℃ b.介于183℃和315℃之间
c.高于315℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品
NaAlO2溶液
Al(OH)3
n克Al2O3
计算该样品中AlCl3的质量分数(结果用m、n表示,不必化简)。
(1)Cl2的电子式
;
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应生成氯化铝、一氧化碳,反应的化学方程式为Al2O3+3Cl2+3C
2AlCl3+3CO;
炉气中残余的少量Cl2,可用NaOH溶液吸收生成氯化钠、次氯酸钠和水,其离子方程式为Cl2+2OH-===ClO-+Cl-+H2O;
(3)AlCl3、FeCl3分别在183℃、315℃时升华,为实现FeCl3和AlCl3的分离让温度介于183℃和315℃之间,使氯化铝升华;
(4)ng氧化铝中铝元素的物质的量为
×
2mol,根据元素守恒,样品中AlCl3的物质的量为
2mol,质量为
2×
133.5g,该样品中AlCl3的质量分数为
100%=
100%。
(2)Al2O3+3Cl2+3C
2AlCl3+3CO
Cl2+2OH-===ClO-+Cl-+H2O
(3)b
(4)
100%或
100%
15.氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。
完成下列填空:
(1)实验室配制氯化铝溶液时加入盐酸的目的是。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是(选填编号)。
a.Na2CO3 b.NaOH c.NaAlO2 d.H2SO4
(3)用滴管向试管中滴加少量AlCl3溶液时,滴管不得伸入试管中的理由是,用试管夹夹持上述试管在酒精灯上加热时,不断上下移动试管的目的是。
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体为。
(4)为确定Al2(OH)nCl(6-n)中n的值,取3.490g白色固体,全部溶解在0.1120mol的HNO3(足量)中,并加水稀释成100mL,将溶液分成两等份,进行如下实验:
①一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g,判断加入氨水已足量的操作是。
过滤、洗涤后至少要灼烧次(填写数字);
测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是(选填编号)。
a.干燥Al(OH)3固体时易失水
b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全
d.灼烧氧化铝时不分解
②从另一份溶液中取出20.00mL,用0.1290mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。
则滴定管的读数mL,Al2(OH)nCl(6-n)中n的值为。
(1)氯化铝水解显酸性,加入盐酸能抑制其水解;
(2)a.AlCl3和Na2CO3发生相互促进水解:
2AlCl3+3Na2CO3+3H2O===2Al(OH)3↓+3CO2↑,得不到澄清溶液,故a错误;
b.AlCl3和过量的氢氧化钠反应生成NaAlO2溶液,反应方程式为AlCl3+4NaOH===3NaCl+NaAlO2+2H2O,得澄清溶液,故b正确;
c.AlCl3和NaAlO2发生相互促进水解,反应方程式为AlCl3+3NaAlO2+6H2O===4Al(OH)3↓+3NaCl,得不到澄清溶液,故c错误;
d.AlCl3和硫酸不反应,故溶液仍为澄清,故d正确。
故选bd。
(3)向试管中滴加溶液时应“垂直、悬空”,目的是防止污染试剂;
用试管夹夹持上述试管在酒精灯上加热时,要上下移动试管防止局部暴沸;
AlCl3溶液蒸干时由于水解生成的HCl是挥发性酸,HCl的挥发导致水解被促进,故最终得Al(OH)3;
故答案为:
防止试剂被污染;
防止局部受热引起暴沸;
Al(OH)3。
(4)①判断试剂已过量的方法是继续滴加,即当氨水加入过量时,取上层清液继续滴加氨水,则无沉淀生成;
将所得的Al(OH)3沉淀至少灼烧2~3次,至两次质量差不超过0.1g即说明Al(OH)3分解完全得Al2O3,不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因是干燥Al(OH)3时易分解失水,而灼烧Al2O3不失水;
②滴定管的0刻度在上,故滴定管的读数为18.60mL,则消耗的氢氧化钠的体积为18.60mL;
根据0.1120molHNO3的消耗有两个原因:
被3.490gAl2(OH)nCl(6-n)中OH-消耗的和被0.1290mol/L的标准NaOH溶液消耗的,可有:
0.112mol=
n+0.129mol/L×
0.0186L×
5,解得n=5。
(1)防止氯化铝水解
(2)bd (3)防止试剂被污染 防止局部受热引起暴沸 Al(OH)3 (4)①静置,取上层清液,滴加氨水,无沉淀生成 2 ad ②18.60 5