高中化学专题2原子结构与元素的性质第二单元第1课时原子核外电子排布的周期性学案苏教选修3Word格式.docx
《高中化学专题2原子结构与元素的性质第二单元第1课时原子核外电子排布的周期性学案苏教选修3Word格式.docx》由会员分享,可在线阅读,更多相关《高中化学专题2原子结构与元素的性质第二单元第1课时原子核外电子排布的周期性学案苏教选修3Word格式.docx(14页珍藏版)》请在冰点文库上搜索。
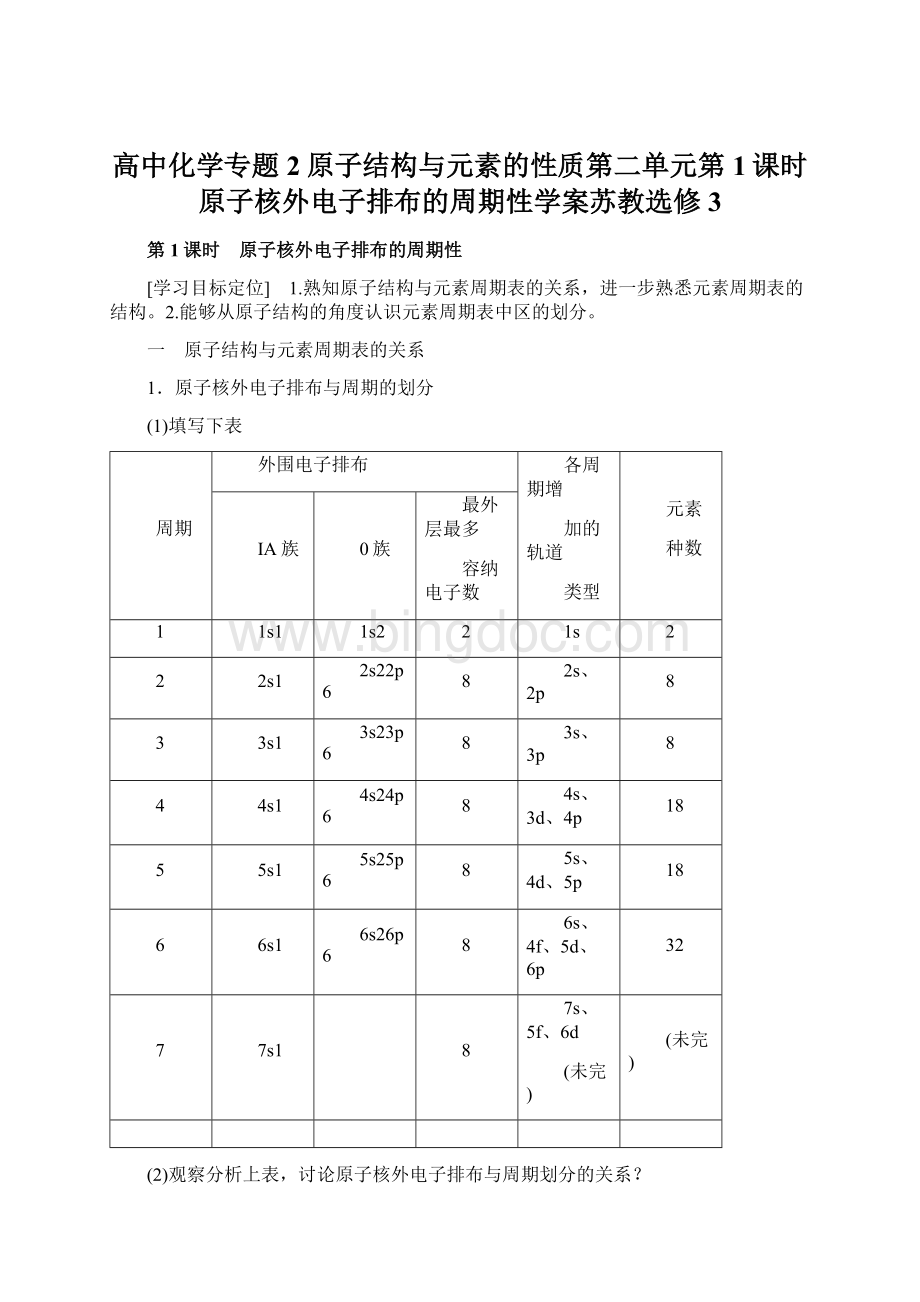
5s、4d、5p
6
6s1
6s26p6
6s、4f、5d、6p
32
7
7s1
7s、5f、6d
(未完)
(2)观察分析上表,讨论原子核外电子排布与周期划分的关系?
①元素周期表的形成过程
随着元素原子的核电荷数的递增,每到出现碱金属,就开始建立一个新的电子层,随后最外层上的电子数逐渐增多,最后达到8个电子,出现稀有气体;
形成一个周期,循环往复形成周期表。
②元素周期表形成的原因:
元素原子核外电子排布的周期性变化。
③元素周期表中周期所含元素种类的变化规律:
由于随着核电荷数的递增,电子在轨道里的填充顺序遵循构造原理;
元素周期表的周期不是单调的;
每一周期里元素的数目并不总是一样多,而是随周期序号的递增逐渐增多,同时,金属元素的数目也逐渐增多。
可以把元素周期表的周期发展形象地比喻成螺壳上的螺旋。
2.原子核外电子排布与族的划分
(1)将下列各主族元素的价电子数、外围电子排布式填入表中。
族数
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
外围电子
排布式
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
列数
13
14
15
16
17
价电
子数
(2)以第4周期副族元素为例,填写下表
副族
21Sc
22Ti
23V
24Cr
25Mn
29Cu
30Zn
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
外围电
子排
布式
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d104s1
3d104s2
价电子
数目
(3)依据上述表格,讨论族的划分与原子核外电子排布的关系?
族的划分依据是原子的外围电子排布
①同主族元素原子的外围电子排布完全相同,外围电子全部排布在ns或nsnp轨道上。
价电子数与族序数相同。
②稀有气体的外围电子排布为1s2或ns2np6。
③过渡元素(副族和Ⅷ族)同一纵行原子的外围电子排布基本相同。
外围电子排布为(n-1)d1~10ns1~2,ⅢB~ⅦB族的外围电子数与族序数相同,第ⅠB、ⅡB族和第Ⅷ族不相同。
[归纳总结]
[活学活用]
1.某元素位于周期表中第4周期ⅤA族,则该元素的名称和价电子排布式均正确的是( )
A.砷,4s24p3B.溴,4s24p5
C.磷,4s24p3D.锑,5s25p3
答案 A
解析 由于该元素为主族元素,价电子数=主族序数,故价电子数为5,排除B项。
又因周期数=电子层数,排除D。
由元素在周期表中的位置可知:
元素的价电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,为33号元素砷,故A项正确。
2.某元素的原子序数为29,试问:
(1)此元素原子的电子总数是________个。
(2)它有________个电子层,有________个能级。
(3)它的外围电子排布式是________________。
(4)它属于第________周期第________族。
(5)它有________个未成对电子。
答案
(1)29
(2)4 7 (3)3d104s1 (4)4 ⅠB (5)1
解析 解答该题需掌握原子核外电子排布与元素周期表的关系和原子核外电子排布的规律。
根据核外电子排布原理,该元素的电子排布式应为1s22s22p63s23p63d104s1,共有29个电子,故为Cu元素。
从核外电子排布式中可以得出n=4,有四个电子层,所以为第4周期元素,外围电子排布为3d104s1,所以在ⅠB族。
外围电子的轨道表示式为
,所以有1个未成对电子。
二 元素周期表的分区
1.按电子排布式中最后填入电子的能级符号可将元素周期表分为s、p、d、f4个区,而ⅠB、ⅡB族这2个纵行的元素的核外电子因先填满了(n-1)d能级而后再填充ns能级而得名ds区。
5个区的位置关系如下图所示。
2.各区元素的外围电子排布特点
分区
元素分布
外围电子排布式
元素性质特点
s区
ⅠA族、
ⅡA族
ns1~2
除氢外都是活泼金属元素
p区
ⅢA族~ⅦA族、
ns2np1~6
最外层电子参与反应
d区
ⅢB族~ⅦB族、
Ⅷ族
(n-1)d1~9ns1~2
d轨道不同程度地参与化学键的形成
ds区
ⅠB族、ⅡB族
(n-1)d10ns1~2
金属元素
根据原子结构特征判断元素在元素周期表中的位置:
电子排布式
3.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是( )
A.第3周期Ⅷ族,p区B.第3周期ⅤB族,ds区
C.第4周期Ⅷ族,d区D.第4周期ⅤB族,f区
答案 C
解析 +3价离子的核外有23个电子,则原子核外有26个电子,26号元素是铁,位于第4周期Ⅷ族,位于d区。
4.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的外围电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p轨道上半充满的元素一定位于p区
D.基态原子的外围电子排布为(n-1)dxnsy的元素的族序数一定为x+y
解析 基态原子的N层上只有一个电子的元素,是ⅠA族元素,也可能为铬元素或者铜元素,A错误;
原子的外围电子排布为(n-1)d6~8ns2的元素是Ⅷ族元素,不是副族元素,B错误;
基态原子的p轨道上半充满的元素的基态原子价电子排布式为ns2np3,则一定属于p区元素,C正确;
基态原子的外围电子排布为(n-1)dxnsy的元素的族序数可能为x+y(x+y≤7)、可能为第Ⅷ族(10≥x+y>
7)、还可能为y(x=10),D错误。
核外电子排布与元素周期表的关系
当堂检测
1.下列说法不正确的是( )
A.元素原子的核外电子排布呈现周期性变化是形成元素周期表的根本原因
B.周期序号越大,该周期所含金属元素越多
C.所有区的名称均来自按构造原理最后填入电子的能级符号
D.周期表共18个纵列,可分为7个主族7个副族,1个Ⅷ族,1个0族
解析 除ds区外,区的名称均来自按构造原理最后填入电子的能级符号。
2.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为V
C.该元素为ⅡA族元素
D.该元素位于d区
解析 该元素的最外层电子数为2,并且为同族元素中原子序数最小的,所以该元素为第2周期或第4周期元素。
又因其价电子数≠最外层电子数,可推出该元素并不是第2周期元素,应为第4周期元素,外围电子排布式为3d34s2,故为23号元素V,d区元素。
3.某元素基态原子的最外层电子排布式为ns2,该元素( )
A.一定是ⅡA族元素
B.一定是金属元素
C.不是ⅡA族元素就是副族元素
D.可能是金属元素也可能是非金属元素
答案 D
解析 由于最外层电子排布式为ns2,则该元素可能是He元素、第ⅡA族元素或是过渡金属元素,所以综合起来讲,可能是金属元素也可能是非金属元素,答案选D。
4.有A、B、C、D四种元素。
其中A为第4周期元素,与D可形成原子个数比为1∶1和1∶2的化合物,其焰色反应透过蓝色钴玻璃观察呈紫色;
B为第4周期d区元素,最高化合价为+7;
C和B是同周期的元素,具有相同的最高化合价;
D的外围电子排布式为nsnnpn+2。
(1)试写出四种元素的元素符号:
A______、B______、C______、D______。
(2)按原子半径由大到小排列:
________________________________________________。
答案
(1)K Mn Br O
(2)K>
Mn>
Br>
O
解析 由B为第4周期d区元素,最高化合价为+7可推出B是锰元素;
C和B是同周期的元素,具有相同的最高化合价,则C是溴元素;
D的外围电子排布式为nsnnpn+2,D是氧元素;
A与D可形成原子个数比为1∶1和1∶2的化合物,A是钾元素。
40分钟课时作业
[基础过关]
一、原子核外电子层结构
1.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
解析 本题考查的是原子核外电子的排布规律与族序数的关系。
依据题意:
“K层电子数为奇数”、“L层电子数为奇数”说明K、L层必然为最外层,所容纳的电子数等于族序数。
“L层电子数为偶数”不能确定L层是否为最外层,所以也就不能确定族序数。
则选项C不正确。
M层电子为奇数的主族元素,M层一定是最外层,所在族的序数与该元素原子的M层电子数相等,D项对。
2.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2B.X2YZ3
C.X2YZ2D.XYZ3
3.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相等,当n为次外层时,其最多容纳的电子数比(n+1)层最多容纳电子数多10,则n层是( )
A.N层B.M层C.L层D.K层
答案 B
解析 从题意可知:
当n为最外层时其次外层电子数为8;
当n为次外层时,其最多容纳电子数为18个。
则该电子层是M层。
二、元素周期表的结构与区的划分
4.已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )
A.第3周期ⅣA族,p区
B.第4周期ⅡB族,s区
C.第4周期Ⅷ族,d区
D.第4周期ⅡA族,s区
解析 该元素为Ca,处于第4周期ⅡA族,s区。
5.下列说法正确的是( )
A.第ⅣA族元素最不活泼
B.过渡元素就是副族元素
C.第ⅣA族元素即为第十四纵行
D.第ⅣA族元素所含元素种类最多
6.元素周期表的第7周期称为不完全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是( )
A.该周期的元素都是放射性元素
B.该周期的元素,原子序数最大为118
C.该周期的ⅦA族元素是金属元素
D.该周期的ⅢA族的元素的氢氧化物具有两性
解析 第ⅢA从上到下金属性逐渐增强,其氢氧化物不可能具有两性。
7.下列各表中的数字代表的是元素的原子序数。
表中数字所对应的元素与它们在周期表中的位置相符的是( )
解析 根据同主族原子序数差值判断。
三、元素的“位—构—性”之间的关系
8.下表是元素周期表的一部分,有关说法正确的是( )
c
d
a
b
e
f
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:
e>
b>
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
解析 a、b、c、d、e、f分别是钠、镁、碳、氧、硫、氯。
同一主族,氢化物的稳定性由上到下递减,H2O(d)的稳定性比H2S(e)强;
同一周期原子半径从左到右递减,a、b、e三种元素的原子半径a>
e;
六种元素中最活泼的金属是Na(a),最活泼的非金属是氧(d)。
则选项A、B、C均不正确。
9.
短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所处的周期序数与族序数相等。
下列判断不正确的是( )
A.最简单气态氢化物的热稳定性:
R>
Q
B.最高价氧化物对应水化物的酸性:
Q<
W
C.原子半径:
T>
Q>
R
D.含T的盐溶液一定显酸性
解析 T应为Al、Q为Si、W为S、R为N,NH3的稳定性大于H2S、H2SiO3酸性小于HClO4。
AlCl3溶液显酸性,而NaAlO2溶液显碱性。
10.
右图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
A.D与C不能形成化合物
B.D的最高正价与B的最高正价相等
C.A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>
B>
A
D.原子半径的大小顺序是C>
A>
D
解析 A为P、B为S、C为Cl、D为O。
A项O和Cl可形成Cl2O7;
原子半径:
P>
S>
Cl>
O。
[能力提升]
11.
X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在元素周期表中的位置如右图所示,试回答下列问题。
(1)X元素单质的化学式是________。
(2)Y元素的原子结构示意图是____________,Y与Na所形成化合物的电子式为________________________________________________________________________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有________性;
若从Z元素在元素周期表中所处位置看,它具有这种性质的原因是__________________________________________________________,其外围电子排布式为______________。
答案
(1)F2
(2)
(3)砷 两 Z位于元素周期表中金属元素与非金属元素交界线附近 4s24p3
解析 在元素周期表中,非金属元素位于元素周期表中右上方,三种元素均为非金属元素,必位于第ⅤA、ⅥA、ⅦA三个主族,则可认定X必为氟元素,Y为硫元素,Z为砷元素。
12.假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可容纳的元素种类如下:
元素种类
人们预测元素周期表第8周期将来也会排满,那么该周期排满后的元素种类是________。
A.18B.32C.50D.无法判断
(2)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在第________周期____族(注:
把0族看作ⅧA族,下同)。
周期表中元素在填满第________周期后将结束。
(3)根据周期表中每个周期非金属元素的种数(把稀有气体元素看为非金属元素),预测周期表中应该有________种非金属元素,还有________种未发现。
未发现的非金属元素处于第______周期______族。
答案
(1)C
(2)8 ⅧA 8 (3)23 1 7 ⅧA
解析
(1)由已知可归纳出周期为1、2、3、4、5、6、7,元素种数2×
12、2×
22、2×
32、2×
42,据此预测第8周期元素种数为2×
52=50(种)。
(2)观察周期表可知:
第6周期倒数第三种元素为金属元素,第7周期倒数第二种元素为金属元素,第8周期倒数第一种元素为金属元素。
(3)前六周期非金属元素种数分别为2、6、5、4、3、2种,则可类推第7、8周期非金属元素种数分别为1种、0种。
共计23种,第7周期未填满,有1种非金属元素未发现,将处在ⅧA族。
13.下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物名称为________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。
请写出元素②的氢氧化物与NaOH溶液反应的化学方程式______________________________________________。
答案
(1)⑨
(2)苯 (3)5
(4)Be(OH)2+2NaOH===Na2BeO2+2H2O
解析
(1)⑨属于d区元素。
(2)元素①是氢元素,元素③是碳元素,依题意,形成的环状物是苯。
(3)从nsnnpn+1可知,n=2,该元素为N元素,最外层电子数为5。
(4)⑤是Al,②是Be,依对角线规则,两元素性质相似,仿照Al(OH)3和碱反应的化学方程式写出Be(OH)2与NaOH反应的化学方程式。
[拓展探究]
14.已知元素周期表中共有18纵行,如图实线表示元素周期表的边界。
按电子排布,可把周期表里的元素划分为几个区:
s区、p区、d区、ds区等。
除ds区外,其他区的名称来自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影
和
表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)请在元素周期表中用元素符号标出4s轨道半充满的元素。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
_____________________
________________________________________________________________________
________________________________________________________________________。
(5)随着科学技术的发展,不断有新的元素被发现。
若把第7周期排满,则元素周期表共可以排布________种元素。
答案
(1)如图
(2)ds (3)见上图
(4)Fe的外围电子排布为3d64s2,Fe2+为3d6,Fe3+为3d5,依据“能量相同的轨道处于全空、全充满和半充满时能量最低”的原则,3d5处于半充满状态,结构更稳定,故Fe3+比Fe2+稳定 (5)118
解析
(1)正确理解题意,明确按构造原理分区的含义即可,注意把握关键信息“……最后填入的电子的能级符号”。
(2)ds区外围电子排布为(n-1)d10ns1和(n-1)d10ns2,而d区内6纵行外围电子排布为(n-1)d54s1,7纵行外围电子排布为(n-1)d54s2,因此类比可以放在ds区。
(3)4s轨道半充满,即为4s1,根据构造原理和能量最低原理、洪特规则,该元素原子的电子排布式可能为1s22s22p63s23p64s1(K)或1s22s22p63s23p63d54s1(Cr)或1s22s22p63s23p63d104s1(Cu),分别标在元素周期表中相应位置即可。
(4)Fe外围电子排布为3d64s2,Fe2+为3d6,Fe3+为3d5,Fe3+为半充满状态较稳定。
(5)根据0族元素原子序数知,第7周期排满,其0族元素的原子序数应为2+8+8+18+18+32+32=118。