钠镁及其化合物.docx
《钠镁及其化合物.docx》由会员分享,可在线阅读,更多相关《钠镁及其化合物.docx(32页珍藏版)》请在冰点文库上搜索。
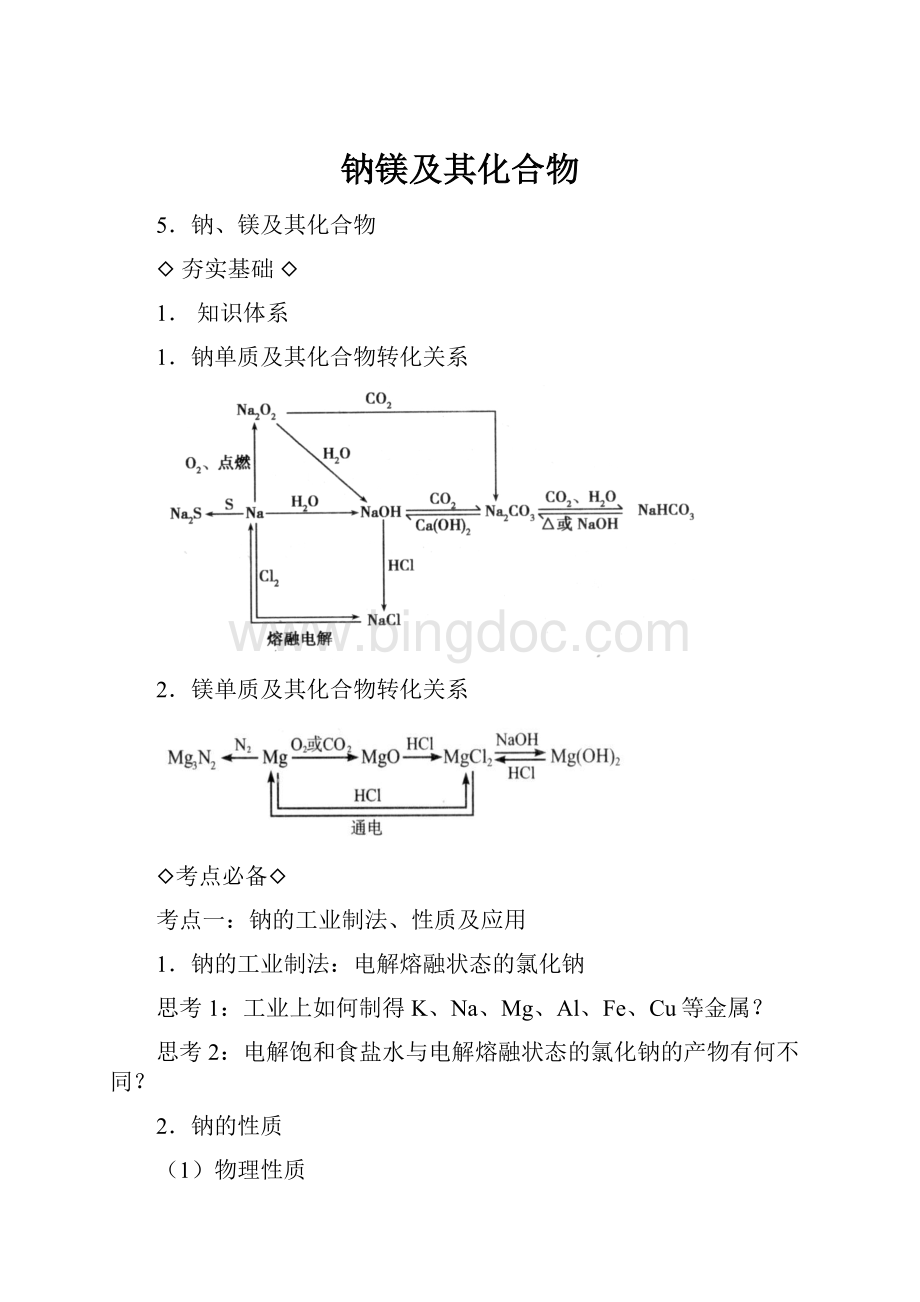
钠镁及其化合物
5.钠、镁及其化合物
◇夯实基础◇
1.知识体系
1.钠单质及其化合物转化关系
2.镁单质及其化合物转化关系
◇考点必备◇
考点一:
钠的工业制法、性质及应用
1.钠的工业制法:
电解熔融状态的氯化钠
思考1:
工业上如何制得K、Na、Mg、Al、Fe、Cu等金属?
思考2:
电解饱和食盐水与电解熔融状态的氯化钠的产物有何不同?
2.钠的性质
(1)物理性质
颜色
状态
硬度
密度
熔点
银白色
固体
小
比水轻
0.97g•cm-3
低于水的沸点
97.8℃
(2)化学性质
①与非金属反应
②与水反应
2Na+2H2O=2NaOH+H2↑
实验现象:
钠块熔成小球(说明反应放热且钠的熔点低);钠球浮在水面上(说明钠的密度比水小);钠球在水面上四处游动(说明反应放出气体,推动钠球在水面上运动);发出嘶嘶的声音(说明生成可燃性气体,发出轻微的暴鸣声)。
③与盐溶液反应
钠投入CuSO4溶液中:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
实验现象:
看到生成蓝色絮状沉淀,其余现象同钠与水反应。
思考:
钠投入FeSO4溶液、NH4Cl溶液等现象如何?
④与熔融盐反应
说明:
钠与盐的水溶液反应时,先与水反应生成NaOH和H2,然后再分析盐与NaOH是否发生复分解反应,即钠不能置换出水溶液中的不活泼金属,,但可与盐的熔融液反应置换出金属。
3.钠的应用
①制高压钠灯
②形成钾钠合金,用于快中子反应堆热交换剂
③制取钠的化合物
④制取钛、锆、铌、钽等金属
△针对训练
1.钠与水反应时产生的各种现象为①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
A、①②③④⑤B、全部C、①②③⑤⑥D、①③④⑤⑥
2.(09上海)9.2g金属钠投入到足量的重水中,则产生的气体中含有
A.0.2mol中子B.0.4mol电子
C.0.2mol质子D.0.4mol分子
考点二:
钠的重要化合物
1.氧化钠与过氧化钠比较
氧化钠
过氧化钠
状态
白色固体
淡黄色固体
结构和组成
含有O2-,阴阳离子比为1∶2
含有O22-,阴阳离子比为1∶2
氧元素的化合价
-2
-1
化学性质
与水反应
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
与酸反应
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
与酸性氧化物反应
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2↑
用途
—
氧化剂、供氧剂、漂白剂、杀菌剂
保存
隔绝空气,密封保存
隔绝空气、密封保存、远离易燃物
2.碳酸钠与碳酸氢钠比较
名称
碳酸钠
碳酸氢钠
俗名
纯碱或苏打
小苏打
主要物理性质
颜色状态
白色粉末
细小白色晶体
溶解性
易溶于水
(20℃,S=21.5g)
溶于水
(20℃,S=9.6g)
主要化学性质
稳定性
稳定,但结晶碳酸钠易风化
受热易分解
与酸溶液反应
较快;在稀溶液中加入酸液先生成HCO3-,后生成CO2
更快;在稀溶液中加入酸液立即生成CO2
与碱反应
与NaOH不反应,但能与Ca(OH)2反应
与NaOH和Ca(OH)2均反应
与盐的反应
CaCl2
反应,生成沉淀
不反应,无明显现象
Al2(SO4)3
又水解
双水解
与水的作用
水解,碱性较强
水解,碱性较弱
加热
不分解
分解
与酸反应
速率慢;现象与滴加顺序有关
速率快;现象与滴加顺序无关
用途
化工原料
食品发酵、泡沫灭火剂
相互转化
△针对训练
3.(09天津)25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
4.(09北京)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。
下列推断不正确的是
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
考点三:
碱金属元素
1.碱金属的物理性质
(1)相同点:
碱金属除Cs略带金色光泽外,都是银白色、有金属光泽的固体,密度都比较小,硬度也都比较小,熔沸点较低,导电、导热较强。
(2)递变性:
从Li→Cs密度逐渐增大(Na、K反常),熔沸点逐渐降低。
2.原子结构与性质推断
(1)相同点:
最外层上都只有1个电子具有相似的化学性质。
(2)不同点:
从Li→Cs电子层数逐渐增多,原子半径逐渐增大从Li→Cs金属性逐渐增强。
3.碱金属的化学性质
(1)与O2等非金属的反应
碱金属都能与氧气等非金属反应,化学方程式:
(2)与H2O的反应
碱金属单质与水均能发生反应,生成氢氧化物和氢气。
反应的化学方程式可表示为:
2R+2H2O==2ROH+H2↑,但反应的剧烈程度不同:
由Li→Cs反应越来越,证明它们的金属性逐渐增强。
4.焰色反应
多种金属或它们的化合物在燃烧时火焰呈特殊的颜色,这在化学上叫焰色反应。
该变化属物理变化。
钠、钾的焰色反应分别为:
黄色、紫色(透过蓝色钴玻璃)
焰色反应通常可用铂丝或光洁无锈的铁丝或镍、铬、钨丝。
每次焰色反应操作之后,都要用稀盐酸洗净金属丝。
用稀盐酸的原因是:
生成金属氯化物,而金属氯化在高温时可挥发。
△针对训练
5.碱金属与卤素所形成的化合物大都具有的性质是①高沸点②能溶于水③水溶液能导电④低熔点⑤熔融状态下不导电
A、①②③
B、③④⑤
C、①④⑤
D、②③⑤
6.下列关于钠、钾的说法正确的是
①钠的熔点比钾的熔点高②钠和钾在空气中燃烧的产物都是过氧化物③钠和钾性质活泼且都是短周期元素④钠和钾的合金用作原子反应堆的导热剂
A、①②B、②③
C、③④D、①④
考点四:
镁和海水中提镁
1.镁的物理性质
金属镁的密度小,只有铝的密度的2/3,镁合金的强度高、机械性能好,这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。
金属镁具有金属的通性:
导电、导热、延展性。
2.镁的化学性质
(1)与非金属单质反应
(2)与水反应
镁跟常温下的水只能发生很缓慢的反应,跟热水反应较快。
(3)与酸反应
与非氧化性酸反应产生H2
例如:
Mg+H2SO4==MgSO4+H2↑
与氧化性酸如浓硫酸、浓硝酸、稀硝酸在常温下也能反应,但不产生H2。
例如:
Mg+2H2SO4(浓)==MgSO4+SO2↑+2H2O
Mg+4HNO3(浓)==Mg(NO3)2+2NO2↑+2H2O
3Mg+8HNO3(稀)==3Mg(NO3)2+2NO↑+4H2O
(4)与非金属氧化物反应
镁与二氧化碳反应:
请思考:
镁与SO2、SiO2反应的产物分别是什么呢?
3.海水提镁的原理
(1)流程示意图
(2)基本步骤及主要反应
①制碱:
②沉淀:
MgCl2+Ca(OH)2==Mg(OH)2↓+CaCl2
③酸化:
Mg(OH)2+2HCl==MgCl2+2H2O
④蒸发、冷却结晶:
析出MgCl2·6H2O晶体
⑤脱水:
⑥电解:
(3)注意:
从海水中提取镁的工厂就设在海边,需要的碱取自海边丰富的贝壳(含CaCO3),CaCO3分解后生成的CaO再水反应即得碱Ca(OH)2。
电解MgCl2时产生的Cl2又可作为制盐酸的原料,制得的盐酸再跟Mg(OH)2反应制取MgCl2又进入循环,提高了综合经济益。
△针对训练
7.目前,世界上生产的镁有60%来自海水。
海水提镁,最基本的方法就是往海水里加碱使镁沉淀出来,然后经过一系列处理,最终得到单质镁。
试判断:
在海水提镁的过程中,不可能发生的反应有
C、Mg(OH)2+2HCl==MgCl2+2H2OD、Mg2++2OH-==Mg(OH)2↓
8.(07海南)由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。
其先后顺序正确的是
A、②④⑤③①B、③②④①⑤C、②④③⑤①D、③④②⑤①
△针对训练答案:
1.D2.B3.C4.A5.A6.D7.A8.C
◇典例精讲◇
例题1:
往烧杯内注入煤油和水各100mL,静置后将一小块钠投入烧杯中。
发生的现象是
A、钠沉到液面下1/2处,钠块下部有许多气泡放出。
附有气泡的钠块徐徐上升到液体上部,一会儿又沉到液面下1/2处,如此反复多次,最后消失。
B、钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C、钠块浮在液面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D、钠块沉到液面下1/2处,很快熔成一个闪亮的小球,小球在液面下1/2处沿水平方向迅速游来游去,最后消失
解析:
由于钠的密度比水小而比煤油大,故钠应处于水与煤油的交汇处,钠与水接触的部分发生剧烈反应,产生大量气泡,附着在钠表面的气泡使之浮力增大,故会徐徐上浮至煤油的界面处,反应又开始进行,如此反复至钠完全反应。
答案:
A
◇实战演练◇1.(07全国
)在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A、Na2OB、Na2O2
C、Na2O和Na2O2D、Na2O2和NaO2
解析:
HCl为0.04mol。
钠的氧化物若为Na2O,应为0.02mol×62g·mol-1=1.24g;若为Na2O2,应为0.02mol×78g·mol-1=1.56g。
现1.5g,介于1.24~1.56之间,应为二者的混合物。
答案:
C
2.将一块银白色的金属钠放在空气中会发生一系列的变化:
表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是
A、表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B、“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C、最后变成碳酸钠粉末
D、该过程的所有化学反应均为氧化还原反应
解析:
Na2O生成NaOH,NaOH生成Na2CO3等均不是氧化还原反应。
答案:
D
例题2:
(08北京)1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3B.Na2O2、Na2CO3
C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO3
解析:
根据反应式:
2NaHCO3=Na2CO3+CO2↑+H2O,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2;根据计量关系,可知2molNaHCO3生成CO2和H2O各1mol,Na2O2只有1mol,故其恰好和CO2反应生成Na2CO3和O2,气体排出后,只剩余Na2CO3。
答案:
A
◇实战演练◇3.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。
下列物质中不能满足上述结果的是
A.H2B.COC.C6H12O6D.CH4
解析:
采用巧解算法解题。
分析题意要满足题给条件,必须是物质燃烧消耗氧气的量,等于CO2和H2O与过氧化钠反应生成的氧气的量。
所以A、B满足上述结果;选项C可以改写为的(CO)6•(H2)6形式,故C正确;选项D不能满足上述结果。
答案:
D
4.将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如右图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是
A.2mol、3mol、8mol
B.3mol、2mol、8mol
C.2mol、3mol、4mol
D.3mol、2mol、4mol
解析:
本题涉及的反应有:
2Na2O2+2H2O==4NaOH+O2↑
Mg2++2OH-==Mg(OH)2↓
Al3++3OH-==Al(OH)3↓
Al(OH)3+OH-==AlO2-+2H2O
由图中可以看出:
当n(Na2O2)=8mol时,n(气体)=8mol,
故n(NH4+)=n(NH3)=8mol-
mol=4mol;
n[Mg(OH)2]=3mol;
n[Al(OH)3]=5mol-3mol=2mol。
例题3:
(08海南)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
已知实验中可能会发生下列反应:
①2Mg+O2
2MgO;②3Mg+N2
Mg3N2;③2Mg+CO2
2MgO+C
④Mg+H2O
MgO+H2↑⑤Mg3N2+6H2O
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。
实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)____________________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:
______________________________________________________________________
解析:
由题目所提供的信息可知:
Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以Mg在与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。
在连接装置时,要注意气体流向(长进短出)。
O2与Fe反应时应在加热条件(或温度较高)下进行,铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。
根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解的产物中NH3的存在推出产物是Mg3N2。
答案:
(1)B、D、F
选择B,目的:
除去空气中的水蒸气
选择D,目的:
除去空气中的CO2
选择F,目的:
除去空气中的O2
(2)h→g→d→c→k→l→a→b
(3)制得的氮化镁将不纯;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应。
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
◇实战演练◇5.(09天津)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。
从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:
、。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、、、或H2、。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。
微溶于水,有毒性和强腐蚀性。
他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
④C中液体产生颜色为。
为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。
解析:
本题主要考查内容是海水的综合开发——工业制溴单质,利用氧化还原知识并对溴进行富集,对电解饱和食盐水、离子方程式书写以及实验蒸馏装的基本操作考查。
答案:
(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2NaOHNaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br-强酸对设备的严重腐蚀
(5)①冷凝管②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色分液(或蒸馏)
6.(09重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是;NaOH溶液的出口为(填字母);精制饱和食盐水的进口为(填字母);干燥塔中应使用的液体是。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为。
SiCl4可转化为SiHCl3而循环使用。
一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气m3(标准状况)。
解析:
工业电解食盐水装置的考查,以及工业制粗硅以及粗硅的提纯相关化工流程的考查。
答案:
(1)①氯气;a;d;浓硫酸
(2)①SiCl4+2H2+O2
SiO2+4HCl②0.35(3)134.4
例题4:
(08广东)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。
工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO
等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为。
(2)“趁热过滤”的原因是。
(3)若在实验室进行“趁热过滤”,可采取的措施是(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH1=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式。
解析:
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
(3)思路方向:
1.减少过滤的时间2.保持过滤时的温度。
(4)思路:
分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(s)====Na2CO3(s)+H2O(g)。
答案:
(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
(3)若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
(4)若“母液”循环使用,可能出现的问题及其原因是问题:
溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:
“母液”中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
(5)写出Na2CO3·H2O脱水反应的热化学方程式
Na2CO3·H2O(S)====Na2CO3(s)+H2O(g);H=+58.73kJ/mol
◇实战演练◇7.为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
实验甲:
干燥的二氧化碳和过氧化钠的反应:
在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2,在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃且Ⅱ中的淡黄色没有变化。
实验乙:
潮湿的二氧化碳和过氧化钠的反应:
在试管Ⅰ内装入试剂Y,其他操作同实验甲,观察到木条复燃且Ⅱ中的淡黄色变为白色。
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是_____________________。
(2)在实验甲中,试剂X是________,其作用是______________________________。
在实验乙中,试剂Y是________。
(3)根据上述两个实验现象,得到的结论是__________________________________。
(4)试管Ⅲ中的NaOH溶液的作用是________________________________________。
(5)为了确保实验现象的准确性,制备CO2所用的反应物最好选用________(填编号,多选扣分)
A.大理石 B.小苏打 C.烧碱 D.盐酸 E.稀硫酸 F.稀硝酸
(6)CO2和Na2O2的反应机理可用示踪原子分析加以证明,请根据上述实验事实完成下列反应:
Na2O2+C18O2+H218O→
解析:
(1)在通入二氧化碳前,与过氧化钠相连的导气管与NaOH溶液及空气相通,其中所含的水分与过氧化钠反应,因此为防止过氧化钠受潮需关闭K1和K2。
(2)实验甲进行时,需制备干燥的二氧化碳,故试剂X应为干燥剂浓硫酸;而实验乙进行时,二氧化碳气体在通过装置Ⅰ后含较多的水蒸气,所以试剂Y应为水或碳酸氢钠的饱和溶液。
(3)对比甲、乙两个实验的实验现象,可得出二氧化碳与过氧化钠的反应,只有在水存在时才能进行的结论。
(4)因二氧化碳不支持燃烧,要验证是否有氧气产生,需在检验前将未反应的二氧化化碳用NaOH溶液除去。
(5)由实验目的可知,在制得的二氧化碳中不能含有其他挥发性物质,故不可选用稀盐酸或稀硝酸,只能选用稀硫酸;而硫酸与碳酸钙作用产生的硫酸钙微溶于水,覆盖在固体表面,阻碍反应进行,故应选B、E。