浙江选考化学模拟练习卷1Word文档下载推荐.docx
《浙江选考化学模拟练习卷1Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《浙江选考化学模拟练习卷1Word文档下载推荐.docx(25页珍藏版)》请在冰点文库上搜索。
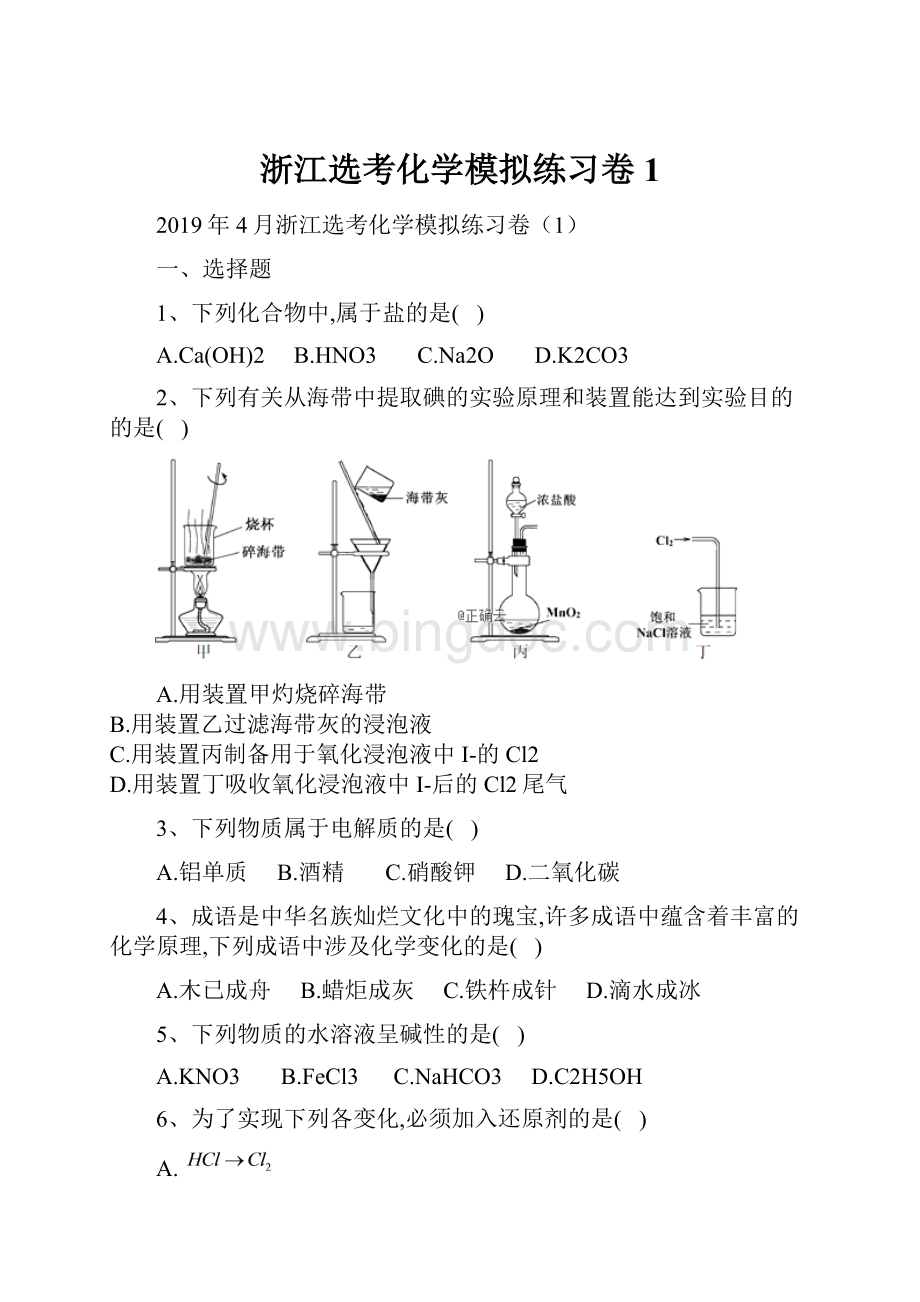
B.Mg2+的结构示意:
C.CCl4的比例模型:
D.CH2F2的电子式:
9、既可用排水法又可用向上排空气法收集的气体是(
A.NO
B.O2
C.NH3
D.NO2
10、下列事故或药品的处理正确的是(
)
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
11、下列说法正确的是(
A.氢元素的几种核素均有质子和中子
B.金刚石和C60互为同素异形体,且都属于原子晶体
C.C2H6和C3H8互为同系物
D.化合物(b)
、(d)
、(p)
的分子式均为C6H6,b的同分异构体只有d和p两种
12、X、Y、Z、W是原子序数依次增大的短周期主族元素,部分元素在周期表中的位置如下图所示,其中X、Y、W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物均能发生反应,下列说法中不正确的是(
A.简单离子半径大小关系为:
Y>
Z>
W
B.X与氢元素形成的化合物中,只含极性键
C.Z、W氧化物的熔点高低:
Z<
D.X与Y可以存在于同一离子化合物中
13、下列离子方程式书写正确的是(
A.澄清石灰水与过量的小苏打溶液反应:
Ca2++OH-+
=CaCO3↓+H2O
B.酸性高锰酸钾溶液与稀草酸反应:
5
+2
+16H+=2Mn2++10CO2+8H2O
C.AgCl的悬浊液中滴加Na2S溶液:
2AgCl+S2-=Ag2S+2Cl-
D.NH4HCO3溶液加入过量NaOH溶液加热:
+OH-=NH3·
H2O
14、在一定温度下,可逆反应N2(g)+3H2(g)
2NH3(g)达到平衡的标志是(
A.NH3生成的速率和NH3分解的速率相等
B.N2、H2、NH3的浓度相等
C.单位时间内生成nmolN2,同时生成3nmolH2
D.N2、H2、NH3的分子数之比为1:
3:
2
15、下列说法正确的是(
A.花生油和玉米油都是可皂化的饱和酯类
B.溴苯、硝基苯和环己烷都难溶于水且密度都大于水
C.分子式为C10H14的单取代芳香烃,其可能的结构有4种
D.尼龙、涤纶和有机玻璃都是通过缩聚反应制得的
16、下列叙述正确的是(
A.蔗糖和麦芽糖的水解产物相同
B.牛、羊的消化道内含有能够分泌纤维素酶的微生物,纤维素在其体内水解的最终产物为葡萄糖
C.蛋白质水解的最终产物为葡萄糖
D.淀粉和纤维素水解得到的最终产物不同
17、25℃时,下列有关0.1mol·
L-1醋酸溶液的说法中,正确的是(
A.pH=1
B.c(H+)=c(CH3COO-)
C.加入少量CH3COONa固体后,醋酸的电离程度减小
D.与0.1mol·
L-1NaOH溶液等体积混合后所得溶液显中性
18、下列说法中正确的是(
A.氢键是一种较弱的化学键
B.NH3的稳定性很强,是因为其分子间能形成氢键
C.最外层能达到稳定结构的微粒只有稀有气体的原子
D.常温下Cl2、Br2、I2状态由气态到固态变化的主要原因是分子间作用力在逐渐增大
19、设NA代表阿伏加德罗常数的值,下列有关叙述正确的是(
A.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA
D.1molFe在氧气中充分燃烧失去3NA个电子
20、下列有关热化学方程式的叙述正确的是(
A.已知甲烷的燃烧热为890.3kJ·
mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔΗ=-890.3kJ•mol-1
B.已知C(石墨,s)═C(金刚石,s)ΔΗ>
0,则金刚石比石墨稳定
C.已知中和热为ΔΗ=-57.4kJ·
mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知S(g)+O2(g)═SO2(g)ΔΗ1;
S(s)+O2(g)═SO2(g)ΔΗ2,则
ΔΗ1<
ΔΗ2
21、人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。
下列有关说法正确的是(
A.a为电源的负极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-
H2↑
D.若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2g(忽略气体的溶解)
22、一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是(
物质
X
Y
Z
W
初始浓度/mol·
L-1
0.5
0
平衡浓度/mol·
0.1
0.4
A.反应达到平衡时,X的体积分数为10%
B.该温度下反应的平衡常数K=16
C.保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D.若X、Y的初始浓度均为0.8mol·
L-1,则达到平衡时,W的浓度为0.64mol·
23、25℃时,下列溶液的离子浓度关系式正确的是(
A.pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1
B.浓度相同的①NH4Cl;
②CH3COONH4;
③NH4HSO4三种溶液的c(
):
①>
③>
②
C.浓度相同的氨水与盐酸等体积混合:
c(
)>
c(Cl﹣)>
c(H+)>
c(OH﹣)
D.将amol·
L-1CH3COOH与bmol·
L-1NaOH溶液等体积混合,测得溶液pH为7,则a>
b
24、中国是茶的故乡,为方便饮用,可通过以下方法制取罐装饮料茶,有关下述过程说法不正确的是(
A.操作①利用了物质的溶解性
B.操作③的方法属于过滤
C.加热杀菌的温度应在500°
C左右
D.抗氧化剂的作用是延长饮料茶的保质期
25、为落实“五水共治”,某工厂拟综合处理含
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程。
下列说法不正确的是(
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含
废水时,发生反应的离子方程式为
二、非选择题
26、萄糖在工农业生产上有很多应用。
D、E均为高分子化合物。
根据下图填空:
(1).写出葡萄糖与新制氢氧化铜悬浊液反应的化学方程式:
__________。
(2).A中的官能团有__________(填官能团符号)。
(3).E在自然界中可降解,对环境无害,下列说法正确的是__________(填字母)。
a.E是一种线型高分子
b.由A生成E的反应属于加聚反应
c.E的相对分子质量为72
d.E用作一次性快餐盒有助于减少白色污染
(4).在反应①~⑤中,属于取代反应的是__________。
(5).A跟氢氧化钙作用可制得一种常用的人体补钙剂,测得这种补钙剂的纯净物中钙元素的质量分数为13.0%,其结晶水的含量为__________。
27、某同学设计如下实验方案,以分离混合溶液中的AlCl3和FeCl2。
(1).沉淀A的化学式为__________
(2).写出AlCl3溶液与过量NaOH溶液反应的离子方程式:
__________
(3).写出沉淀A转化为沉淀B的化学方程式:
(4).写出检验溶液A中是否含有Fe2+的方法__________
28、某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1).实验室用装置A制备SO2。
从物质类别看,SO2属于__________(填“酸性”、“两性”或“碱性”)氧化物。
(2).实验室用装置E制备Cl2,写出该反应的化学方程式:
_________________________。
该反应的氧化剂是__________,还原剂是______________(填化学式)。
(3).反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。
停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
__________,D:
(4).另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,你是否支持这个观点__________(填“是”或“否”)。
(5).C中溶液的作用__________。
29、今有100mLAlCl3和FeCl3的混合溶液,其中AlCl3的浓度为0.40mol/L,FeCl3的浓度为0.80mol/L,向其中逐滴加入一定浓度的NaOH溶液,沉淀量逐渐达到最大值,然后继续滴加NaOH溶液,沉淀开始溶解,当加入的NaOH溶液为200mL时,沉淀恰好不再减少。
计算:
(1).当沉淀达到最大量时,Al(OH)3的物质的量是__________mol
(2).当加入NaOH溶液190mL时,所得沉淀的质量(写出计算过程)。
30、【加试题】赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。
从赤泥中回收钛的工艺流程如下:
请回答以下问题:
(1).赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是__________。
(2).赤泥加一定量水打散的目的是__________。
(3).已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2
Na2TiO3+CO2↑,且Na2TiO3不溶于水。
则Al2O3在烧结中发生的反应是__________,水浸液里的主要溶质有__________。
(4).酸浸时,若使钛的浸出率(η%)达到90%,则根据下图工业上应采取的适宜条件是:
酸浓度和液固比的取值分别约为__________、__________。
同时浸出温度过高可能造成的环境污染是__________。
(5).TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·
xH2O纳米材料,该水解过程的化学方程式是__________。
(6).赤泥中含钛(以TiO2的质量分数表示)一般为4%~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为__________kg。
31、【加试题】回答下列各题:
(1).在一定条件下:
CO(g)+H2O(g)
CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比
充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如图所示。
①R点对应的平衡常数K=__________.
②氢碳比X__________2.0(填“>
”或“<
”或“=”)判断的理由是__________.
③下列能提高CO平衡转化率的措施有__________(填序号)。
A.使用高效催化剂
B.通人He气体使体系的压强增大
C.降低反应温度
D.投料比不变,增加反应物的浓度
(2).已知:
反应Ⅰ:
4NH3(g)+5O2(g)
4NO(g)+6H2O(g)
ΔH<
反应Ⅱ:
4NH3(g)+3O2(g)
2N2(g)+6H2O(g)
氨催化氧化时会发生上述两个竞争反应Ⅰ和Ⅱ.为分析该催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,反应关系如图,该催化剂在高温时选择反应__________(填“Ⅰ”或“Ⅱ”)。
520℃时,4NH3(g)+3O2(g)
2N2(g)+6H2O(g)的平衡常数K=__________(只需列出数字计算式)。
(3).以连二硫酸根(
)为介质,使用间接电化学法可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为__________.
②NO吸收转化后的主要产物为
若通电时电路中转移了0.3mole-则此通电过程中理论上吸收的NO在标准状况下的体积为__________mL.
32、【加试题】苯酚是一种重要的化工原料。
以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)
(1).B的官能团的名称是__________。
(2).已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共振氢谱有3组峰,则C的结构简式____________________。
(3).由D生成N的反应类型是__________,B与C反应生成M的反应类型是__________。
(4).写出M与NaOH溶液反应的化学方程式是____________________________________。
(5).物质F的结构是:
则符合下列条件的F的同分异构体有______种。
①能发生银镜反应
②能与NaHCO3溶液反应
③分子中有苯环,无
结构。
其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:
2:
1的为___________________________________(写结构简式)。
(6).已知:
写出以苯酚、乙醇和ClCH2COOH为原料制备
的合成路线流程图(无机试剂任用)。
答案以及解析
1答案及解析:
答案:
D
解析:
2答案及解析:
B
B本题考查化学实验基本操作:
A项,灼烧碎海带应在坩埚中进行,错误;
C项,用MnO2和浓盐酸制备Cl2需要加热,错误;
D项,吸收尾气中的Cl2要用NaOH溶液,不能用饱和NaCl溶液,错误
3答案及解析:
C
4答案及解析:
5答案及解析:
6答案及解析:
7答案及解析:
A
8答案及解析:
9答案及解析:
10答案及解析:
A.浓硫酸溶于水并放热,且具有强腐蚀性,少量浓硫酸沾在皮肤上,应先用干抹布拭去,再用大量的水冲洗,最后涂上碳酸氢钠溶液,故A错误;
B.中毒者缺氧,应立即将中毒者抬到室外新鲜空气处,故B正确;
C.应先将导管取出,防止发生倒吸,故C错误;
D.含硫酸的废液没有经过处理后不能直接倒入水槽,应先导入废液缸中集中回收处理,故D错误.
故选B.
11答案及解析:
12答案及解析:
13答案及解析:
14答案及解析:
15答案及解析:
花生油和玉米油都属于植物油,植物油多为不饱和酯类,A错误;
溴苯、硝基苯都难溶于水且密度都大于水,环己烷难溶于水但密度比水小,B错误;
分子式为C10H14的单取代芳香烃,符合苯的同系物的通式CnH2n-6,则分子中含有一个苯环和一个丁基(—C4H9),因为丁基有4种结构,故其可能的结构有4种,C正确;
尼龙和涤纶都是通过缩聚反应制得的,有机玻璃(
)是通过加聚反应制得的,D错误。
16答案及解析:
蔗糖水解得到葡萄糖和果糖,麦芽糖水解只生成葡萄糖,A项错误;
蛋白质水解的最终产物为氨基酸,淀粉和纤维素水解的最终产物都是葡萄糖,B项正确,C、D项错误.
17答案及解析:
本题考查弱电解质的电离平衡、盐类水解的原理.A项,醋酸为弱酸,部分电离,0.1mol·
L-1的醋酸中c(H+)小于0.1mol·
L-1,溶液的pH>
1,错误;
B项,据电荷守恒知,0.1mol·
L-1的醋酸中c(H+)=c(CH3COO-)+c(OH-),错误;
C项,0.1mol·
L-1的醋酸溶液中存在电离平衡:
CH3COOH
H++CH3COO-,加入少量CH3COONa固体后,CH3COO-浓度增大,平衡逆向移动,醋酸的电离程度减小,正确;
D项,0.1mol·
L-1醋酸溶液与0.1mol·
L-1NaOH溶液等体积混合后溶液中溶质为CH3COONa,CH3COO-水解,溶液显碱性,错误。
18答案及解析:
19答案及解析:
A、2.24LCl2的物质的量为
由方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,反应中氯元素化合价由0价升高为+1价,由0价降低为﹣1价,氯气起氧化剂与还原剂作用,各占一半,转移电子数目为0.1mol×
×
2×
NAmol﹣1=0.1NA,故A错误;
B、标况下44.8LNO和22.4L氧气混合后生成2molNO2,但NO2中存在平衡:
2NO2⇌N2O4,导致分子个数减少,故反应后气体分子个数小于2NA个,故B错误;
C、二氧化氮和水反应时,3molNO2反应转移2mol电子,生成2mol硝酸,故当生成2mol硝酸时,转移2NA个电子,故C正确;
D、Fe在氧气中燃烧生成Fe3O4,而Fe3O4中Fe元素的价态为+
价,故1molFe在氧气中充分燃烧失去的电子数为
NA,故D错误。
故选:
20答案及解析:
21答案及解析:
由图可知,左侧电极产物为Cl2,Cl-发生氧化反应,故左侧的惰性电极为电解池的阳极,则a为电源的正极,右侧电解产物为H2,H+发生还原反应,故右侧的惰性电极为电解池的阴极,则b为电源的负极,A错误;
阴极发生的反应为2H++2e-
H2↑,阳极发生的反应为2Cl--2e-
Cl2↑,CO(NH2)2+3Cl2+H2O
N2+CO2+6HCl,根据上述反应式可以看出电解—段时间,在阴极消耗的H+的数目与阳极生成的H+的数目相等,阳极室中反应生成的H+通过质子交换膜进入阴极室恰好反应,所以电解前后阴极室中溶液的pH不变,B错误;
由上述分析可知,阳极室发生的反应依次为2Cl--2e-
N2+CO2+6HCl,C错误;
若两极共收集到标准状况下13.44L气体,n(气体)=0.6mol,由反应CO(NH2)2+3Cl2+H2O
N2+CO2+6HCl结合得失电子守恒可知
生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,则除去的尿素的质量为0.12mol×
60g·
mol-1=1.2g,D正确。
22答案及解析:
23答案及解析:
24答案及解析:
25答案及解析:
工业废气中的CO2、SO2能与Ca(OH)2反应生成CaCO3、CaSO3,A项正确;
气体1是不能被过量石灰乳吸收的NO、CO和N2,部分NO与X反应生成NO2,NO和NO2按1:
1的体积比能与NaOH溶液反应生成亚硝酸钠,所以X可以是空气,但不能过量,B项错误;
气体2是没有反应的CO和N2,捕获剂所捕获的气体主要是CO,C项正确;
由题意可知,
与NaNO2反应后生成了N2,两者反应的离子方程式为
D项正确。
26答案及解析:
1.CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
2.—OH、—COOH
3.ad;
4.②⑤;
5.29.15%
27答案及解析:
1.Fe(OH)2;
2.Al3++4OH-
AlO2-+2H2O
3.4Fe(OH)2+O2+2H2O
4Fe(OH)
4.取少量溶液A于试管中,加入过量盐酸酸化,先滴入几滴KSCN溶液,无明显现象,再滴入适量氯水,若溶液变红,则说明含有Fe2+,否則不含
1.加入过量的NaOH溶液时Al3+转化为AlO2-,Fe2+转化为Fe(OH)2沉淀,即沉淀A是Fe(OH)2,在空气中被氧气氧化转化为Fe(OH)3,即沉淀B是Fe(OH)3。
Fe(OH)3和盐酸反应生成FeCl3和水。
溶液A中含有过量的NaOH和生成的NaAlO2,通入CO2生成Al(OH)3沉淀,Al(OH)3和盐酸反应生成AlCl3和水。
根据以上分析可知,沉淀A的化学式为Fe(OH)2。
2.AlCl3溶液与过量NaOH溶液反应的离子方程式为Al3++4OH-
3.沉淀A转化为沉淀B反应的化学方程式为4Fe(OH)2+O2+2H2O
4Fe(OH);
4.亚铁离子具有还原性,检验溶液A中是否含有Fe2+的方法为取少量溶液A于试管中,加入过量盐酸酸化后,先滴入几滴KSCN溶液,无明显现象.再滴人适量氯水,若溶液变红,则说明含有Fe2+,否则不含。
28答案及解析:
1.酸性;
2.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
MnO2,HCl
3.褪色的品红又恢复成红色;
无明显现象;
4.否;
5.吸收尾气,防止污染
29答案及解析:
1.0.4;
2.
当加入NaOH溶液总量达到200mL时,Al(OH)3恰好完全溶解。
Al3+
+
4OH-=
2H2O
0.04mol
0.16mol
Fe3+
+3OH‑=Fe(OH)3↓
0.08mol
0.24mol
NaOH溶液的物质的量浓度为:
(0.16mol+0.24mol)/0.2L=2mol/L
190mLNaOH溶液