浙江省高考理综化学部分第题练习Word下载.docx
《浙江省高考理综化学部分第题练习Word下载.docx》由会员分享,可在线阅读,更多相关《浙江省高考理综化学部分第题练习Word下载.docx(12页珍藏版)》请在冰点文库上搜索。
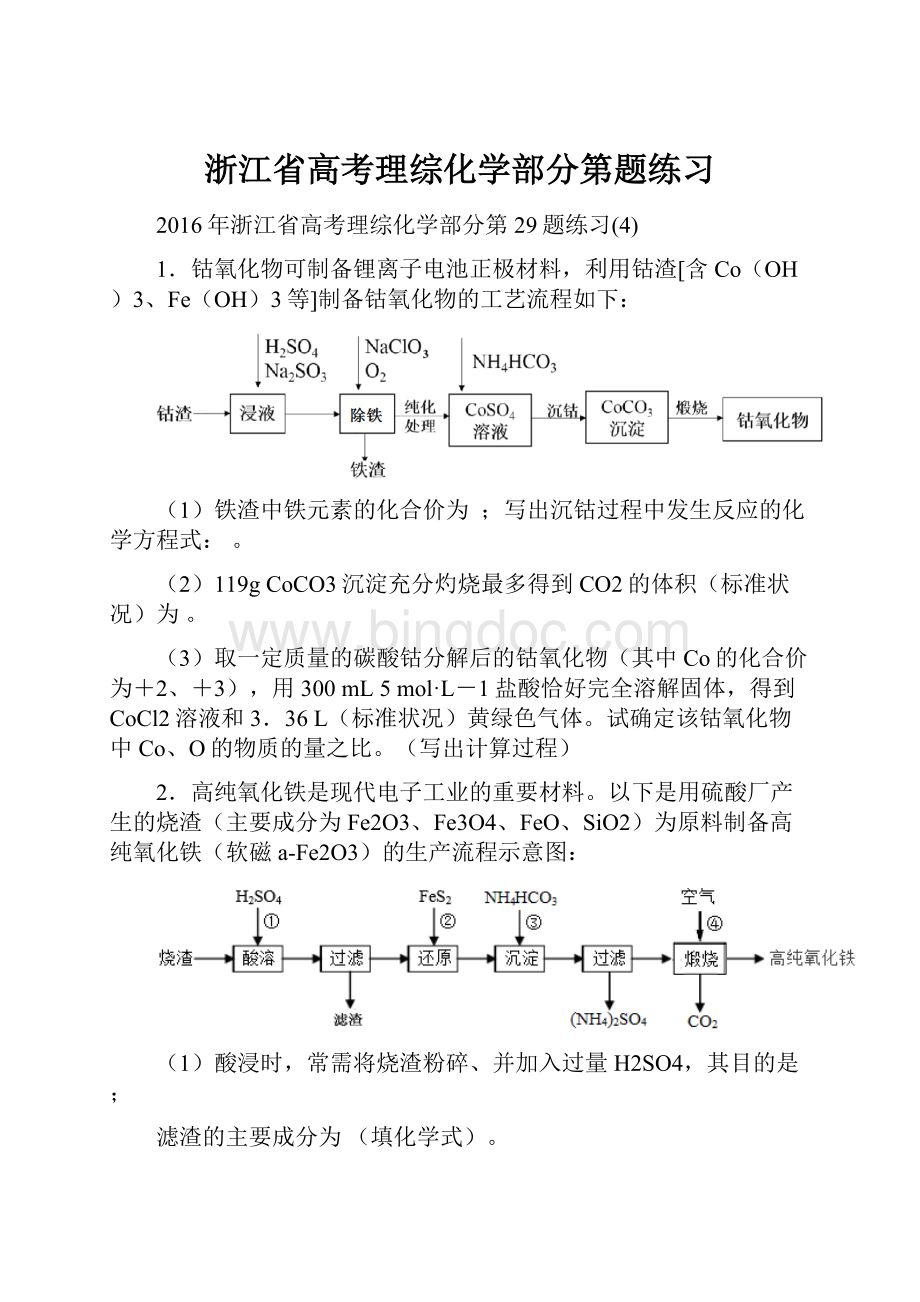
3.兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。
以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为____;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式_____________________________________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是______________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_______________________________;
(5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为____________________________________。
浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:
___________________________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。
请设计简单的回收流程:
浸出液B→_______________________________________。
(示例:
CuO
Cu2+
Cu)
4.某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
序号
试管中的药品
现象
I
1.5mL1mol?
L-1CuSO4溶液和3.5mL1mol?
L-1NaOH溶液混合
开始时有砖红色沉淀A出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体B,溶液呈蓝色
II
L-1CuCl2溶液和3.5mL1mol?
开始时有浅红色沉淀出现,一段时间后,浅红色沉淀消失,静置,生成大量白色沉淀C,溶液呈蓝色
查阅资料如下:
CuCl为白色固体,难溶于水,乙醇、乙酸等,能溶于浓盐酸。
也能溶于浓或稀硝酸溶液,CuCl被氧化。
(1)甲同学通过补充两个实验:
①证明实验Ⅰ中观察到的砖红色沉淀A是Cu2O。
取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈蓝色,则说明砖红色沉淀是Cu2O。
其反应的方程式是_______________________________。
②甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。
向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同。
检验Cu(OH)2洗涤干净的方法是_______________________________。
(2)同学们对白色沉淀的成分继续进行探究。
①请帮助乙同学证明C为CuCl,设计简单的实验方案:
__________________________________________________________________。
②丙同学向洗涤得到的19.9gC中加入足量的稀硝酸,得到蓝色溶液,此过程中反应的离子方程式为:
__________________________________。
向溶解后的溶液中加入足量的AgNO3溶液,过滤、洗涤、干燥,得到27.9g白色沉淀。
这种实验结果___________(偏小、偏大或不变),可能原因是_______________________。
(3)工业上制备CuCl还可以用:
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,倾出部分清液,抽滤出沉淀,沉淀依次用36%的乙酸,无水乙醇洗涤多次,得白色粉末固体,真空或者充氮气保存。
①抽滤出沉淀操作时用到了抽滤瓶、布氏漏斗、______________________等仪器和用品。
②沉淀依次用36%的乙酸,无水乙醇,无水乙醚洗涤多次的目的是__________________。
5.氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
已知:
氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是。
(2)氰化钠与硫代硫酸钠的反应为:
NaCN+Na2S2O3═NaSCN+Na2SO3;
NaSCN中S为-2价,处理1molNaCN,反应中转移电子的物质的量为______。
(3)CN—中C元素显+2价,N元素显—3价,则非金属性N___C(填“<”、“>”或“=”),请设计实验证明:
_____________。
6.氯化锶晶体在工业上常用作铝的缓蚀剂。
工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2?
6H2O)的过程为:
Ⅰ.SrCl2?
6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
Fe(OH)3
Fe(OH)2
开始沉淀的pH
1.5
6.5
沉淀完全的pH
3.7
9.7
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是。
碳酸锶与盐酸反应的化学方程式为__________________。
(2)酸性条件下,加入30%H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为。
能否用新制氯水代替双氧水________(填“能”或“否”)。
(3)在步骤②~③的过程中,将溶液的pH值由1调节至;
宜用的试剂为_______。
A.1.5B.4C.9.7D.氧化钠
E.氢氧化锶粉末F.碳酸钠晶体G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是__________(填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是__________。
(6)步骤⑥中,洗涤氯化锶晶体最好选用___________。
A.水B.稀硫酸C.氢氧化钠溶液D.氯化锶饱和溶液
参考答案
1.
(1)+3;
(2)22.4L(3)由电子守恒:
n(Co3+)=2n(Cl2)=0.3mol由电荷守恒:
n(Co)总=n(Co2+)溶液=0.5n(Cl-)=0.5×
(1.5mol-0.15mol×
2)=0.6mol所以固体中的n(Co2+)=0.6mol-0.3mol=0.3mol
n(O)=(0.3mol×
3+0.3mol×
2)÷
2=0.75mol
故n(Co)∶n(O)=0.6mol∶0.75mol=4∶5
【解析】
试题分析:
(1)浸取时亚硫酸钠把铁和钴的化合物还原为+2价的离子,加氧化剂除铁后钴的价态不变,所以亚铁离子被氧化为铁离子;
反应的产物为CoCO3,硫酸铵等,配平根据碳守恒确定有二氧化碳;
(2)n(CO2)=n(CoCO3)=119/119=1molv(CO2)=22.4L
(3)可以根据两个守恒处理;
由电子守恒:
n(Co3+)=2n(Cl2)=0.3mol;
由电荷守恒:
n(Co)总=n(Co2+)溶液=0.5n(Cl-)=0.5×
故n(Co)∶n(O)=0.6mol∶0.75mol=4∶5
考点:
考查化学计算的有关问题
2.
(1)提高铁元素的浸出率,同时抑制铁离子的水解。
SiO2
(2)FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(3)中和溶液中的酸,调节溶液的pH,使Fe2+全部转化为FeCO3Fe(OH)2取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。
(4)4FeCO3+O2
2Fe2O3+4CO2
(1)将烧渣粉碎是增大接触面加快反应速率,增加硫酸量提高铁元素浸取率,同时抑制铁离子的水解。
二氧化硅不溶解于酸,过滤分离;
(2)根据流程得出还原后的产物为Fe2+和SO42-,根据氧化还原反应原理书写方程式;
(3)煅烧产生二氧化碳可知沉淀为碳酸亚铁,沉淀时pH过高会产生氢氧化亚铁沉淀;
洗涤沉淀的操作是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净。
(4)煅烧时加入空气即氧气参与反应,生成氧化铁和二氧化碳。
考查化学工业流程的原理、实验操作等有关问题
3.
(1)0
(2)2Ni2O3+4H2SO4==4NiSO4+O2↑+4H2O
(3)H2S+2Fe3+==2Fe2++2H++S
(4)不能,因为冷却时,CO能与Ni反应生成Ni(CO)4
(5)2Al+2OH-+2H2O=2AlO2-+3H2↑
因为Al溶于碱液生成AlO2-时在水中存在下列平衡:
AlO2-+2H2O
Al(OH)3+OH-,OH-浓度过小,抑制AlO2-的水解程度过小,所以,产生的Al(OH)3就会沉积下来进而阻止浸出反应的持续进行。
(6)
Al(OH)3
Al2O3
Al。
(1)在Ni(CO)4中,碳元素的化合价与CO相同,为+2价,故Ni的化合价为0;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,说明Ni元素被还原,另外,在硫酸中反应只能是O元素被氧化为O2,故有关镍元素的加压酸浸的化学反应方程式是2Ni2O3+4H2SO4==4NiSO4+O2↑+4H2O;
(3)浸出液A中含有大量的Ni2+、少量的H+和Fe3+,通入H2S时,Fe3+发生还原反应:
H2S+2Fe3+==2Fe2++2H++S;
(4)“高温熔融”时不能将通入氩气换为通入CO,因为冷却时,CO能与Ni反应生成Ni(CO)4;
(5)“碱浸”的目的是溶解镍铝合金中的Al,使镍产生多孔结构,从而增强对氢气的强吸附性,Al溶于NaOH溶液时发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
浸出反应所用NaOH溶液的浓度要大,因为Al溶于碱液生成AlO2-时在水中存在下列平衡:
Al(OH)3+OH-,OH-浓度过小,抑制AlO2-的水解程度过小,所以,产生的Al(OH)3就会沉积下来进而阻止浸出反应的持续进行。
(6)浸出液B中存在AlO2-,首先要将AlO2-沉淀下来,一般是通入足量的CO2生成Al(OH)3,然后脱水生成Al2O3,最后将Al2O3在熔融的状态下电解即可得到金属铝(加入冰晶石可以降低Al2O3的熔点)。
4.【答案】
(1)①2Cu2O+SO2=CuSO4+3Cu②取适量的最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净
(2)①白色沉淀C
白色沉淀溶解
出现白色沉淀
②3CuCl+4H++NO3-=3Cu2++NO↑+2H2O+3Cl-
偏小
AgCl在干燥过程中有少量分解(其它合理答案也可)
(3)①玻璃棒、滤纸
②36%的乙酸是为了除去CuCl沉淀表面的酸和钠盐;
无水乙醇是为了除去乙酸和水,快速干燥,防止氧化
实验I和II的不同点是配制Cu(OH)2的溶液时铜盐的阴离子不同,导致现象不同。
在实验II中,白色沉淀C的生成一定与Cl-有关,试题给出了CuCl的一些性质,是解决问题的关键。
(1)①Cu2O固体加蒸馏水,通入SO2,试管底部有少量紫红色固体Cu,溶液呈蓝色Cu2+,说明Cu2O发生了歧化反应,同时SO2被氧化。
故反应的方程式是2Cu2O+SO2=CuSO4+3Cu;
②甲同学重新作实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净,防止Cu(OH)2中含有Cl-,故适量的取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净。
(2)①由实验流程可知:
后面实验加入蒸馏水得到白色沉淀分析铜盐只要CuCl,开始是CuCl被溶解,能够溶解的试剂有浓盐酸和硝酸溶液;
而CuCl溶于硝酸后生成Cu(NO3)2溶液,再加入蒸馏水,不会白色沉淀溶解,故先加入的是浓盐酸。
②CuCl溶于稀硝酸,产生了气体NO,CuCl中的铜元素被氧化;
有CuCl~AgCl可知:
m(AgCl)=
=28.7g,而实际沉淀为27.9g,偏小,说明AgCl有损失,指出损失的合理原因即可。
(3)抽滤出沉淀操作时用到了抽滤瓶、布氏漏斗及玻璃棒、滤纸等;
因为Na2SO3与CuCl2反应为Na2SO3+2CuCl2+H2O=Na2SO4+2CuCl+2HCl,故过滤后残留在CuCl表面是钠盐和酸,用36%的乙酸是为了除去这些杂质,而后无水乙醇是为了除去乙酸和水,快速干燥,防止氧化。
5.
(1)CN-+H2O2+H2O=HCO3-+NH3↑
(2)4mol
(3)>;
取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;
(4)安全瓶,防止倒吸;
Na2SO3(5)NaOH溶液
(6)滴入最后一滴硝酸银溶液,出现淡黄色沉淀(7)否
(1)常温下,氰化钠能与过氧化氢溶液反应,生成能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,根据原子守恒可知生成的酸式盐为碳酸氢钠,反应的离子方程式为CN-+H2O2+H2O=HCO3-+NH3↑;
(2)处理1molNaCN的同时消耗1molNa2S2O3,该反应中S元素化合价由+2价变为-2价,得到4个电子,则反应中转移4mol电子;
(3)CN—中C元素显+2价,N元素显-3价,说明N非金属性强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,其检验方法为:
(4)二氧化硫易溶于水,b装置为安全瓶,防止倒吸;
d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;
(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-反应生成AgI黄色沉淀,说明反应到达滴定终点;
(7)消耗AgNO3的物质的量为1.50×
10-3L×
0.0001mol/L=1.50×
10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×
10-7mol×
2×
49g/mol=1.47×
10-5g,废水中氰化钠的含量为
=0.735mg/L>0.50mg/L,所以没有达到排放标准。
考查氧化还原反应、物质制备实验、物质含量测定等实验设计
6.
(1)加快反应速率;
SrCO3+2HCl=SrCl2+H2O+CO2↑
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;
能(3)B;
EG
(4)Fe(OH)3、BaSO4(5)温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去(6)D
以SrCO3为原料制备六水氯化锶,由流程图可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2?
6H2O。
(1)把碳酸锶粉碎并加以搅拌,其目的是加快反应速率;
碳酸锶与盐酸反应的化学方程式为SrCO3+2HCl=SrCl2+H2O+CO2↑;
(2)酸性条件下,加入30%H2O2溶液,将Fe2+氧化成Fe3+,同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
新制氯水也能把亚铁离子氧化铁离子,且不引入杂质,因此可以用新制氯水代替双氧水。
(3)由表中数据可知,Fe3+在pH=1.5时开始沉淀,在pH=3.7时沉淀完全,故在步骤②~③的过程中,将溶液的pH值由1调节至≥3.7,使Fe3+转化氢氧化铁沉淀,且不引入新杂质,可以选择氢氧化锶粉末或氧化锶粉末;
(4)由于前面加入了稀硫酸,故有硫酸钡生成,水解可生成氢氧化铁沉淀,所以沉淀有两种即BaSO4、Fe(OH)3;
(5)由于温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去六水氯化锶晶体,因此用热风吹干六水氯化锶选择的适宜温度范围是50~60℃;
(6)根据溶解平衡,且不能引入新杂质,步骤⑥宜选用的洗涤剂是饱和氯化锶溶液,答案选D。