化学平衡高考真题文档格式.docx
《化学平衡高考真题文档格式.docx》由会员分享,可在线阅读,更多相关《化学平衡高考真题文档格式.docx(31页珍藏版)》请在冰点文库上搜索。
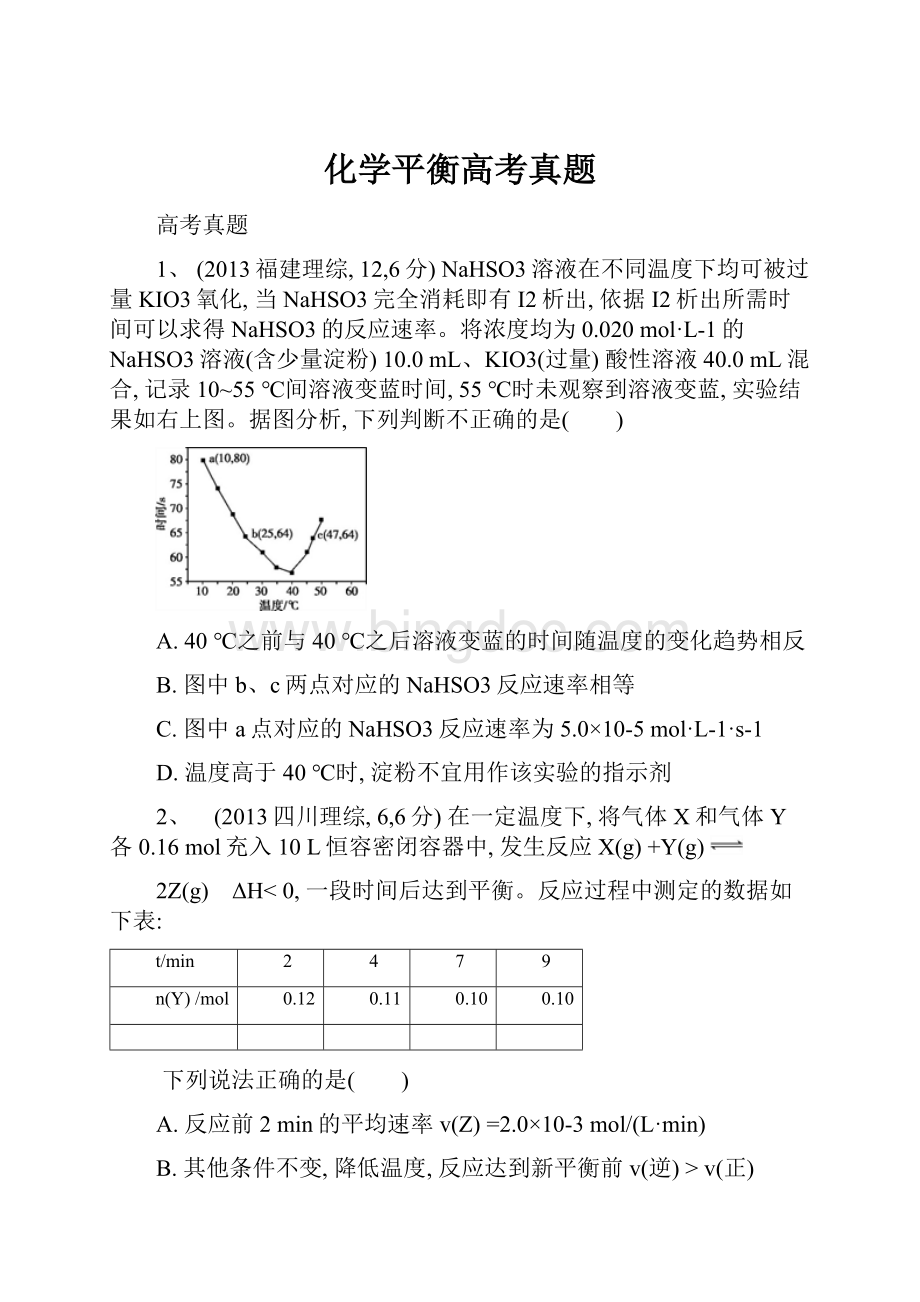
A.2.5μmol·
min-1和2.0μmol·
L-1
B.2.5μmol·
min-1和2.5μmol·
C.3.0μmol·
min-1和3.0μmol·
D.5.0μmol·
5、(2009福建,12,6分)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。
反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。
在一定温度下,获得如下实验数据:
实验
序号
初始浓度c/mol·
溴颜色消失
所需时间t/s
CH3COCH3
HCl
Br2
①
②
③
④
0.80
1.60
0.20
0.40
0.0010
0.0020
290
145
580
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
6、 (2010全国Ⅰ,27,15分)在溶液中,反应A+2B
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。
所改变的条件和判断的理由是:
② ;
③ ;
(2)实验②平衡时B的转化率为 ;
实验③平衡时C的浓度为 ;
(3)该反应的ΔH 0,其判断理由是
;
(4)该反应进行到4.0min时的平均反应速率:
实验②:
vB= ;
实验③:
vC= 。
7、 (2013北京理综,11,6分)下列实验事实不能用平衡移动原理解释的是( )
A.
B.
t/℃
25
50
100
KW/10-14
1.01
5.47
55.0
C.
D.
c(氨水)/(mol·
L-1)
0.1
0.01
pH
11.1
10.6
8、 (2013大纲全国)反应X(g)+Y(g)
0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大
9、 (2013安徽理综,11,6分)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>
0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项
x
y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
10、 (2013江苏单科,15,4分)一定条件下存在反应:
CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。
现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molCO和1molH2O,在Ⅱ中充入1molCO2和1molH2,在Ⅲ中充入2molCO和2molH2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
11、 (2012全国,8,6分)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO2(g)+H2(g) ΔH<
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
12、(2012重庆理综,13,6分)在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)
2c(g);
ΔH1<
0x(g)+3y(g)
2z(g);
ΔH2>
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
13、 (2011天津,6,6分)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是( )
A.反应在c点达到平衡状态B.反应物浓度:
a点小于b点
C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:
a~b段小于b~c段
14、 (2011福建,12,6分)25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>
D.25℃时,该反应的平衡常数K=2.2
15、 (2011安徽,9,6分)电镀废液中Cr2
可通过下列反应转化成铬黄(PbCrO4):
Cr2
(aq)+2Pb2+(aq)+H2O(l)
2PbCrO4(s)+2H+(aq) ΔH<
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
16、 (2010重庆,10,6分)COCl2(g)
CO(g)+Cl2(g);
ΔH>
0。
当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
17、 (2010安徽,10,6分)低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)ΔH<
在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
18、 (2009重庆,13,6分)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
19、 (2013福建理综,23,16分)利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·
M2O3·
2RO2·
nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为 。
②常温下,不能与M单质发生反应的是 (填序号)。
a.CuSO4溶液b.Fe2O3c.浓硫酸d.NaOH溶液e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:
H2S(g)
H2(g)+
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。
以H2S起始浓度均为cmol·
L-1测定H2S的转化率,结果见下图。
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。
据图计算985℃时H2S按上述反应分解的平衡常数K= ;
说明随温度的升高,曲线b向曲线a逼近的原因:
。
②电化学法
该法制氢过程的示意图如下。
反应池中反应物的流向采用气、液逆流方式,其目的是 ;
反应池中发生反应的化学方程式为 。
反应后的溶液进入电解池,电解总反应的离子方程式为 。
20、 (2012课标,27,15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3kJ·
mol-1、-285.8kJ·
mol-1和-283.0kJ·
mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g)
Cl2(g)+CO(g) ΔH=+108kJ·
mol-1。
反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T
(2)与第8min反应温度T(8)的高低:
T
(2) T(8)(填“<
”“>
”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·
L-1;
④比较产物CO在2—3min、5—6min和12—13min时平均反应速率[平均反应速率分别以v(2—3)、v(5—6)、v(12—13)表示]的大小 ;
⑤比较反应物COCl2在5—6min和15—16min时平均反应速率的大小:
v(5—6) v(15—16)(填“<
”或“=”),原因是 。
21、 (2013重庆理综,7,6分)将E和F加入密闭容器中,在一定条件下发生反应:
E(g)+F(s)
2G(g)。
忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
①b<
f②915℃、2.0MPa时E的转化率为60%
③该反应的ΔS>
0④K(1000℃)>
K(810℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
22、 (2012天津理综,6,6分)已知2SO2(g)+O2(g)
2SO3(g) ΔH=-197kJ·
向同温、同体积的三个密闭容器中分别充入气体:
(甲)2molSO2和1molO2;
(乙)1molSO2和0.5molO2;
(丙)2molSO3。
恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:
p甲=p丙>
2p乙
B.SO3的质量m:
m甲=m丙>
2m乙
C.c(SO2)与c(O2)之比k:
k甲=k丙>
k乙
D.反应放出或吸收热量的数值Q:
Q甲=Q丙>
2Q乙
23、 (2012江苏单科,14,4分)温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经过一段时间后达到平衡。
反应过程中测定的部分数据见下表:
t/s
150
250
350
n(PCl3)/mol
0.16
0.19
A.反应在前50s的平均速率v(PCl3)=0.0032mol·
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·
L-1,则反应的ΔH<
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>
v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
24、 (2012安徽理综,9,6分)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
25、 (2012四川理综,12,6分)在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:
2SO2+O2
2SO3;
ΔH<
当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。
下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.达到平衡时,SO2的转化率为90%
26、 (2011全国,8,6分)在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10% C.15% D.20%
27、 (2011北京,12,6分)已知反应:
2CH3COCH3(l)
CH3COCH2COH(CH3)2(l)。
取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,CH3COCH3的
>
1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
=1
28、 (2010北京,12,6分)某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=
。
该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度
甲
乙
丙
c(H2)/mol/L
0.010
0.020
c(CO2)/mol/L
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
29、 (2009宁夏,13,6分)在一定温度下,反应
X2(g)
HX(g)的平衡常数为10。
若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5% B.17% C.25% D.33%
30、 (2009全国Ⅰ,13,6分)下图表示反应X(g)
4Y(g)+Z(g),ΔH<
0,在某温度时X的浓度随时间变化的曲线:
下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
31、(2013课标Ⅱ,28,14分)在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)
B(g)+C(g) ΔH=+85.1kJ·
mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
1
8
16
20
30
总压强p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ,平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算:
a= 。
反应时间t/h
c(A)/(mol·
a
0.026
0.0065
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是 ,由此规律推出反应在12h时反应物的浓度c(A)为 mol·
L-1。
模拟练习
1、 (2013北京通州摸底,17)两体积相同的密闭容器中均充入1molX和1molY,分别于300℃和500℃开始发生反应:
X(g)+Y(g)
3Z(g)。
Z的含量(Z%)随时间t的变化如右图所示。
已知在t3时刻改变了某一实验条件。
A.曲线a是500℃时的图像B.正反应是吸热反应
C.t3时刻可能是增大了压强D.t3时刻可能是降低了温度
2、 (2013北京海淀期末,11)在密闭容器中进行反应:
A(g)+3B(g)
2C(g)。
有关下列图像的说法不正确的是( )
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的ΔH<
0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH>
3、 (2013北京丰台期末,10)在恒容密闭容器中,由CO合成甲醇:
CO(g)+2H2(g)
CH3OH(g)。
在其他条件不变的情况下,研究温度对平衡的影响,实验结果如下图所示,下列说法正确的是( )
A.平衡常数K=
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的反应速率
D.处于A点的反应体系从T1变到T2,达到平衡时
增大
4、 (2013北京朝阳一模,11)已知:
H2(g)+I2(g)
2HI(g) ΔH=-14.9kJ/mol。
某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。
甲中反应达到平衡时,测得c(H2)=0.008mol/L。
c(H2)/mol/L
c(I2)/mol/L
c(HI)/mol/L
0.02
下列判断正确的( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
5、 (2012北京朝阳一模,