高中常见气体的制备方法.doc
《高中常见气体的制备方法.doc》由会员分享,可在线阅读,更多相关《高中常见气体的制备方法.doc(7页珍藏版)》请在冰点文库上搜索。
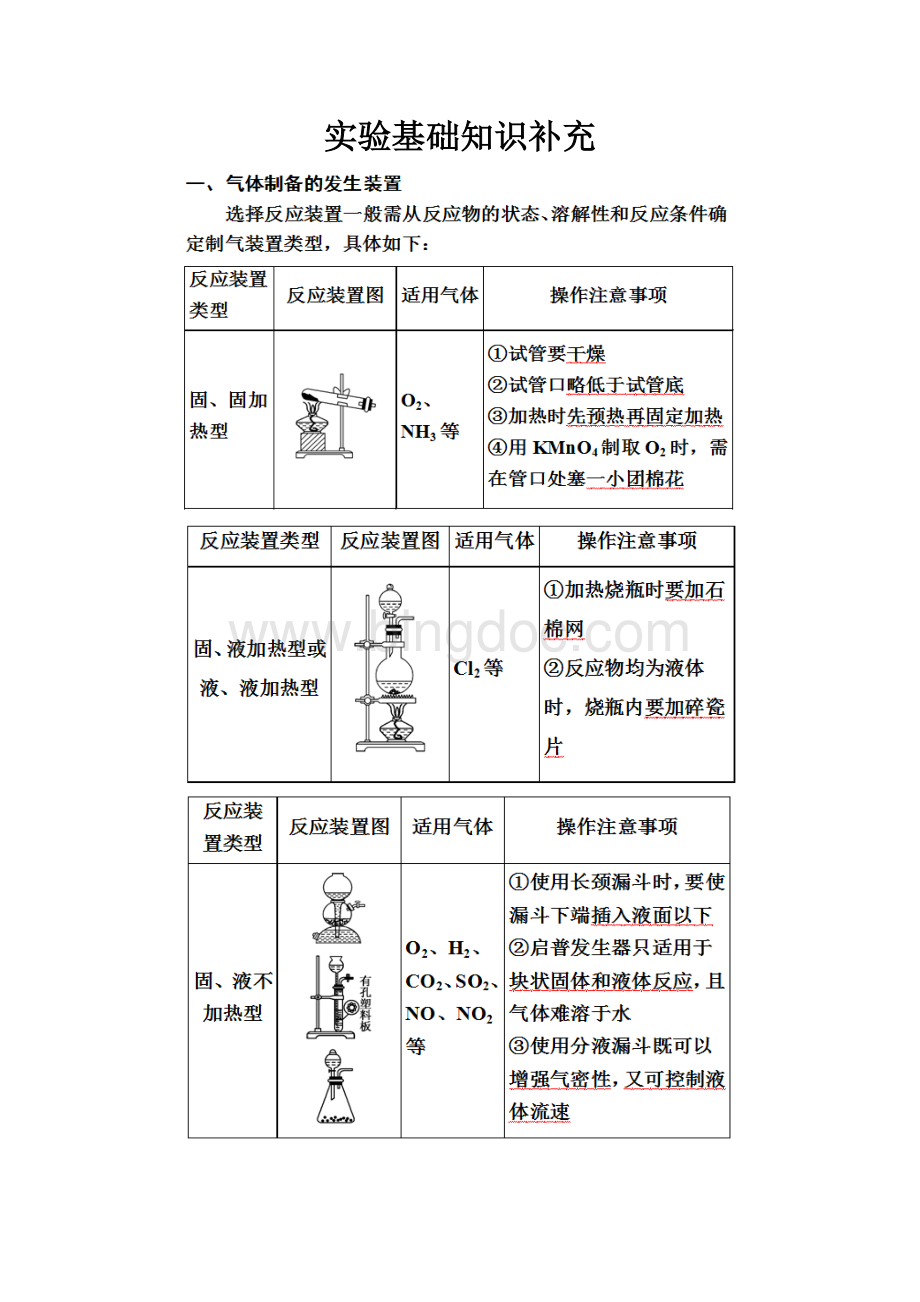
实验基础知识补充
二、常见气体的制备方法(前6个最常考,有下划线的必须熟记)
1.氨气
(1)工业制法 (合成氨工业):
N2+3H2 2NH3
(2)实验室制法 (氯化铵和消石灰混合加热):
2NH4Cl+Ca(OH)2 CaCl2+2NH3 ↑+2H2O
说明:
试管口棉花的作用是支撑固定导管,且减少NH3与空气的对流,提高氨气的纯度。
(3)实验室快速制氨法:
浓氨水滴入到生石灰(或烧碱或碱石灰)表面快速产生氨气。
2.氯气
(1)工业制法
①电解饱和食盐水得到烧碱、氢气和氯气:
2NaCl+2H2O2NaOH +H2↑+ Cl2↑
②冶炼钠(或镁)时得到金属和氯气:
2NaCl(熔融) 2Na + Cl2↑
(2)实验室制法
①KMnO4常温氧化浓盐酸:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2加热氧化浓盐酸:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (与稀盐酸不反应)
3.二氧化硫
(1)工业制法
①高温煅烧硫铁矿:
4FeS2+11O2 2Fe2O3+8SO2
②火法炼铜得到副产物二氧化硫:
Cu2S+O2 2Cu+SO2
③燃烧硫磺得到二氧化硫:
S+O2 SO2
(2)实验室制法
①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (向上排空气法收集)
②Na2SO3+ H2SO4(70%)=Na2SO4+H2O+SO2 ↑
说明:
1、浓硫酸的浓度过高会使得溶液中没有H+,反应无法发生;硫酸浓度过低,生成的
SO2与水反应并溶解在溶液中。
2、B装置的作用是验证SO2具有还原性;B装置中的现象是紫红色褪色或颜色变浅;
离子方程式为5SO2+2MnO+2H2O===5SO+2Mn2++4H+
3、C装置的作用是验证SO2的氧化性;现象是溶液中产生黄色浑浊
4.氯化氢
(1)工业制法 (氢气在氯气中燃烧):
H2+Cl2 2HCl
(2)实验室制法
①2NaCl+H2SO4(浓) Na2SO4+2HCl ↑
②浓硫酸滴入到浓盐酸中快速制备HCl气体。
5.一氧化氮
(1)工业制法 :
①氨的催化氧化(硝酸工业的第一步反应):
4NH3+5O2 4NO+6H2O
②NO2溶于水制硝酸的副产物:
3NO2+H2O=2HNO3+NO
(2)实验室制法 :
3Cu+8 HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
6.二氧化氮
(1)工业制法 (硝酸工业的第二步反应):
2NO+O2=2NO2
(2)实验室制法:
Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (向上排空气法收集)
7.乙烯
(1)工业制法 (石油裂解制乙烯):
C4H10C2H6+C2H4 C8H18 C6H14+C2H4
(2)实验室制法(乙醇的消去反应 ) :
CH3CH2OH CH2=CH2 ↑+H2O
8.乙炔
实验室制法(电石水解法):
CaC2+2H2O = Ca(OH)2+C2H2 ↑
9.氢气
(1)工业制法
①水煤气法:
(高温还原水蒸气) C+H2O(g) CO+H2
②氯碱工业的副产物:
(电解饱和食盐水) 2NaCl+2H2O2 NaOH +H2↑+ Cl2↑
(2)实验室制法
①金属与非氧化性强酸反应:
Zn+H2SO4 = ZnSO4+H2↑
②金属与强碱溶液反应:
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
10.氧气
(1)工业制法:
①分离液态空气法
②电解氧化铝得到副产物氧气:
2Al2O3(熔融)4Al+3O2 ↑
③冶炼金属汞、银时得到副产物氧气:
2HgO 2Hg+O2↑;2Ag2O 4Ag+O2↑
(2)实验室制法
①高锰酸钾受热分解:
2KMnO4 K2MnO4+MnO2+O2↑ (固加热)
②氯酸钾受热分解:
2KClO3 2KCl + 3O2↑(固+固加热)
③双氧水催化分解:
2H2O22H2O+O2↑ (固+液不加热)
11.二氧化碳
(1)工业制法
①高温分解,煅烧大理石:
CaCO3 = CaO+CO2 ↑
②玻璃工业副产物:
SiO2+Na2CO3 = Na2SiO3+CO2 ↑;SiO2+CaCO3 = CaSiO3+CO2 ↑
③联碱工业小苏打制纯碱的副产物:
2NaHCO3 = Na2CO3+H2O+CO2 ↑
(2)实验室制法:
CaCO3+2HCl=CaCl2+H2O+CO2↑
12.一氧化碳
(1)工业制法
①水煤气法(高温条件下还原水蒸气):
C+H2O(g) CO+H2
②焦炭还原二氧化硅(工业制粗硅的副产物):
2C+SiO2 = Si+2CO↑
(2)实验室制法
①草酸分解法:
H2C2O4 CO↑+CO2 ↑+H2O ,混合气体通过碱石灰得到一氧化碳
②甲酸分解法:
HCOOH CO↑+H2O
三、防倒吸装置
1、吸不满
2、吸不着
3、不愿吸(将硫酸换成水呢?
可以。
将CCl4换成苯呢?
不行)